

导读:近年来,法洛四联症(TOF)手术后的长期生存率持续提高。然而,残留的血流动力学和电生理异常在成年期很常见。肺动脉瓣返流(PR)是TOF术后最常见的血流动力学障碍。此外,残余RVOT狭窄、肺动脉(PA)分支狭窄、残余房间隔缺损(ASD)或室间隔缺损(VSD)、TR、右心室(RV)扩张和功能障碍、主动脉扩张、AR(主动脉瓣返流)和左心室(LV)功能障碍也是TOF修复患者经常遇到的解剖和功能异常。TOF 修复的患者会面临房性(20%)和室性(15%)心律失常、运动不耐受、心衰和心源性猝死(SCD发生率约为每十年 2%)等并发症。TOF 的手术修复随着时间的推移而发展,右心室流出道(RVOT)阻塞的缓解通常涉及漏斗部切开术、阻塞性肌束的切除以及使用补片来扩大从右心室到肺动脉的通路,这些操作会导致疤痕组织,并在RVOT中产生运动障碍且通常是动脉瘤区域。

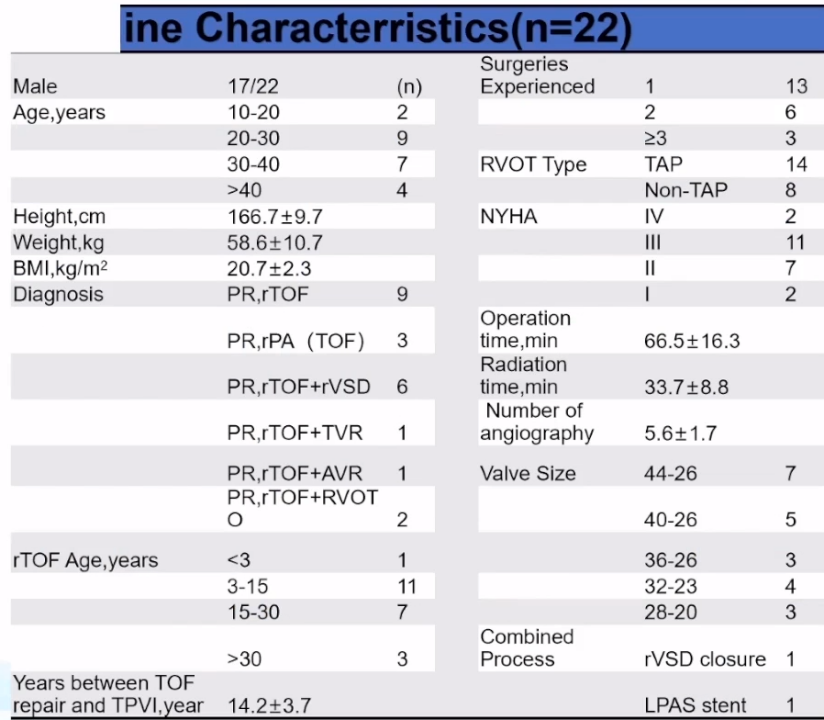
华中科技大学同济医学院附属协和医院尚小珂教授以“经导管窄腰肺动脉瓣治疗自体肺动脉瓣返流-协和经验”为题做汇报,他提到国内TOF手术广泛使用跨环补片(>85%),远期PR、肺动脉/右室流出道(MPA/RVOT) Aneurysm多见。国内每年约完成10000台TOF根治术,大部分可能在10-30年后面临大量PR需要进行肺动脉瓣置换术(PVR)。
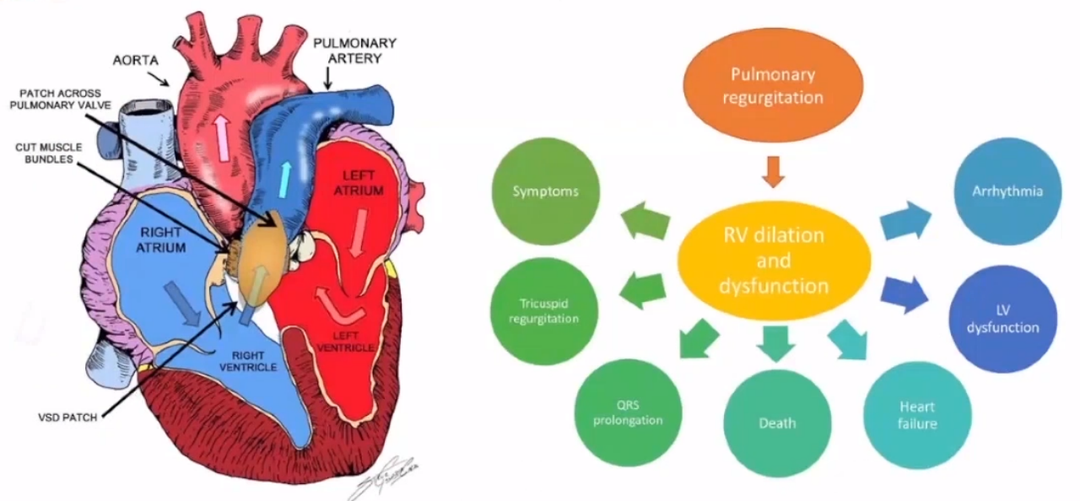
尚教授介绍了经导管肺动脉瓣置换术(TPVR)的发展历程,尤其对国内外的球囊扩张式瓣膜,球扩式经导管肺动脉瓣,自膨式经导管肺动脉瓣和异位分支肺动脉瓣做介绍,并着重分享了该院的首例窄腰肺动脉瓣手术病例和医院经验。
(一)球囊扩张式瓣膜
Philipp Bonhoeffer于2000年首次报道Bonhoeffer牛颈静脉瓣、铂铱合金支架。国外绝大多数为法洛四联症术后的患者再狭窄是主要原因,大部分使用球囊扩张式瓣膜。
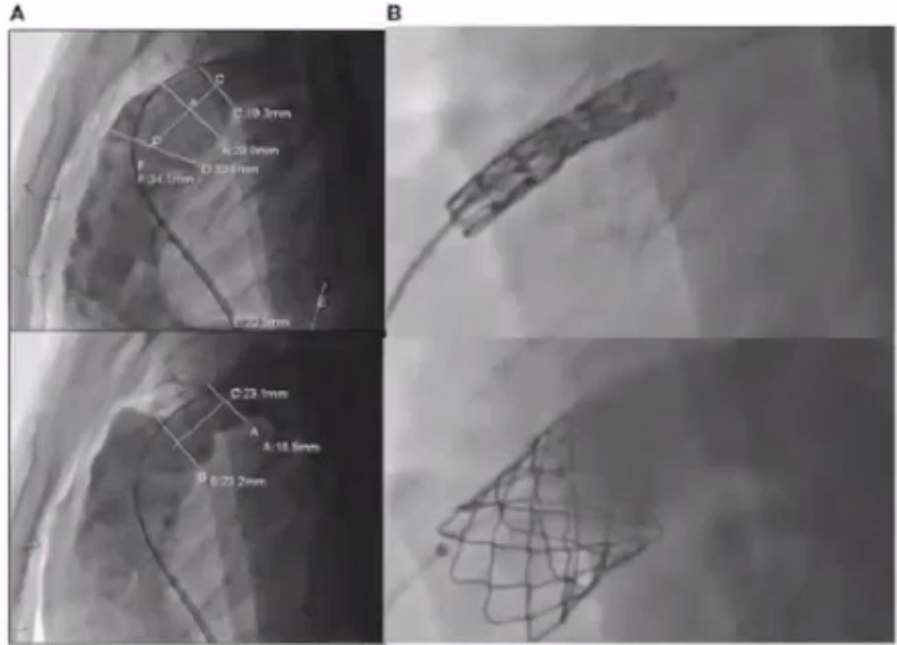
在《2018 AHA/ACC 成人先天性心脏病管理指南:美国心脏病学会/美国心脏协会临床实践指南工作组的报告》文章中,报道了目前明确的PR干预指征:有症状患者Ⅰ类指征;无症状患者合并明显右室扩大和收缩功能下降、三尖瓣返流(TR)、QRS增宽、心律失常等:Ⅱ类指征。
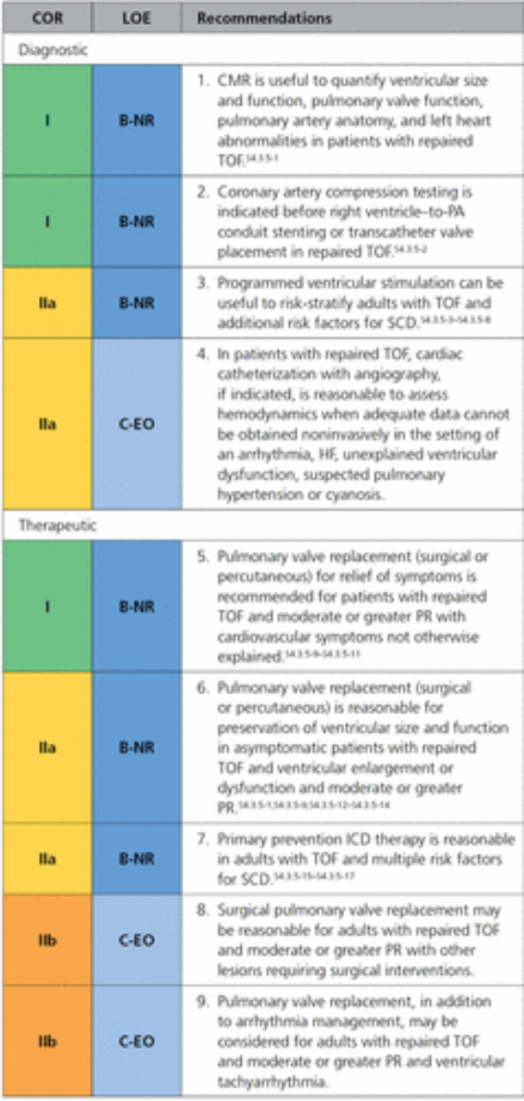
对于其他需要接受手术的病变如TR、分支狭窄、VSD、AR、腹主动脉瘤(AAA)、PCI、经导管射频消融术(RFCA)等,同期PVR可能是合理的。单纯PVR并不一定能降低VT(室性心动过速)和SCD风险,高危者需考虑射频消融或ICD植入。
《欧洲心脏杂志》发表的《2020ESC成人先天性心脏病治疗指南》文章,对于法洛四联症修复后干预治疗的建议如下:
1.有症状且合并严重PR和/或减至少中度RVOTO的患者建议行PVRep,证据分级Ⅰ,推荐水平C;
2.对于没有先天流出道的患者,在解剖条件可行的前提下更推荐经导管介入治疗(TPVI),证据分级Ⅰ,推荐水平C;
3.无症状且合并严重PR和/或RVOTO的患者当存在以下标准之一时应当考虑PVRep:客观的运动能力指标下降;RV进行性扩大至RVESVi≥80mL/m²,和/或RVEDVi≥160mL/m²,和/或TR进行性进展至至少中度;RV收缩功能进行性减退;RVOTO合并RVSP>80mmHg;证据分级Ⅱa,推荐水平C。
指南对于右心室至肺动脉导管介入治疗建议推荐如下:
1.有症状的RVSP>60mmHg(流量减少时可能更低)和/或严重PRc的患者,如果解剖上可行,应优先进行导管介入(TPVI)干预;推荐等级Ⅰ,证据级别C;
2.如果解剖上可行,且至少存在以下一个标准,则应考虑对无症状严重右室流出道梗阻和/或严重PR的患者进行干预,最好是导管介入(TPVI):运动能力下降(CPET);RV逐渐扩张至RVESVi>80mL/m²,和/或RVEDVi>160mL/m²,和/或TR至少进展至中度;进行性RV收缩功能障碍;RVSP>80mmHg;推荐等级Ⅱa,证据级别C。
目前观点如下:
1.TPVR已成为可替代SPVR(外科肺动脉瓣置换术)的安全有效的手术方式;
2.对于解剖结构合适rTOF合并重度PR患者TPVR可作为治疗首选;
3.当技术可行时,TPVI治疗的5年长期结局与SPVR相当,延长右心室导管的寿命,降低患者再次手术的次数;
4.新型产品有望继续扩大TPVR手术的解剖指征。
(二)球扩式经导管肺动脉瓣
TPVR以Medtronic Melody瓣膜(牛颈静脉瓣+铂铱合金支架)植入例数最多。Edwards Sapien为第二款球扩瓣(牛心包瓣+钴铬合金支架)。
(三)自膨式经导管肺动脉瓣
Medtronic Harmony已完成20例人体植入和2年随访。自膨胀式肺瓣Pulsta Valve,已完成10例人体植入。Alterra Adaptive Prestent支架,完成了第1例人体试验。
(四)异位分支肺动脉瓣
双侧分支肺动脉瓣/单侧分支延续支架+开窗(Melody/Sapian)。2018年报告34例(美国多中心,18例双侧、16例单侧)、7例(密歇根州,双侧)。方案可行,但失败率及死亡率偏高。
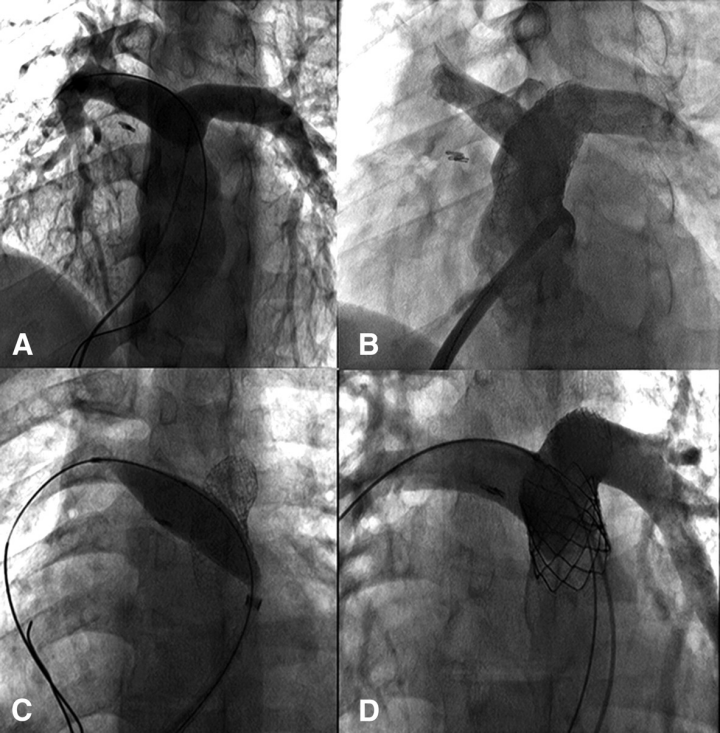
1.Venus P自膨式经导管肺动脉瓣
Venus P为首款自膨式经导管肺动脉瓣,首例植入于2014年于上海中山医院完成,国内临床试验在6家中心完成55例植入,全世界16个国家27个中心完成了220多例植入。此外,已完成CE mark临床研究入组(80例)。正在开展FDA的IDE研究型号选择标准为肺动脉瓣环直径+2-4mm。
PT-Valve是国内第二款自膨式经导管肺动脉瓣膜,正在开展多中心正式临床(已完成10+例),它是对称性镍钛合金框架,支架两端柔软、中部瓣位小而硬,流出端与中部半不连续,放射标记及释放锚,猪心包全覆盖,猪心包瓣叶和密封膜,21F-12F输送系统。
PT-Valve标准释放方法如下图所示,释放过程中反复造影确认准确位置。
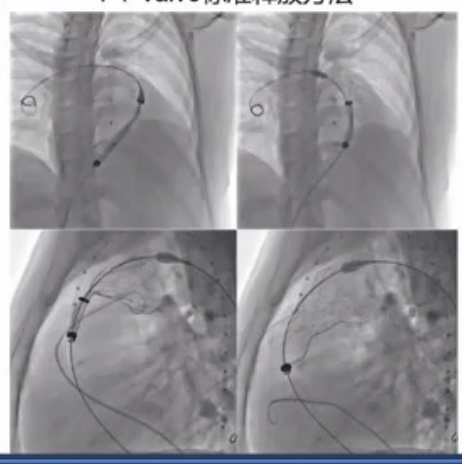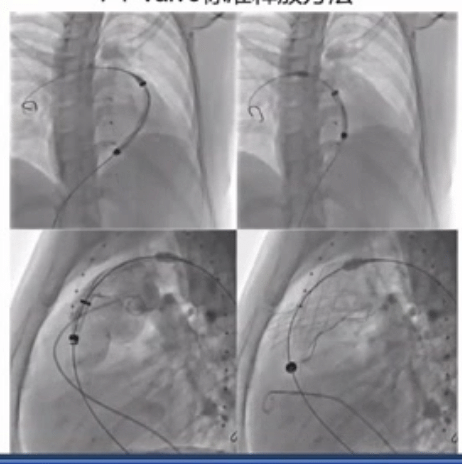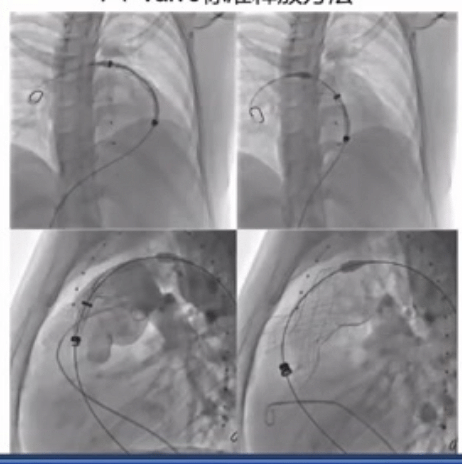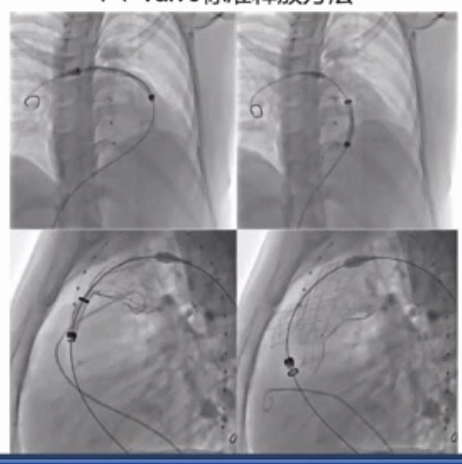
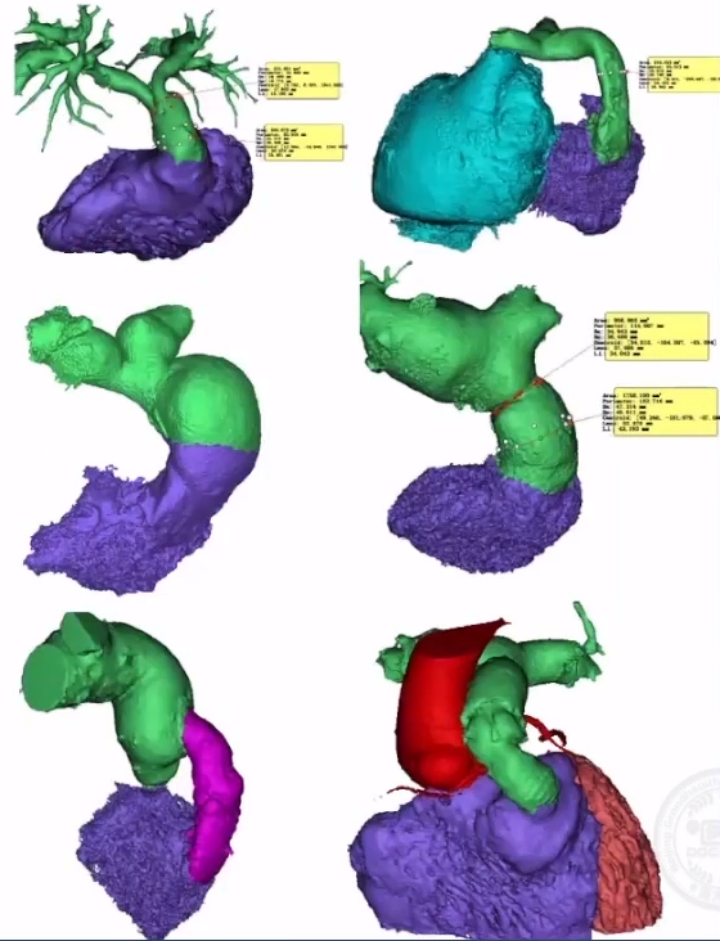
RVOT的形态复杂,在《患者特定的重建解剖结构和计算机模拟是选择医疗器械治疗的基础:应用于新的经皮肺动脉瓣》这篇文章中看到,研究将62 名患者的 RVOT 按形态类型分组:Ⅰ型43例(69.3%),Ⅱ型9例(14.5%),Ⅲ型1例(1.6%),Ⅳ型7例(11.3%),Ⅴ型2例(3.2%)。

基于3D重建的多水平测量的标准铆定方式与释放部位是一种不错的方式,共有7个平面来决定肺动脉瓣膜置换的尺寸和位置:远端分叉、肺动脉中部、窦管交界、窦部、解剖瓣环、流出道瘤和肌性出口。
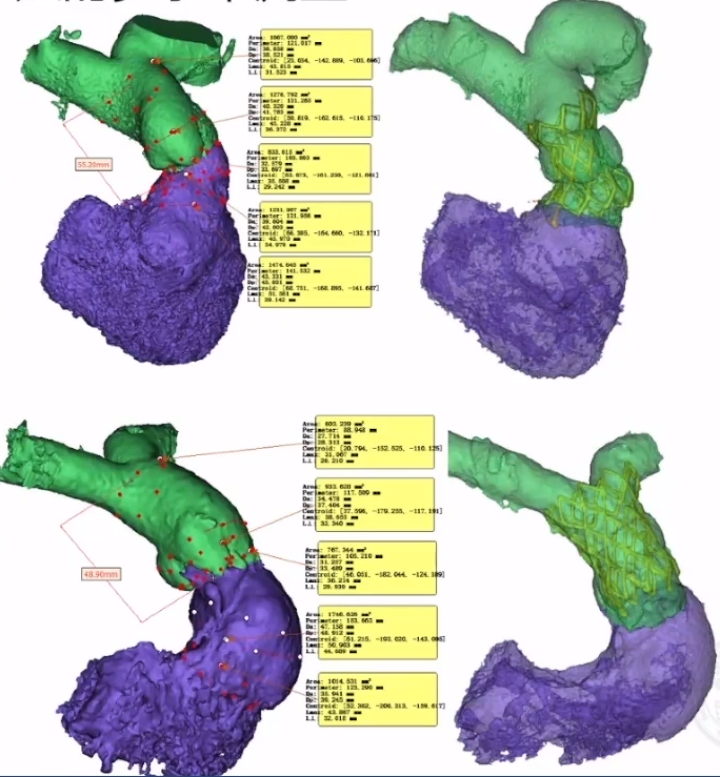
主要铆定方式利用解剖学相对狭窄处,包括瓣环固定,花冠悬挂、窦管交界和右室流出道联合固定,以及肺动脉瘢痕固定。
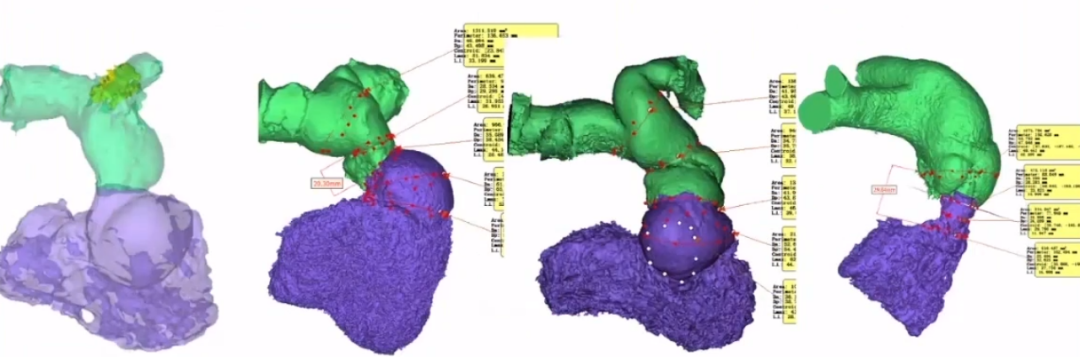
其他特殊铆钉方式还分为:分叉内铆定/近端抵流出道,流出道铆定。
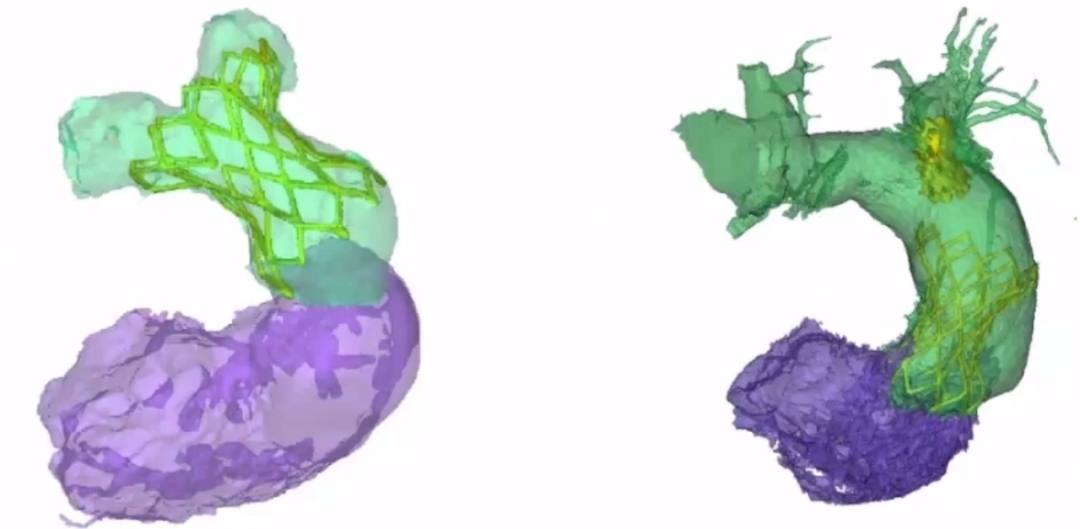
2.窄腰肺动脉瓣
窄腰肺动脉瓣的设计优势是:冠脉压迫风险更低;支架中段腰部不被压缩,不影响瓣膜性能及耐久性;型号选择不依赖瓣环,解剖适应证不受瓣环直径限制(半数病例瓣环33-46mm)。
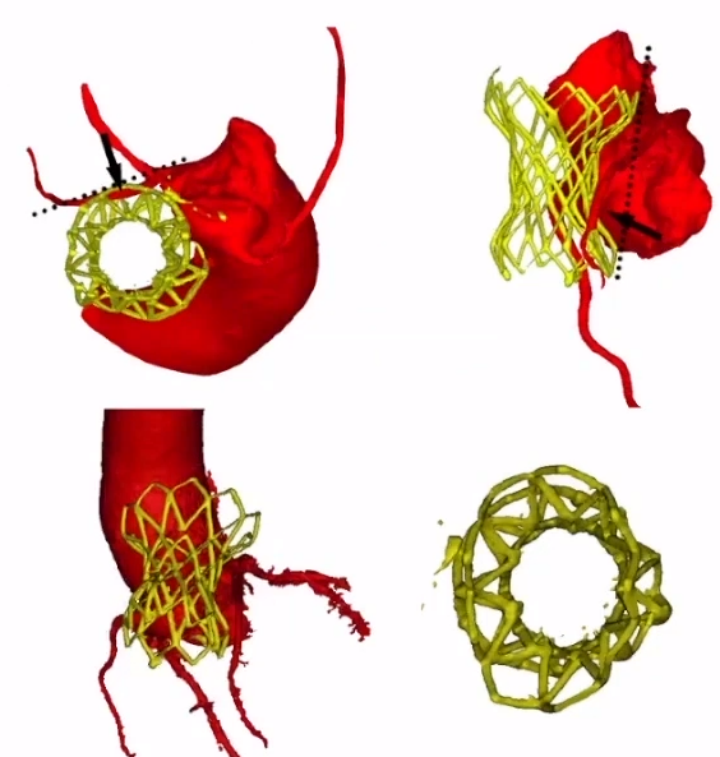
3.解剖学不适合TPVR
解剖禁忌:多发肺动脉分支狭窄;MPA过度扩张或倒漏斗;人工带瓣管道。
路径问题,三尖瓣机械瓣。
冠脉风险,肺动脉扩张压迫左主干。

尚小珂教授还介绍本院的TPVR手术背景,完成全球首例经皮自膨式窄腰肺动脉瓣植入,完成全球首例Rastelli外管道植入自膨式肺瓣,完成全球首例极简式介入肺动脉瓣植入术,完成全球首例一站式自膨式肺瓣+VSD封堵,完成全球首例一站式自膨式肺瓣+分支支架植入,完成全球首例ROSS手术后同种带瓣管道TPVR术,完成全球首例右位心经皮自膨胀TPVR术,完成全球首例倒漏斗型RVOT的经皮TPVR术。
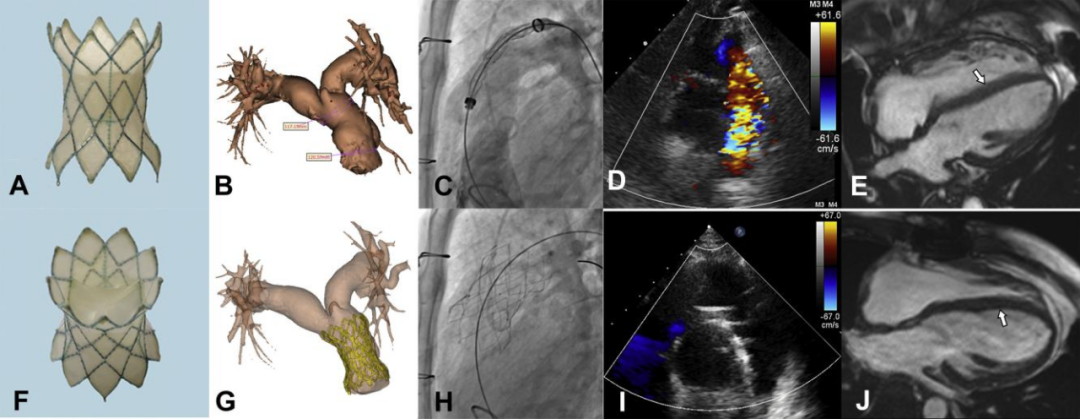
2019年该院在《JACC:Cardiovascular Interventions》杂志发表了一篇《首次在右心室流出道植入 Med-Zenith PT 瓣膜治疗肺动脉瓣反流》文章,报道了一种新型经导管肺动脉瓣(TPV)装置的首次人体植入,用于治疗先天性RVOT中的严重 PR。
研究选择了四名患者尝试进行 TPVR 手术。所有人都曾接受过 TOF 手术,对 RVOT 进行了经环状补片修复,并伴有严重的 PR 并伴有明显的 RVOT 扩张。进行了多模块成像评估,包括经胸超声心动图、心脏计算机断层扫描血管造影(CTA)以及心脏磁共振成像(CMR),用于手术计划和围手术期评估。
患者处于全身麻醉状态。根据基于 CTA 的最佳装置进行 RVOT 血管造影。如果 CTA 图像预测冠状动脉受压的高风险,则进行冠状动脉成像和球囊大小调整。在 PA 远端放置一根超硬导丝后,将 21-F 输送系统推进到 PA 中。瓣膜从分叉下方的远端主 PA 开始展开。在瓣膜框架展开期间进行血管造影。近端支柱被部署到远端 RVOT 中。包含生物瓣膜的框架随着 3 个嵌入式附件的最终脱壳被释放。部署完成后,运载系统被小心撤出。所有患者均实现瓣膜植入成功,无残留 PR。
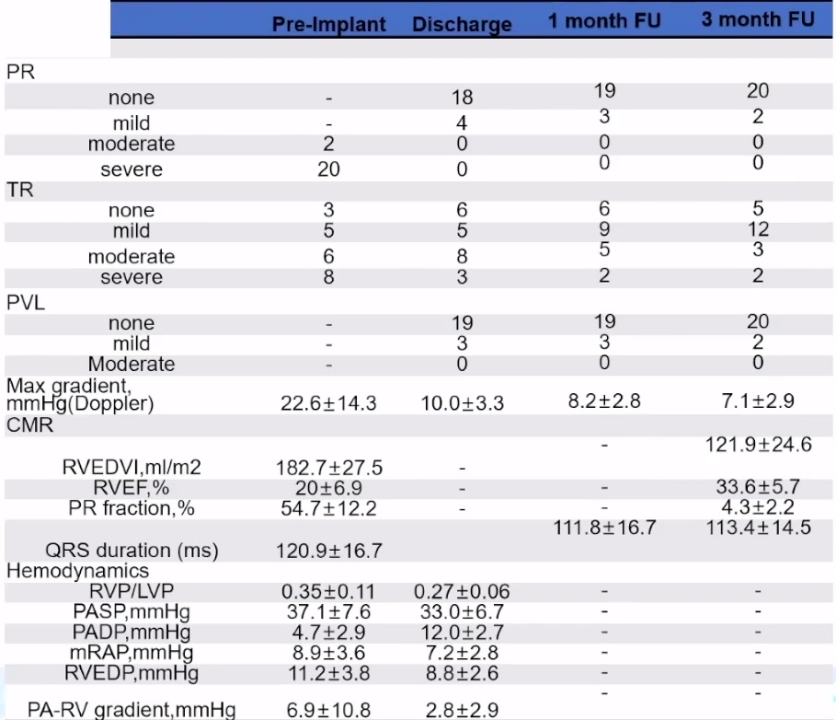
随着应用的逐渐成熟,尚教授统计了医院在TPVR手术的临床数据:总体来说手术效果不错,22例手术全部成功,且无冠脉压迫、分支或三尖瓣受累、心包填塞等急性并发症、装置脱落等设备相关并发症、紧急体外手术和死亡的风险,也无狭窄及轻度以上的瓣膜或瓣周返流。
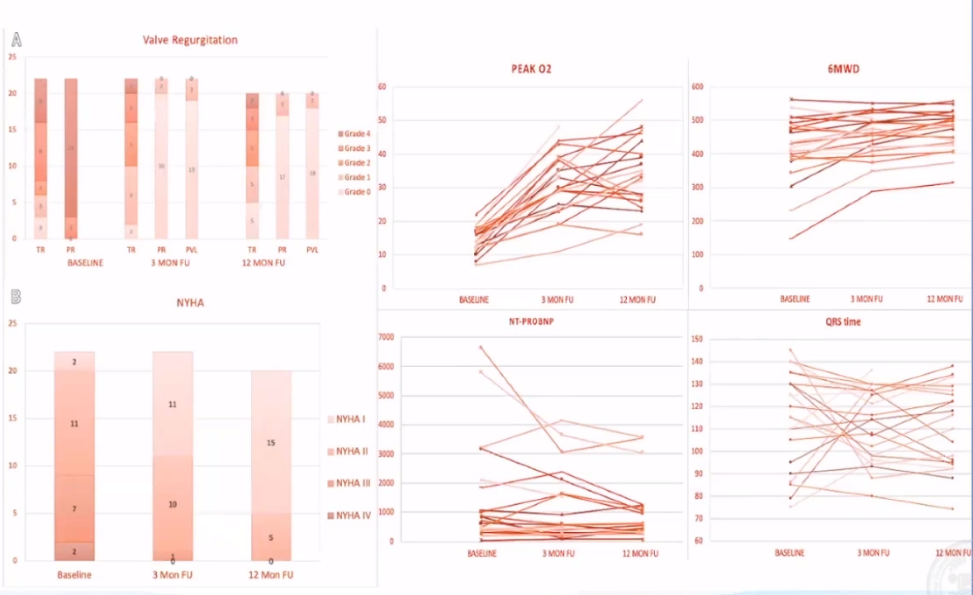
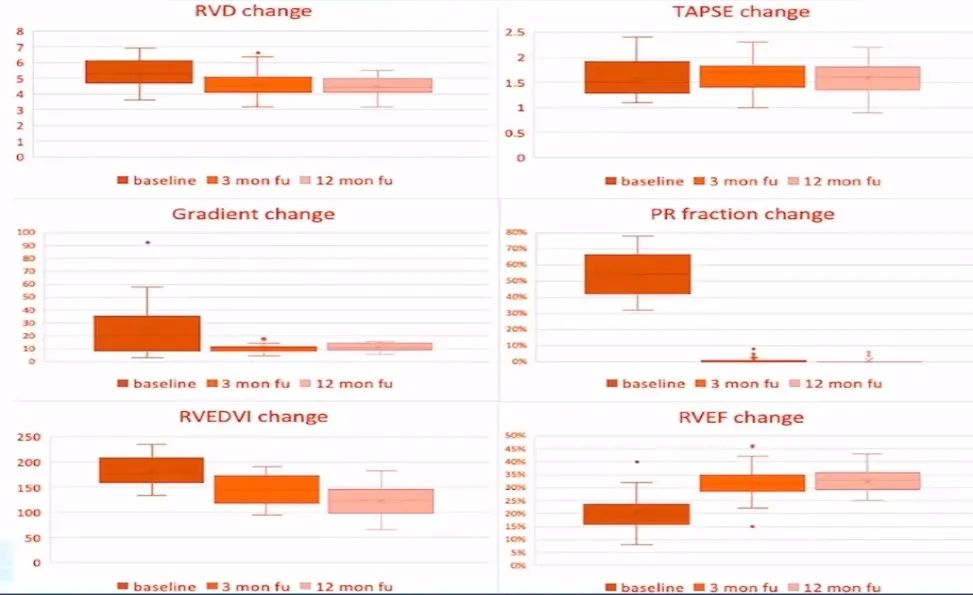
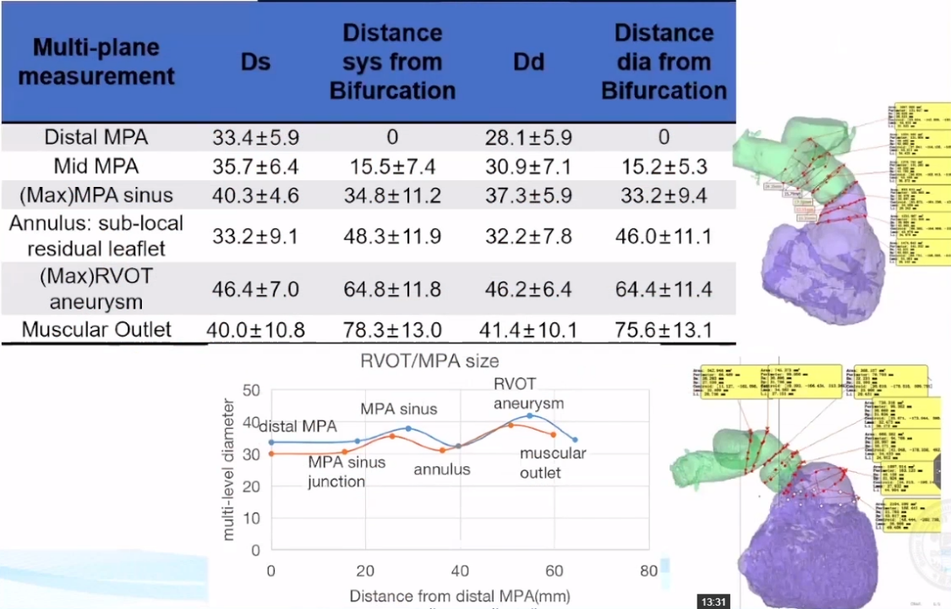
1.国人rTOF手术方式多样,肺动脉解剖形态各异。
2.基于3D重建的多水平测量有助于准确判断解剖学适应证和制定手术方案。
3.铆定区、铆定方式及瓣膜型号的选择需个体化(最窄处直径和瓣环直径)。
4.近期及远期并发症仍需密切关注。
-End-