

以往,美国相关指南关于TAVI(经导管主动脉瓣植入术)的适应人群推荐在80岁以上,欧洲相关指南推荐用于75岁以上且为高危患者。因此,行TAVI的患者与外科手术患者的瓣膜衰败并没有可比性,因为进行TAVI手术的患者年龄偏大且多伴有其他慢性疾病,实际中瓣膜还没有出现问题,患者由于高龄、并发症等一系列问题已经有了生命危险。所以,TAVR(经导管主动脉瓣置换术)与SAVR(外科主动脉瓣置换术)的临床获益无法进行比较。

随着低危研究Evolut Low Risk和PARTNER 3研究的开展,目前AHA/ACC指南和ESC/EACTS指南均对TAVI手术的适应证进行了调整,TAVI适应证已拓展至低危人群,年龄也相对放宽,受术者必将不断增加。复旦大学附属中山医院的周达新教授就此给我们带来ACC热点解读:瓣膜血流动力学衰败五年结果。周教授指出,由于低危患者、年轻患者往往有更长的预期寿命,必须强调瓣膜置换患者的终生管理,因此TAVI瓣膜的耐久性应该得到更多的关注。
ESC-EAPCI-EACTS 共识文件VAR-3
1.明确了人工瓣膜衰败(BVF)的定义
严重的、可引起临床不良事件的瓣膜退化称为BVF。不良事件包括:生物瓣膜功能障碍相关的死亡(即诊断为人工生物瓣膜功能障碍后由人工生物瓣膜功能障碍引起的任何死亡或不明原因的猝死);确诊人工生物瓣膜功能障碍后重复介入治疗(即瓣中瓣联合TAVI、瓣周漏封堵术或SAVR);严重血流动力学SVD(结构性瓣膜衰败)。
2017年发表在欧洲心胸外科杂志上一篇文章指出“外科生物瓣10年后约10%需再次手术,15年后再次手术率约30%……”
2. 瓣膜有效开口面积对耐久性产生影响
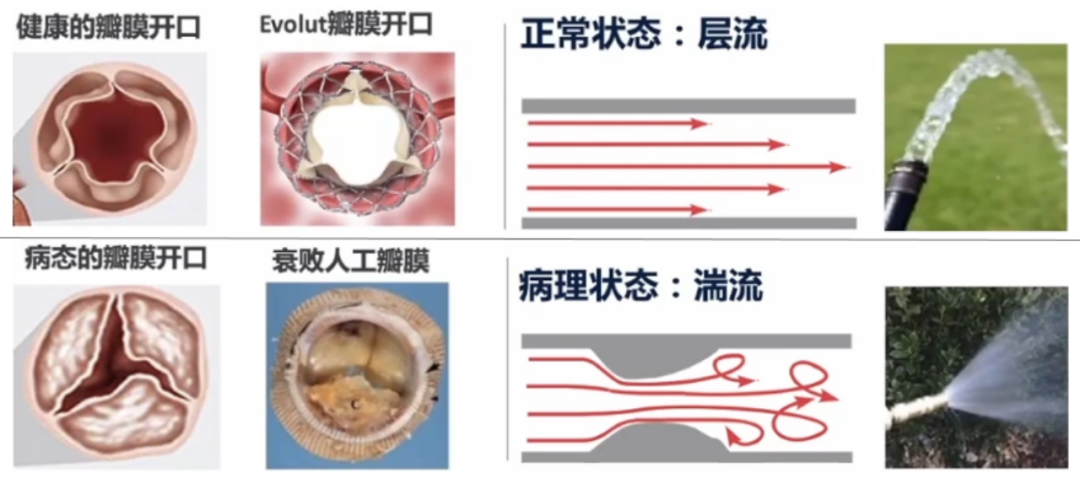
瓣膜有效开口面积变化带来血流动力改变,最终也将对瓣膜耐久性产生影响:前向血流阻力增加→心室收缩期射血压力增大→左室与升主动脉平均压差增大→血液通过流速增大。
3.共识文件:人工生物瓣膜功能障碍(BVD)
BVD的评价标准和路径:确定瓣膜功能障碍的原因→评估血流动力学变化→确定临床结果。
在发生BVF之前,生物瓣膜功能障碍(BVD)可能是更早出现的瓣膜退化表现。 最新定义的BVD包括结构性瓣膜功能退化、非结构性瓣膜功能退化、血栓形成和感染性心内膜炎4大类型。
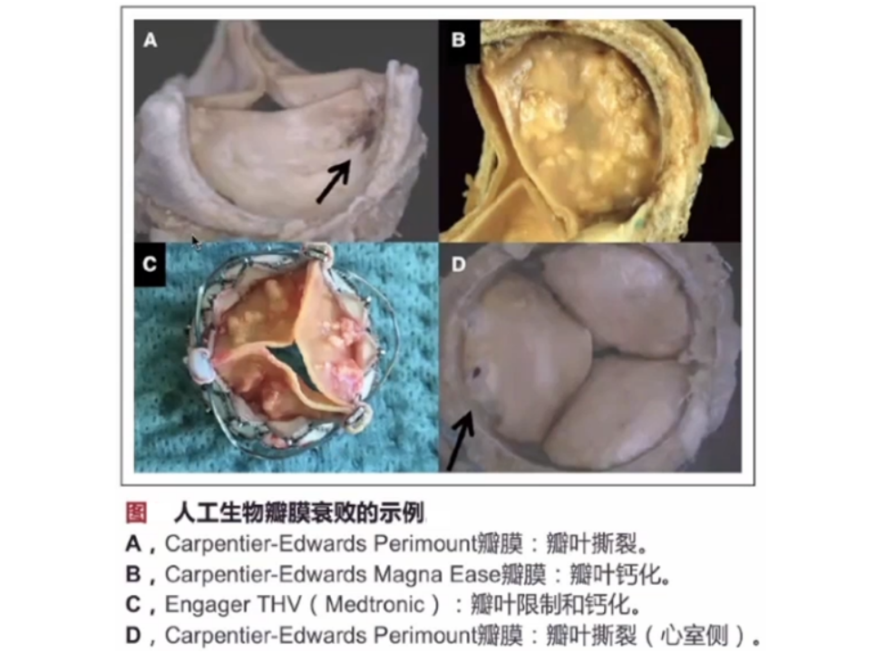
(1)结构性瓣膜衰败(SVD):人工瓣膜固有的永久性变化(即钙化、瓣叶纤维化、撕裂或浮动)所导致瓣膜退化和/或血流动力学功能障碍。
-
a.严重血流动力学SVD(以下任一情况):平均跨瓣压差≥40mmHg;平均跨瓣压差较基线变化≥20mmHg;重度人工瓣膜内主动脉瓣返流,新发或较基线恶化(>2+/4+)。
-
b.中度血流动力学SVD(以下任一情况):平均跨瓣压差≥20且<40mmHg;平均跨瓣压差≥10mmHg且较基线变化<20mmHg;中度人工瓣膜内主动脉瓣返流,新发或较基线恶化(>1+/4+)。
-
c.形态学SVD(以下任一情况):瓣叶完整性异常(即撕裂或浮动导致瓣架内返流);瓣叶结构异常(即病理性增厚和/或钙化导致瓣膜狭窄或中心返流);瓣叶功能异常(即活动受损,导致狭窄和/或中心返流);支柱/瓣架异常(即断裂)。
(2)非结构性瓣膜衰败(NSVD):人工瓣膜本身非固有的任何异常(即人工瓣膜内或人工瓣膜周围返流、人工瓣膜异位、患者人工瓣膜不匹配、晚期栓塞等)所导致的瓣膜退化和/或功能障碍。
(3)血栓形成:人工瓣膜的任何结构上出现血栓,导致功能障碍,伴或不伴血栓栓塞。
(4)心内膜炎:累及人工瓣膜任意结构的感染,会导致瓣周脓肿、裂开、假性动脉瘤、痿管、赘生物、瓣尖破裂或穿孔。
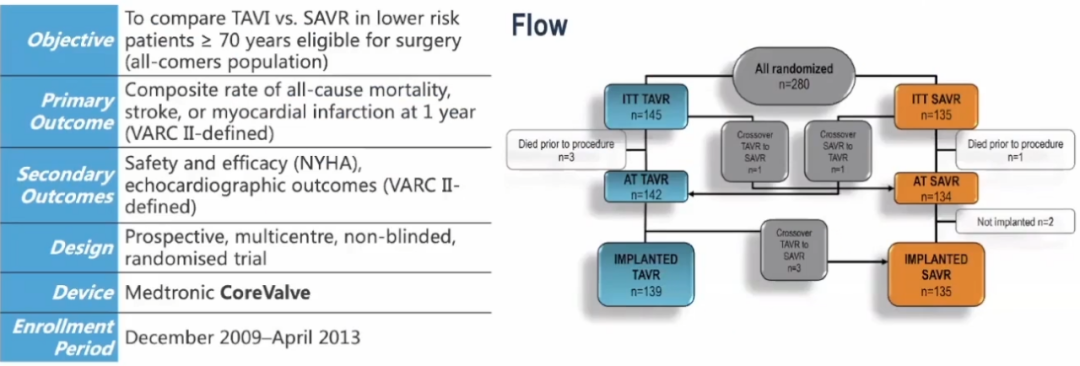
2021年ESC更新:Notion Trial 8年随访研究
随着经导管主动脉瓣置换术逐渐用于中低危患者,其长期耐久性变得尤为重要。
一般来讲,外科瓣膜根据指南推荐,50岁以上可以考虑生物瓣。目前欧洲和美国的相关指南,特别时欧洲指南,不考虑评分及危险性分层,推荐75岁以上才能选择TAVR,美国则推荐80岁以上。中国2020年指南推荐60-70岁之间就可以考虑TAVR,因此随着年龄层的降低,瓣膜耐久性越来越得到大家的重视。
最近,葛均波院士带领团队做了一个多聚合物铸成的瓣膜,这个瓣膜根据临床试验,推测可用到25-35年以上。如果说一个瓣膜应用于临床,证实确实能够用很长时间,大部分解剖结构支持的患者都可以选择TAVR。
Notion Trial 8年随访研究引领TAVR适应证从极高危拓展到低危重度主动脉瓣狭窄;不断积累临床证据,证明TAVR优于外科的长期耐久性.
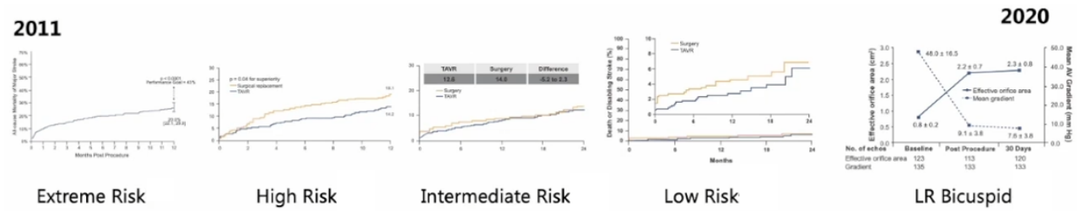
Notion Trial——首个纳入了低危患者的前瞻性研究,8年持续随访表明Core Valve/Evolut瓣膜在耐久性方面有优异表现。
研究结果显示:
(1)TAVR组全因死亡/卒中/心梗率与SAVR无显著差异。
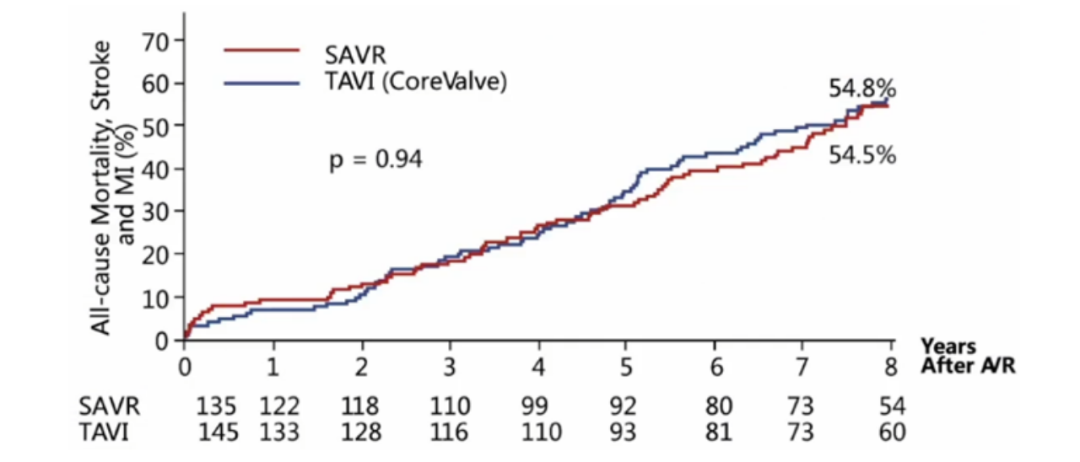
(2) TAVR组全因死亡与SAVR无显著差异。

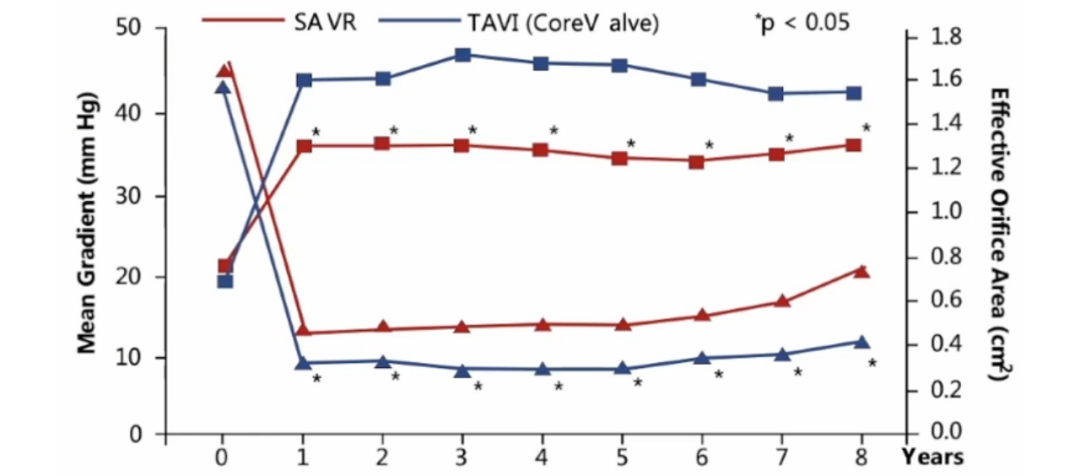
(3) TAVR组可维持更大的瓣膜开口面积/更低的跨瓣压差。
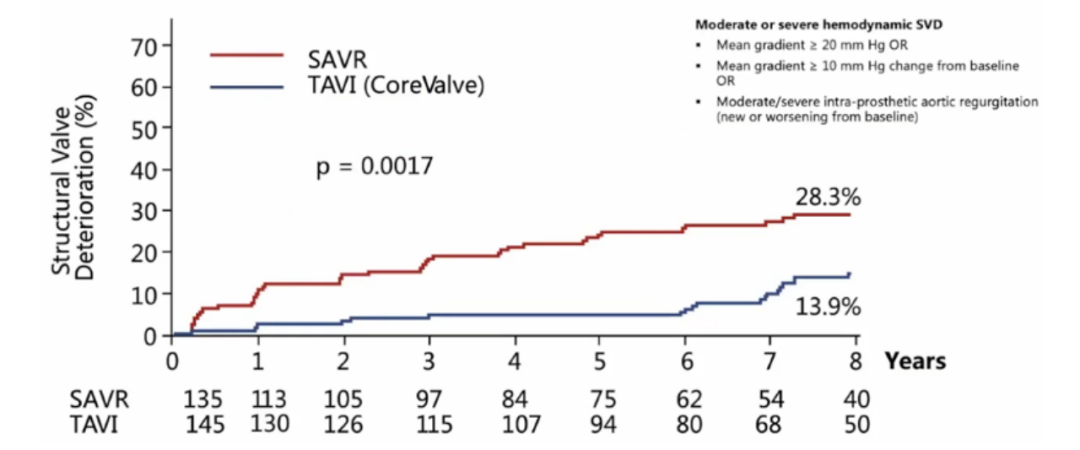
(4)TAVR组结构性瓣膜衰败率显著低于外科手术。
(5)TAVR组严重瓣膜衰败率(BVF)在数值上低于外科手术,虽然没有明显的统计学差异,可能增加病例后差异会明显。
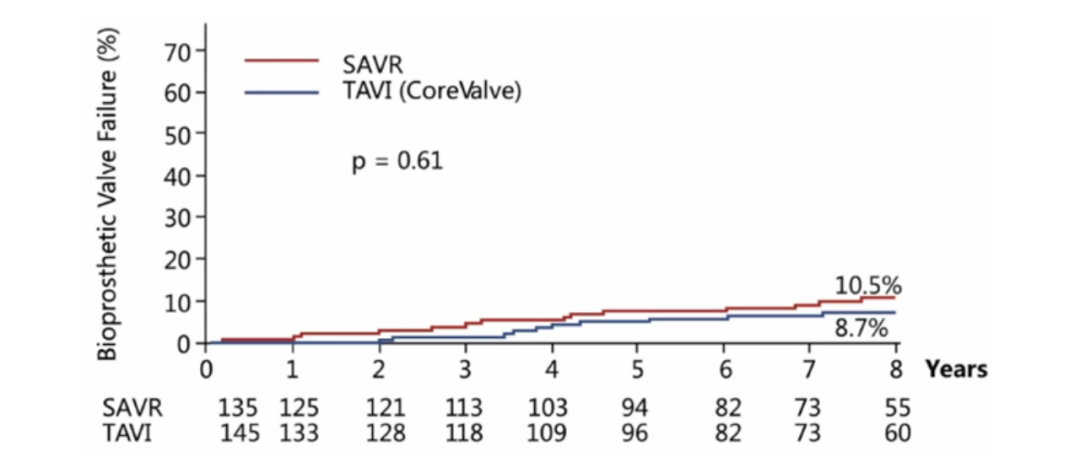
结论:低危患者最长时间随机对照研究,证明8年CoreValve/Evolut全因死亡率、卒中发生率与外科手术无显著差异,瓣膜衰败发生率更低。
一直以来,业界缺乏关于TAVR瓣膜与外科手术方面权威性的对比研究,根深蒂固的一个观点就是外科瓣膜耐久性更好,TAVR瓣膜使用时间较短,形成这种观念的原因就是TAVR瓣膜往往应用于高龄患者,没有等到瓣膜衰败,患者可能因各种问题就去世了。
ACC 2022结构性瓣膜衰败5年随访解读
“我们原来只考虑是否找到了更好的材料,不大关注瓣膜植入以后,由于血流动力学障碍导致的瓣膜衰败问题。未来我们应该不是单纯把瓣膜植入就好了,也应该评估植入多大的瓣膜,以怎样的角度能够给病人带来更大的益处……”
——葛均波院士
研究目的:
通过回顾性分析US Pivotal Trial与SURTAVI随机对照数据,评估TAVR和SAVR因血流动力学障碍导致结构性瓣膜衰败(SVD)的5年发生率、临床结果和预测因子。
研究方法:
纳入两项RCT研究(US Pivotal Trial和SURTAVI)数据,1128例TAVI组患者和971例SAVR组患者,共2099例数据,用于比较TAVI和外科换瓣结构性瓣膜衰败(SVD)的发生率,同时探索SVD对临床预后的影响。
该研究中SVD(经胸心脏超声评价)定义为中度以上的瓣膜血流动力学衰败:平均跨瓣压差≥20mmHg且较出院前30天心脏超声测量的平均跨瓣压差增加≥10mmHg;新发或进展至中度及以上的瓣中反流。
研究结果:
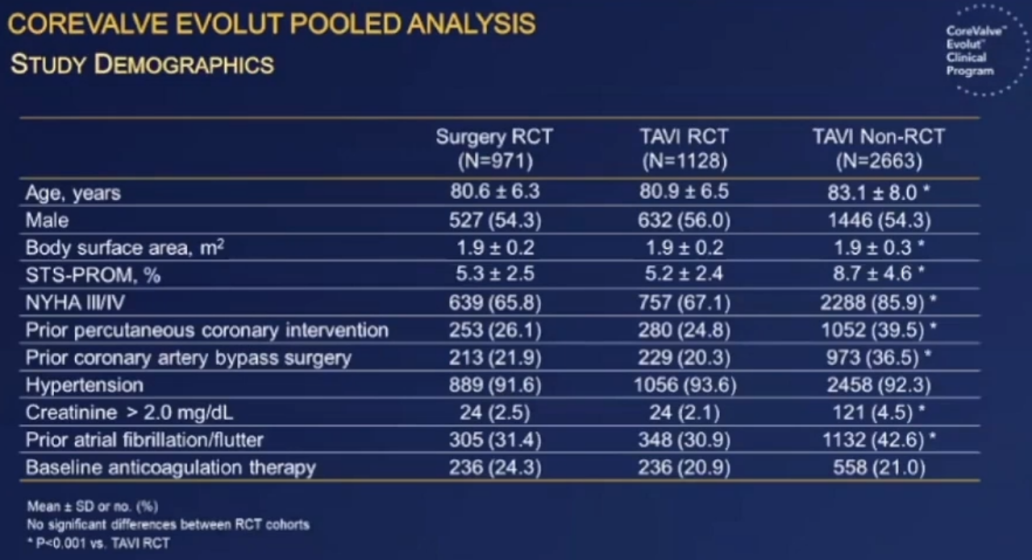
(1)基线特征比较,RCT队列组间可比,*表示TAVI非RCT和RCT队列相比P值<0.001。
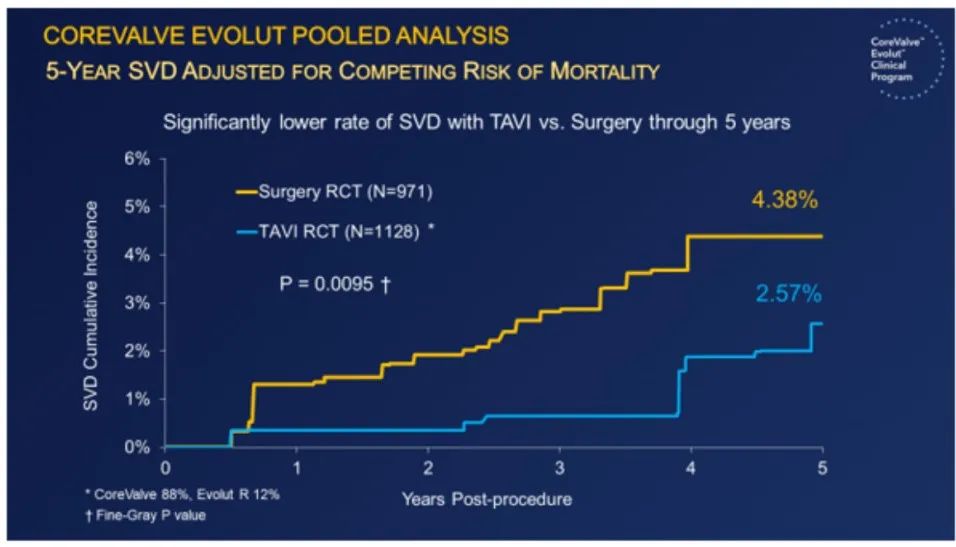
(2)在中高危重度AS患者中,TAVI患者结构性瓣膜衰败(SVD)的5年发生率仅为2.57%(P=0.0095),而外科换瓣组为4.38%。
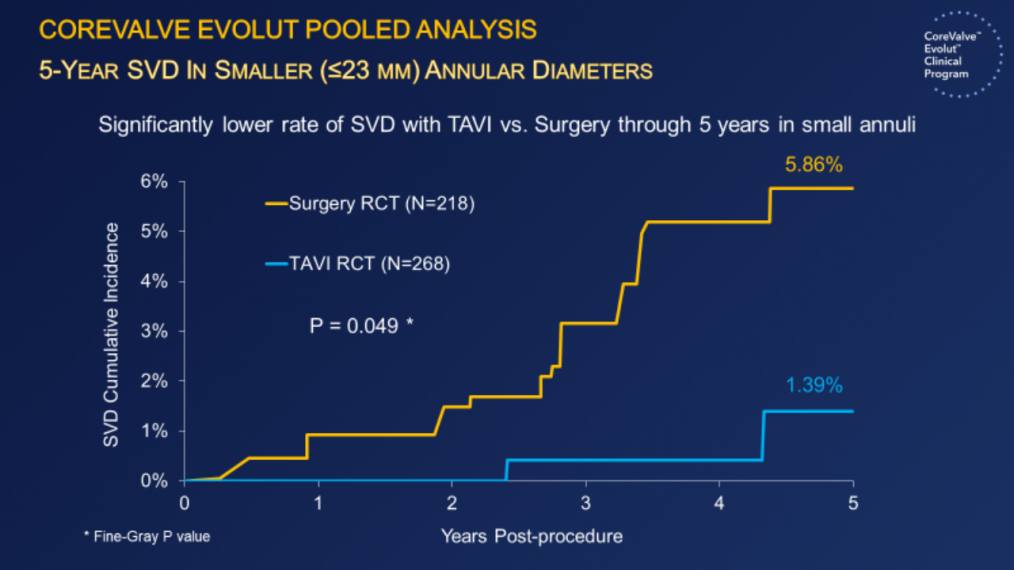
(3)在小瓣环(≤23mm)患者中,SVD累积发生率:SAVR 5.86% vs TAVI 1.39%,(P=0.049)。
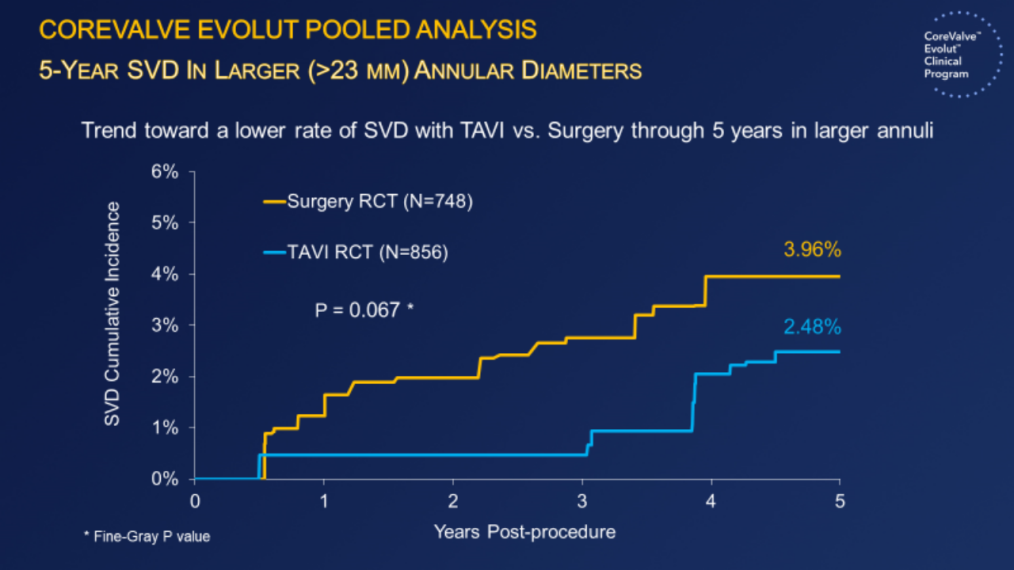
(4)在大瓣环(>23mm)患者中,SVD累积发生率:SAVI 3.96% vs TAVI 2.48%,(P=0.067)。
(5)TAVI队列中度和重度的结构性瓣膜衰败(SVD)例数均更低。
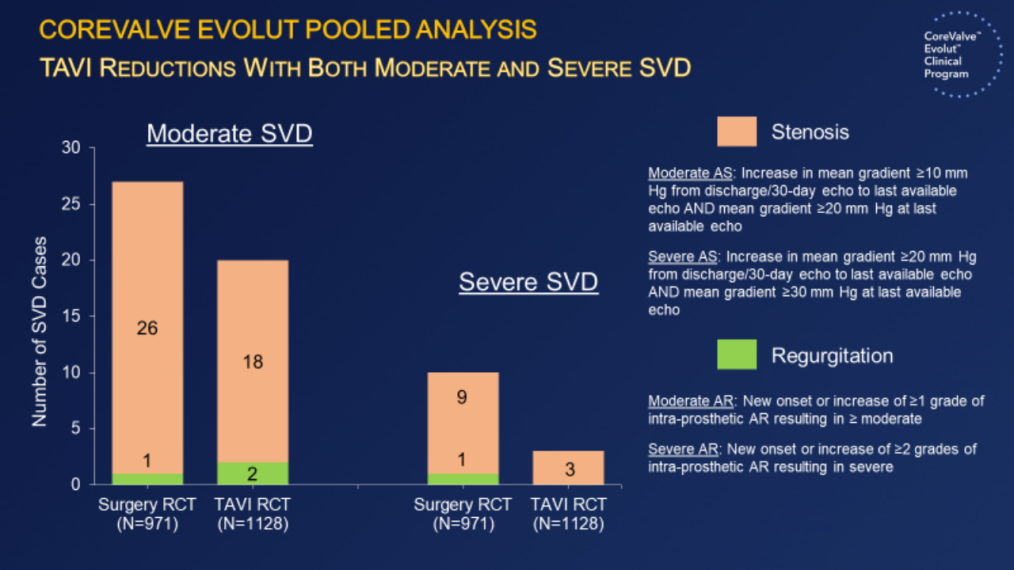
橙色示狭窄,绿色示反流
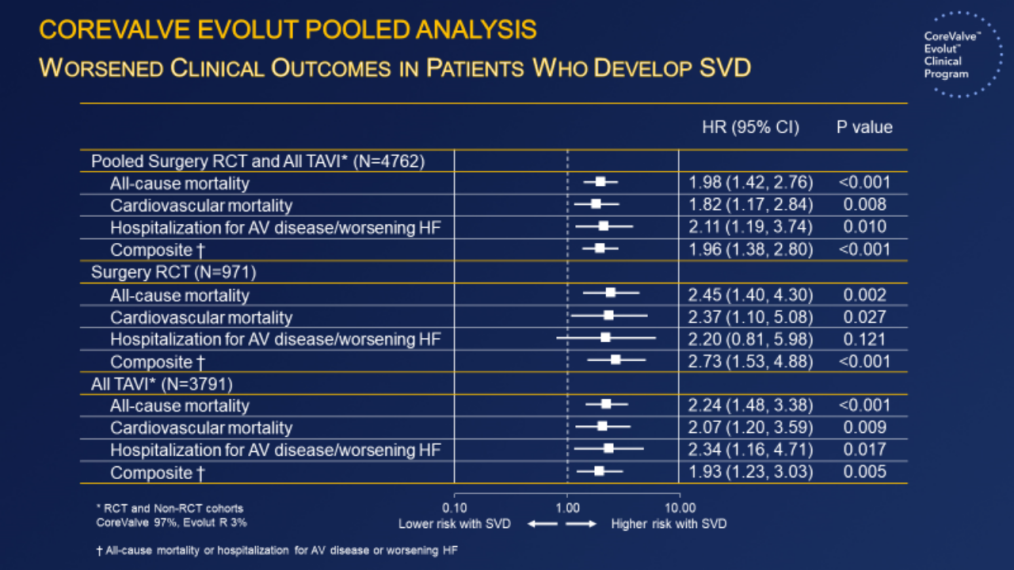
(6)结构性瓣膜衰败(SVD)患者5年时全因死亡率(P<0.001),因瓣膜相关疾病或心力衰竭住院(P=0.01)的风险增加近2倍。
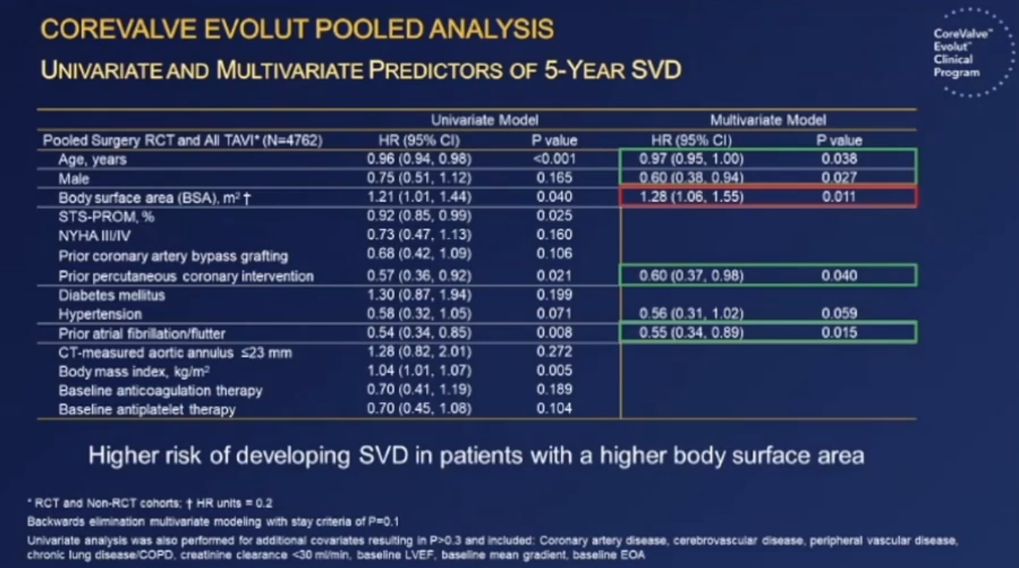
(7)单因素和多因素分析显示,体表面积较大是5年结构性瓣膜衰败(SVD)的独立危险因素[HR(95% CI):1.28(1.06, 1.55),P=0.011]。
研究结论:
在中高危重度AS患者中,TAVI比外科换瓣结构性瓣膜衰败(SVD)5年累计发生率更低。TAVI队列中度和重度的结构性瓣膜衰败(SVD)例数均更低。
在小瓣环(≤23mm)患者中,TAVI 比SAVR结构性瓣膜衰败(SVD)5年累积发生率显著更低;在大瓣环(>23mm)人群中,TAVI的结果也要低于SAVR。
结构性瓣膜衰败(SVD)患者5年时全因死亡率、因瓣膜疾病或心衰住院的风险增加近2倍。
体表面积较大的患者发生结构性瓣膜衰败(SVD)风险更高;而男性、老年患者以及既往PCI和房颤患者发生结构性瓣膜衰败(SVD)的风险较低。
总结
TAVR将适应证从极高风险、高风险、中风险逐渐拓展至低风险,“年轻化”的主动脉狭窄患者对瓣膜长期耐久性更为关注。
TAVR独特的瓣膜设计和工艺:自膨环上瓣,瓣叶高吊缝合,猪心包组织瓣膜以及AOA抗钙化技术,共同造就Evolut长期稳定的血流动力学改善。
NOTION TRIAL对低风险患者进行的8年随访证实其长期可靠的耐久性,TAVI组SVD发生风险明显低于SAVR组,严重瓣膜衰败(BVF)发生率较低。
回顾分析US Pivotal Trial和SURTAVI临床研究的5年SVD发生率显示,TAVI组SVD发生率显著低于SAVR组,从临床结果和瓣膜的耐久性来看,TAVI的长期结果是令人放心的。
