临床以往对ECMO(体外膜肺氧合)技术在重症冠心病患者中的广泛应用均以结果为指导,但新疆医科大学第一附属医院马翔教授在一次会议中提到决策水平可以决定结果水平。他在“机械循环支持下重症冠心病中的应用”报告中介绍了选择重症冠心病ECMO支持影响因素的三个方面:1.病变层面,AMI(急性心肌梗死)、CTO(慢性完全闭塞性病变)、钙化、LM(左主干)、迂曲、多支;2.患者层面,ECPR(体外心肺复苏)、心源性休克(CS)、是否合并复杂内科情况;3.技术层面,术者经验、器械、团队合作。

马翔教授提到ECMO支持的时机策略可以分为术前、术中和术后,以及主动和被动几种情况。
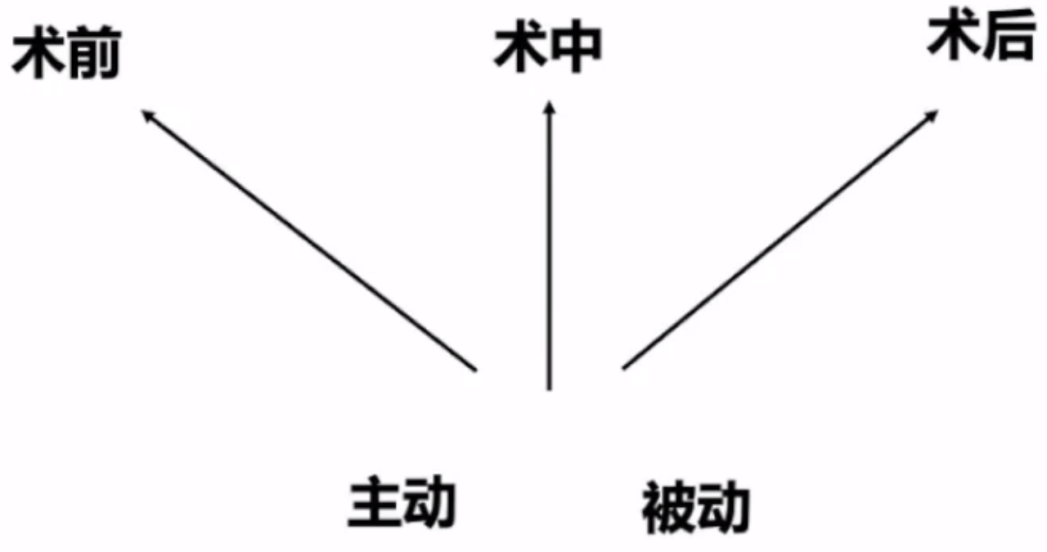
整体来说,临床医生在患者诊疗中应掌握主动权,主动术前(CCU)预植入,尽早上机和撤机。早期预植入,预判介入手术可能中会出现的血流动力学障碍和严重心功能障碍,建议早上机。若心脏功能恢复到一定程度,射血分数35%~40%,可以早撤机。早上早撤机,可以充分保证患者血流动力学和氧合的稳定,使手术包括抢救成功率显著提高。
J Cardiothorac Surg
2017年《成人心脏手术后难治性心源性休克的体外膜氧合:系统评价和荟萃分析》
背景
对正性肌力支持和主动脉内球囊反搏术 (IABP) 难治的心脏切开术后心源性休克 (PCCS) 很少发生,但在没有机械循环支持的情况下几乎普遍致命。在这项系统回顾和荟萃分析中,我们从患者存活率和结果决定因素的角度研究了在难治性 PCCS 中使用VA ECMO背后的证据。
方法
2017 年 1 月使用 PubMed(未定义时间段)使用关键词“心脏切开术后”、“心源性休克”、“体外膜氧合”和“心脏手术”进行系统评价。我们排除了与儿科心脏手术后 ECMO、心源性休克的医学原因以及病例报告、评论文章、专家意见和致编辑的信件有关的论文。整理研究后,将对符合纳入标准的论文中的幸存者比例进行荟萃分析。对最常报告的不良预后指标 (API) 进行元回归。
结果
从 1992 年到 2016 年,我们确定了 24 项研究和 1926 名患者。我们将人口统计数据制成表格,包括每项研究的优缺点、VA ECMO 治疗难治性 PCCS 的结果、并发症和 API。所有研究均为回顾性队列研究。对中度异质性数据的荟萃分析(95% CI 0.29 至 0.34,p < 0.01,I 2 = 60%)显示出院的总生存率为 30.8%。一些经常报告的 API 是高龄(>70 岁,95% CI -0.057 至 0.001,P = 0.058)和长期 ECMO 支持(95% CI -0.068 至 0.166,P = 0.412)。术后肾功能衰竭、高 EuroSCORE (>20%)、糖尿病、肥胖、ECMO 期间乳酸升高、胃肠道并发症也有报道。
结论
VA ECMO 的血液动力学支持可提供生存益处以及合理的中期和长期结果。许多研究报告高龄、肾功能衰竭和延长 VA ECMO 支持是 PCCS 中 VA ECMO 最可能的 API。EuroSCORE 可用于预测高风险类别中预防性围手术期 VA ECMO 的需求。API 可用于辅助有关难治性 PCCS 的 ECMO 建立和戒断的决策。
JAMA
2020年《血管内微轴左心室辅助装置与主动脉内球囊反搏术的使用与急性心肌梗死并发心源性休克患者的院内死亡率和大出血的关联》
目的
研究接受机械循环支持(MCS)装置治疗的急性心肌梗死并发心源性休克的经皮冠状动脉介入治疗(PCI)患者的结局。
设计、设置和参与者
一项基于倾向性匹配登记的回顾性队列研究,研究对象为 2015 年 10 月 1 日至 2017 年 12 月 31 日期间接受 PCI 的 AMI 并发心源性休克患者,这些患者的数据来自参与 CathPCI 的医院和胸痛-MI 登记处,它们都是美国心脏病学会国家心血管数据登记处的一部分。接受血管内微轴 LVAD 的患者与接受 IABP 的患者在人口统计学、临床病史、表现、梗塞部位、冠状动脉解剖和临床实验室数据方面进行了匹配,最终随访至 2017 年 12 月 31 日。
暴露:血流动力学支持,分类为仅使用血管内微轴 LVAD、仅使用 IABP、其他(例如使用经皮体外心室辅助系统、体外膜氧合或 MCS 装置组合使用)或仅药物治疗。
主要结果和测量
主要结果是院内死亡率和院内大出血。
结果
28304例因AMI并发心源性休克接受PCI的患者中,平均(SD)年龄为65.0(12.6)岁,男性占67.0%,ST段抬高型心肌梗死占81.3%,心脏骤停占43.3%。在 AMI 患者的研究期间,6.2% 的患者使用了血管内微轴 LVAD,29.9% 的患者使用了 IABP。在 1680 个倾向匹配对中,使用血管内微轴 LVAD (45.0%) 与使用 IABP 相关的院内死亡风险显着更高(34.1% [绝对风险差异,10.9 个百分点 {95% CI, 7.6-14.2};P < .001)以及院内大出血的风险更高(血管内微轴 LVAD [31.3%] vs IABP [16.0%];绝对风险差异,15.4 个百分点 [95% CI,12.5-18.2 ];P < .001)。
结论和相关性
在 2015 年至 2017 年因 AMI 并发心源性休克而接受 PCI 的患者中,与 IABP 相比,使用血管内微轴 LVAD 与更高的调整后院内死亡和大出血并发症风险相关,尽管研究解释受到以下因素的限制观察设计。可能需要进一步的研究来了解这些患者的最佳设备选择。
EuroIntervention
2021年《心源性休克患者的静脉-动脉体外膜肺氧合 (ECMO):随机、多中心、开放标签 EURO SHOCK 试验的基本原理和设计》
目的
心源性休克 (CGS) 发生在 6-10% 的急性冠脉综合征 (ACS) 患者中。随着时间的推移,由于急性血运重建,死亡率从 80% 下降到大约 50%,但自 1990 年代以来一直处于稳定状态。一旦确诊,患有 CGS 的患者就会发展出不利的代偿机制,导致死亡的恶性循环,这种情况变得难以逆转。我们的目的是在一项稳健的、前瞻性的随机对照试验中测试VA-ECMO的早期支持是否可以通过降低死亡率和发病率来提供临床益处。
方法和结果
EURO SHOCK 试验将测试使用 VA-ECMO 的机械心脏支持的益处或其他方面,该支持在 CGS 急性PCI后早期启动。该试验旨在将 428 名 CGS 并发 ACS 患者随机分组,接受直接 PCI (P-PCI) 后,接受极早期 ECMO 联合标准药物治疗,或单独接受标准药物治疗。它将在 39 个欧洲中心进行。主要终点是 30 天全因死亡率和关键次要终点:1) 12 个月全因死亡率或因心力衰竭入院,2) 12 个月全因死亡率,3) 12 个月因心力衰竭入院. 将嵌入成本效益分析(包括生活质量措施)。将进行机械和假设生成子研究。
结论
EURO SHOCK 试验将确定在 PCI 后持续出现 ACS-CGS 的患者中早期启动 VA-ECMO 是否会降低死亡率和发病率。
Heart Fail Rev
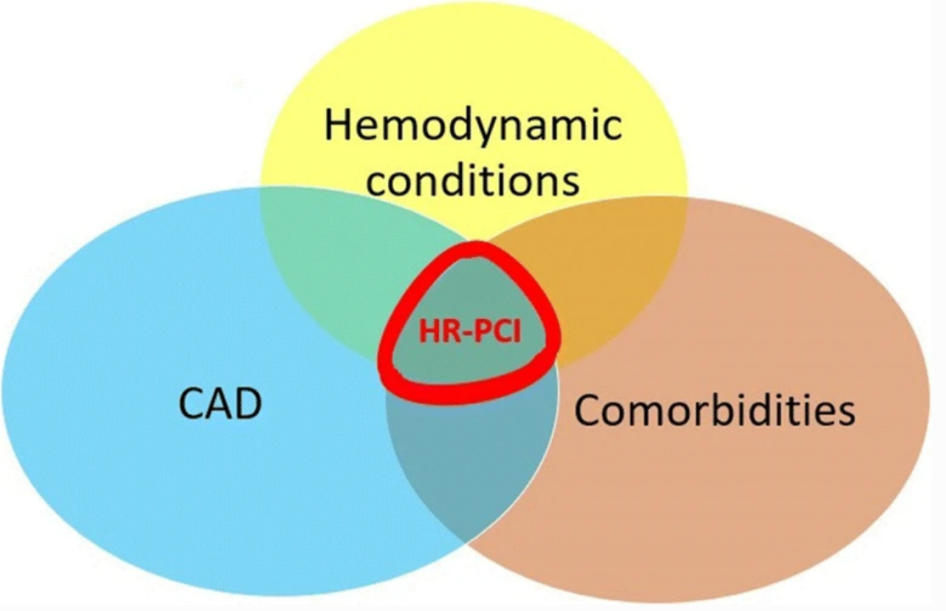
2020年《静脉-动脉ECMO支持下高危经皮冠状动脉介入治疗的心脏重症监护管理》这篇文章中提到,VA-ECMO已被引入作为 HR-PCI(高风险经皮冠状动脉介入治疗)患者的临时MCS,以便在手术过程中提供足够的全身灌注。HR-PCI具有以下特征:患者特异性、病变特异性、临床表现。
具体而言,患者特异性因素包括年龄增加(> 75 岁)、糖尿病(DM)、相关慢性肾病(CKD)或慢性阻塞性肺病(COPD)、严重心脏瓣膜病(HVD)、心力衰竭(HF)、既往心肌梗死 (MI)、外周动脉疾病 (PAD) 以及既往短暂性脑缺血发作 (TIA) 或中风病史。
特定病变组包括开口狭窄、最后开放导管、存在严重的多支冠状动脉疾病(定义为 SYNTAX 评分 > 33)、CTO、重度钙化病变和显着狭窄涉及LM或其分叉。
相反,涉及临床表现的特征是指血流动力学状态、左心室功能以及心电不稳定的存在或风险。
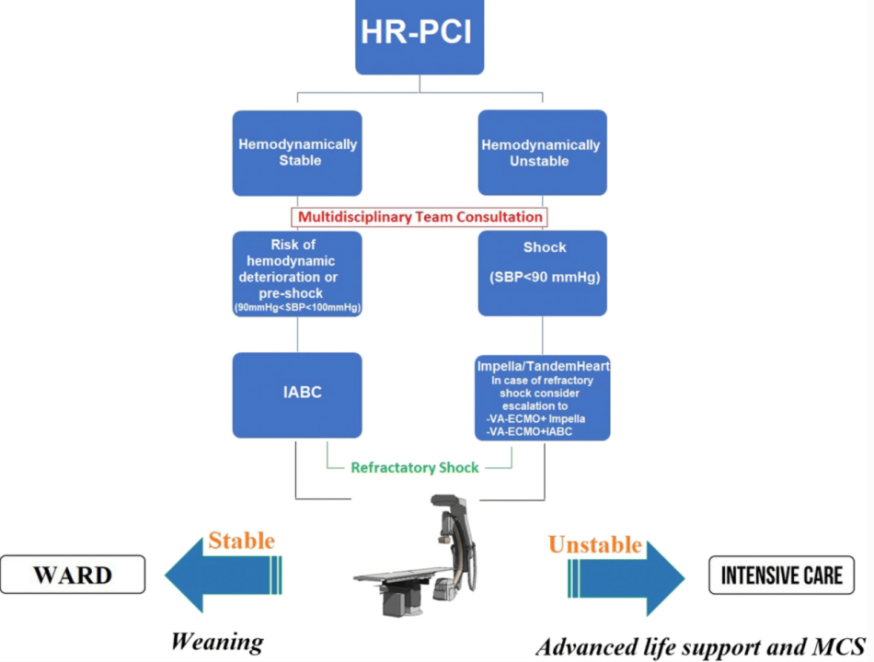
在临床实践中,真正的挑战仍然是选择哪种设备可以为每位患者提供最充分的支持。通常,在休克前(定义为收缩压 < 100 mmHg 的全身低灌注)患者中,通常使用IABC提供血流动力学支持。相反,严重 CS 患者应接受 pVAD(体外循环心室辅助装置)作为一线治疗,而如果出现进一步的临床恶化,例如难治性 CS 休克或AMI后心肺复苏支持的心脏骤停,则 MCS 会进一步升高到 VA-ECMO。
病例1 术前主动
50岁男性患者,因反复活动后胸痛,气促15年,加重1个月入院。2003年LAD行PCI治疗。危险因素是高血压,DM,吸烟。血压95/70mmHg。心脏超声提示左心室腔略增大,EF40%。BNP 3830.00(ng/L),Cr 65umol/L。
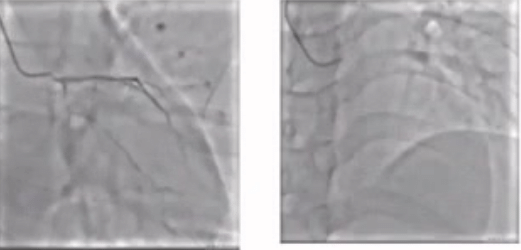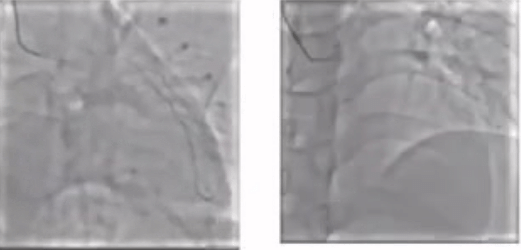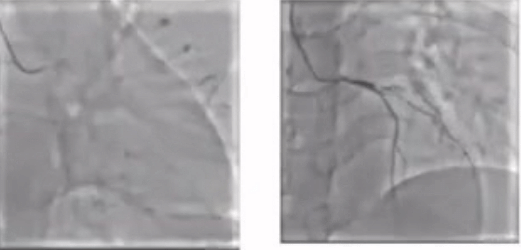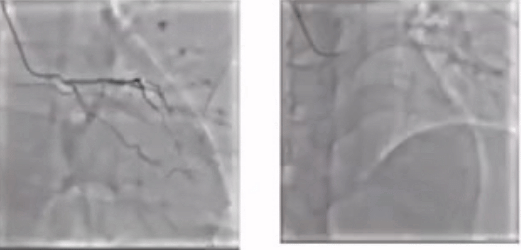
CAG
病变评估
1. LM-LAD重度狭窄
2.LCX闭塞
3. RCA闭塞
考虑到该例患者三支病变高危风险,马翔教授强调若要进行PCI手术就需要做到术前主动,提前预植循环辅助装置。在跟患者家属商量后,成功通过ECMO的支持,一次性完成了RCA、LCX以及LM-LAD三处病变,最终结果较满意。因此,对于多支血管闭塞,心脏储备功能较低的患者,通过ECMO术前主动植入可以有效降低术中风险。
病例2 术前被动
58岁患者,主诉以“间断胸痛10天,加重1天,伴意识丧失1小时”入院。 血压测不到,心电图示急性广泛前壁心梗,EF无,心肌酶CK-MB 118.00(U/L)。诊断为心肺复苏(CPR)后。
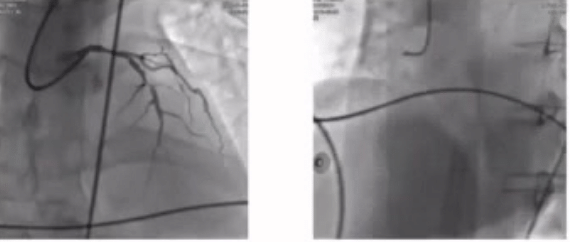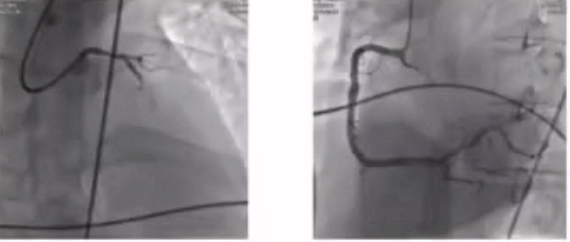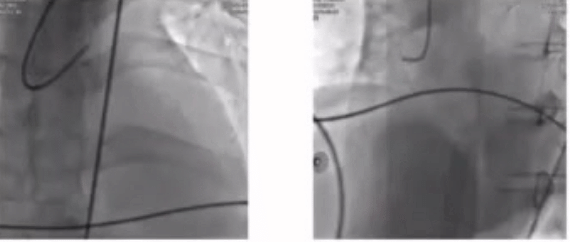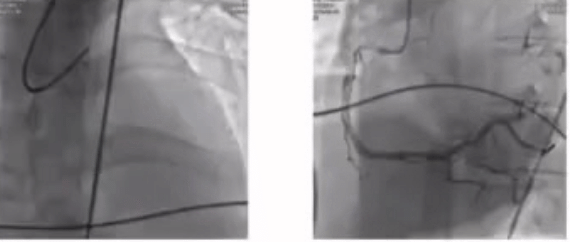
对该例CPR术后的复杂患者,病变简单,ECMO术前被动植入也可以有效降低术中风险。
此外,对于术中和术后的主动和被动,马教授举例说若术中对于高龄患者LAD要多次旋磨,是否需要进行ECMO辅助支持时,当你犹豫时就应主动预植入,因为这类患者发生血肿并发症的风险较高。当然,也可以被动中主动,如术前冲管、穿刺等操作先做好,一但患者血压检测不到,可以立即启动ECMO,为患者争取时间。同样,对于术后不稳定的患者,我们也应将患者风险降到最低。
对于机械循环支持下重症冠心病患者的思考,马翔教授强调我们应充分评估患者病情,提前制定预防策略,有好的策略才会产生好的结果,具体包括以下几点:
1.充分发挥团队优势,对患者风险的分析与预判断。
2.对冠脉病变的准确分析,合理的处理方案。
3. ECMO设备的准备。
4.目前缺乏类似于SHOCK的前瞻性研究,未来还需要各位同道共同努力。
5.排除价格因素,可以参考IABP的使用经验,IABP和ECMO的联合使用可以整体缩短时间,提升患者救治效率。