临床上,对一部分患者而言,胆固醇水平增高是由于遗传因素所造成,例如家族性高胆固醇血症(Familial hypercholesterolaemia,FH)。FH是一种家族性遗传性疾病,表现为先天性LDL-C(低密度脂蛋白胆固醇)异常增高,早发性ASCVD(动脉粥样硬化性心血管疾病),遗传模式主要是单基因病,少数符合多种遗传模式。主要机制是功能缺失性突变LDLR、ApoB、LDLRAP1和功能获得性突变 PCSK9。
北京大学第一医院李建平教授在龙江会上对“家族性高胆固醇血症风险管控与药物治疗进展”作介绍。他在授课中强调世界范围内很早就认识到这种疾病,但目前为止它还相对罕见,我们从疾病诊断到风险管控、风险评估以及治疗方面还缺乏基于循证医学证据的标准和路径,缺乏对相关极高胆固醇和特殊遗传背景造成胆固醇升高的有效治疗药物。

脂质代谢紊乱的影响因素包括遗传因素和环境因素。血脂包括胆固醇水平增高的环境因素包括饮食、运动状态、BMI(体重指数)、吸烟以及饮酒等。
1.杂合型家族性高胆固醇血症(HeFH):
-
突变基因来源于父母一方;
-
总胆固醇: 8-15 mmol/L(310-580 mg/dL);
-
通常55岁-60岁以前患冠心病。
2.纯合型家族性高胆固醇血症(HoFH):
-
突变基因来源于父母双方;
-
总胆固醇: 12-30 mmol/L(460-1160 mg/dL);
-
很早发生冠心病;
-
如果不治疗,通常在20岁之前死亡。

目前,家族性高胆固醇血症诊断没有通用标准,广泛应用的是2019年EHJ杂志中提到的荷兰的临床诊断标准,其中提到FH诊断通常基于临床表现,需通过DNA分析进一步验证。
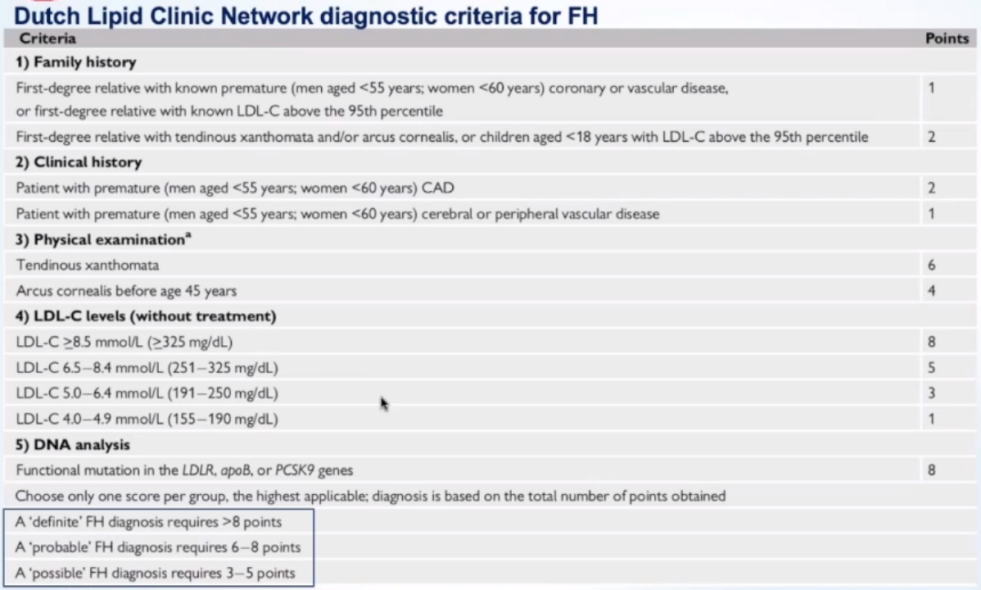
除了上述荷兰标准外,英国的“The Simon Broome diagnostic criteria”提到要结合临床、体检和化验资料来综合诊断。“Make Early Diagnosis and Prevent Early Deaths (MED-PED) criteria”提示要更多关注脂质水平和家族史而非临床特征或基因检测。
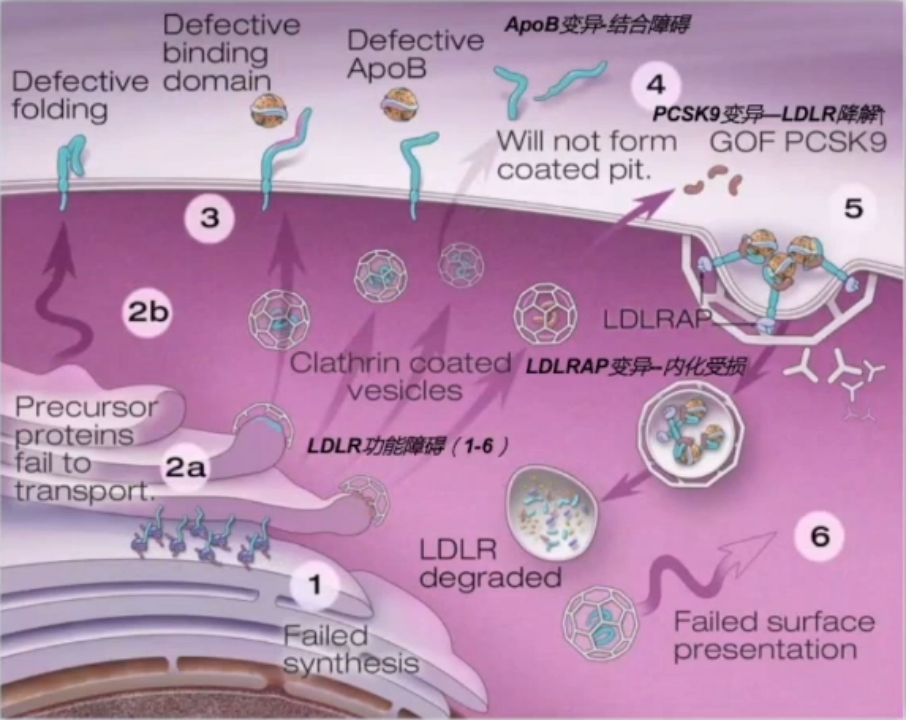
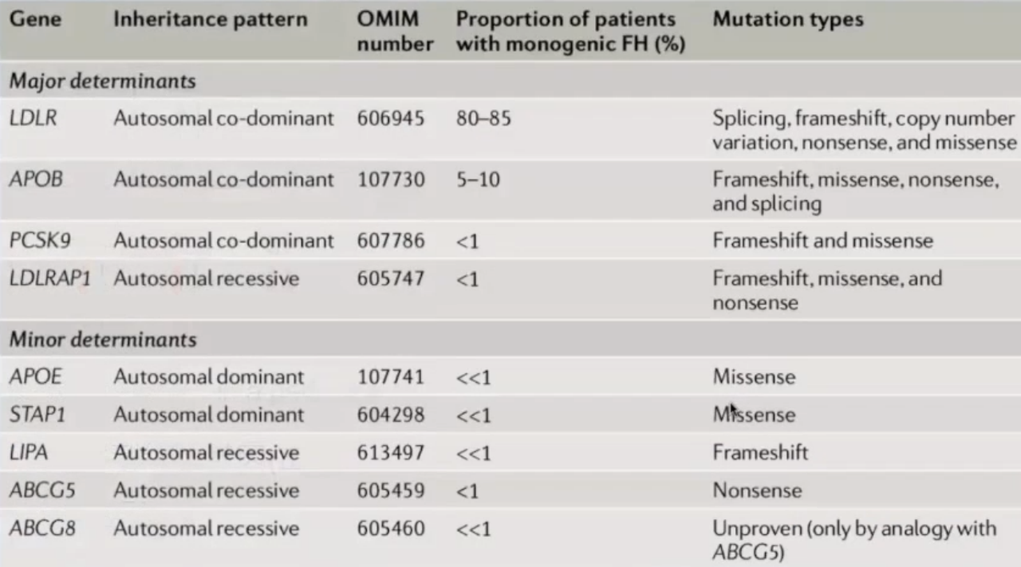
1.LDLR 基因,LDLR基因外显子共1741种突变,1064种致病性突变。
2.ApoB 基因,ApoB基因外显子有8种疾病相关突变且多位于外显子26。
3.PCSK9基因,主要针对功能获得性突变。
4.遗传模式:主要符合单基因显性遗传模式。
25%∶野生型等位基因(正常);50%∶杂合子;25%∶纯合子。
单基因频率:LDLR(>95%);APOB (2-5%);PCSK9(<1%);LDLRAP1(<1%)。(LDLR adaptor protein 1)
在FH的基因筛查时,既要考虑到主要和罕见地单基因致病因素,还应考虑到多基因致病一单核苷酸多态性(single nucleotide polymorphisms, SNPs)。从下图可以看到有多个基因位点单核苷酸突变可以导致小程度地LDL-C升高,但如果一个患者同时合并了多种SNPs,最后的累积效应也可以达到非常显著地胆固醇水平增高。
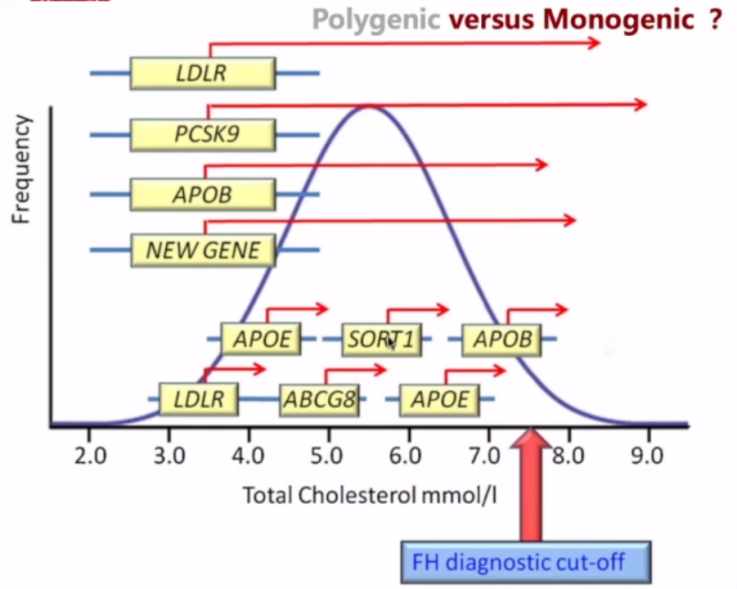
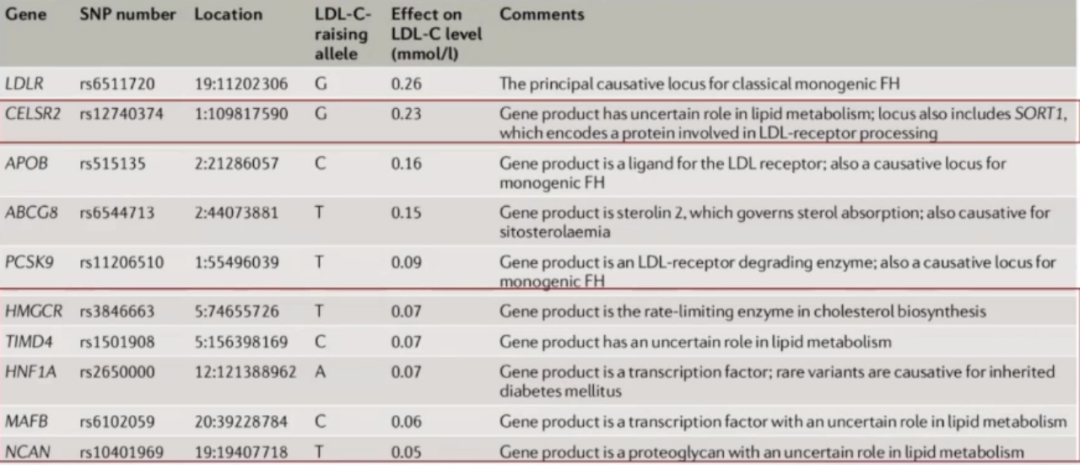
2019年Nat Rev Cardiol杂志地研究数据显示,目前超过50个基因组位点的SNP与LDL-C水平升高相关,这些小效应位点可逐渐累积,将LDL-C水平升高至与APOB、LDLR或PCSK9基因致病性突变类似的水平。
多重临床危险因素共同影响心血管预后。对于FH患者的风险管控,从思路上跟一般地高胆固醇血症危险分层相类似。FH患者的动脉粥样硬化疾病发生风险同时受到了其他ASCVD危险因素的影响,例如:
2.脂代谢表型:LDL-c水平及暴露时间、Lp(a)水平、富含甘油三酯脂蛋白残粒及HDL-C水平。Total cholesterol(TC) burden =TC *age at diagnosis+annually assessed。
3.行为因素。
亚临床动脉粥样硬化指标评估:
1.冠状动脉钙化积分
-
预测无症状FH患者冠脉事件发生风险;
-
对LDL-C下降的反应较差,相反可因他汀治疗而增加。
2.颈动脉内膜中层厚度(Carotid intima media thickness,cIMT)
-
25-90%的无症状FH患者颈动脉超声提示存在动脉粥样硬化斑块;
-
反映他汀治疗后LDL-c下降。
3.冠脉、颈动脉斑块负荷
-
与FH患者冠脉事件发生独立相关
4.外周血管、脑血管影像
-
FH患者缺血性脑卒中风险增加尚未明确
ASCVD风险综合评估:
ASCVD风险包括FH遗传背景、LDL-C、既往心血管疾病、亚临床动脉粥样硬化负荷、经典心血管风险因素。对于一般高胆固醇血症患者的一级预防人群而言,可以采用10年ASCVD发病绝对风险进行评估。对于FH患者,一项加拿大横断面研究对670位LDLR基因突变的成年FH患者进行评估,研究提示Montreal-FH-SCORE>20,ASCVD风险升高10倍。
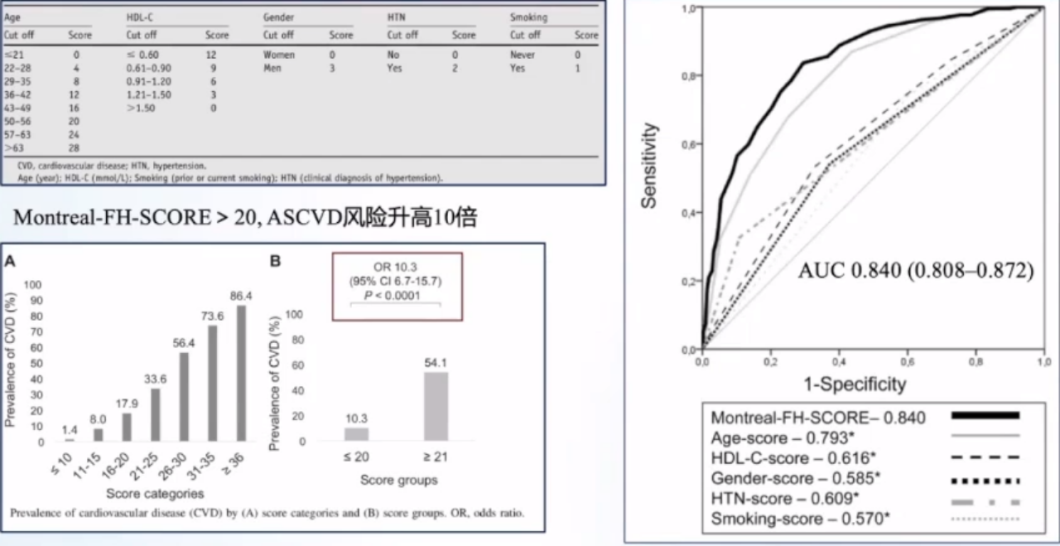
SAFEHEART危险评估是西班牙的队列研究,纳入了2404位LDLR、APOB基因突变的成年FH患者,危险因素有性别、年龄、ASCVD病史、血压、BMI、吸烟、LDL-C和Lp(a)水平。此外,另一项研究以20岁女性FH患者为例预测5年、10年新发ASCVD风险。
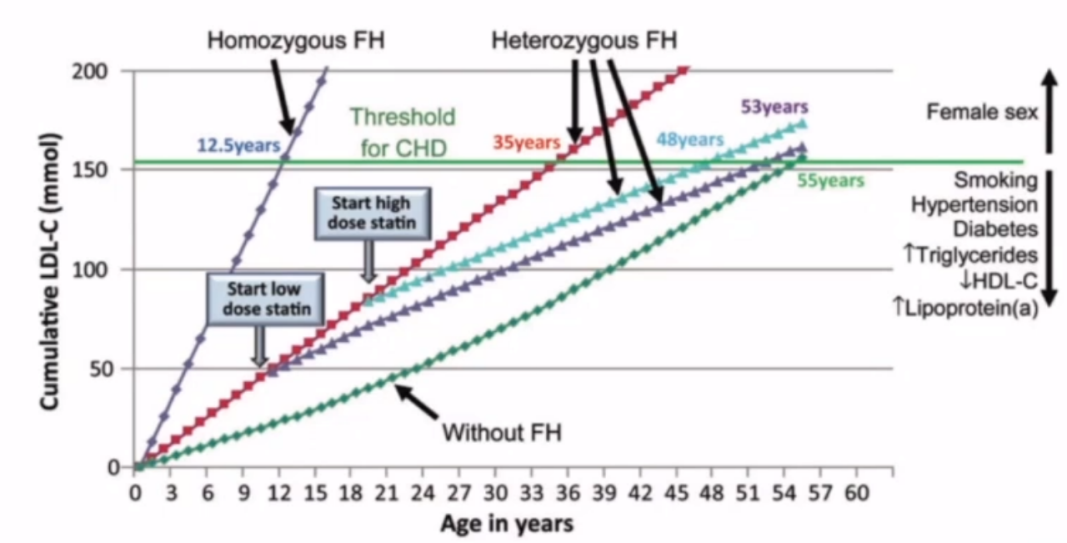
根据上述风险评估,国际动脉粥样硬化协会制定了严重FH标准:表型LDL-C水平及危险因素;亚临床动脉粥样硬化特征;以及ASCVD。早期降脂治疗非常重要,对于ASCVD发病风险极高的人群,要关注风险,早期积极干预。下图解释了胆固醇负荷跟ASCVD发病风险的关系:胆固醇负荷除了绝对水平以外,它在绝对水平的持续时间共同决定了发病风险。因此,要早期干预,将水平维持在靶标,长期达标。
FH成人患者管理
1.生活方式干预
-
低饱和脂肪、富含多不饱和脂肪的食物,如地中海饮食、得舒饮食;
-
戒烟限酒;
-
体重管理BMI降至正常范围;
-
运动,无禁忌,60分钟/日有氧运动,每周两次肌力训练;
-
避免不良情绪。
2.控制危险因素及合并症
3.降脂治疗
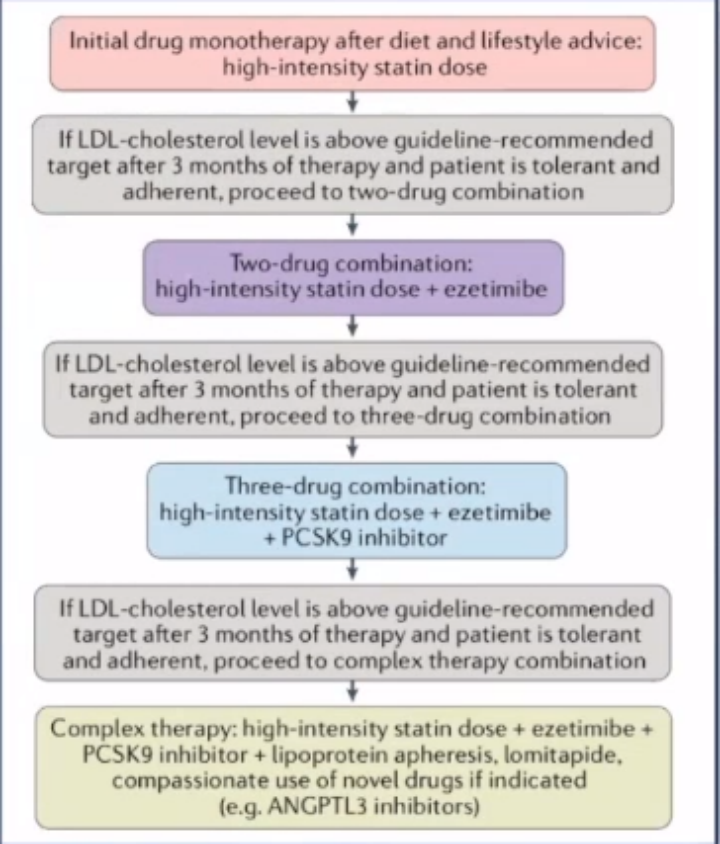
2019 年ESC/EAS关于HeFH治疗建议的指南推荐如下:
-
建议对有ASCVD或有其他主要危险因素的FH患者按照极高危险分层进行治疗,对既往无ASCVD或其他危险因素的FH患者按照高危分层进行治疗。(Ⅰ,C)
-
对于患有ASCVD的FH患者,建议降脂目标为LDL-C比基线水平降低50%同时LDL-C<1.4mmol/L(<55mg/dL)。如果达不到该目标,则建议联合用药。(Ⅰ,C)
-
在一级预防中,对于极高危的FH人群,应考虑将降脂目标定为LDL-C比基线水平降低50%同时LDL-C<1.4mmol/L(<55mg/dL)。(Ⅱa,C)
-
在极高危的FH患者中,如果最大耐受性他汀类药物加依折麦布仍没有达到降脂目标,那么推荐使用PCSK9抑制剂治疗。(Ⅰ,C)
JACC杂志研究显示1559名无基础CAD的杂合子FH患者,中-高强度他汀治疗降低CAD及全因死亡风险约44%。其他研究提到依折麦布降低LDL-C约18%,在FH患者中,依折麦布联合辛伐他汀组较辛伐他汀单药组LDL-C多降低16.5%,颈动脉内膜中层厚度无明显差异。此外,主要治疗终点的Kaplan-Meier曲线显示:主要终点的Kaplan-Meier发生率在第7年,辛伐他汀-依西替米组32.7%,辛伐他汀单药治疗组34.7%;绝对风险降低2.0%。主要终点事件包括心血管死亡、非致死性心肌梗死、需要再住院治疗的不稳定心绞痛、冠状动脉血运重建或非致命性卒中。
对于一个基线LDL-C在7-8的患者,即使降低50%胆固醇的幅度也不能达标。当然,胆固醇吸收抑制剂可以让LDL-C水平进一步降低,仍然不能满足临床需求。
显然,PCSK9抑制剂的出现和上市对FH患者,尤其是杂合子患者疗效显著。抗PCSK9单克隆抗体与循环PCSK9结合,阻断PCSK9与细胞表面LDL-R的相互作用;导致LDL-R增加和血浆LDL降低;接受最大耐受剂量的他汀+依折麦布HeFH患者抑制PCSK9可额外降低LDL-C 60%。
对于PCSK9抑制剂,SPIRE 研究亚组分析认为:Bococizumab对主要不良心脏事件风险的降低在FH患者和非FH患者中相似(-17%vs-21%);Evolocumab在高血浆Lp(a)浓度、冠状动脉病变范围广的患者中对不良心血管事件的降低程度更大。研究主要终点的累积发生率:ACS患者LDL-C>2.6 mmol/l,在4年时,Alirocumab组和安慰剂组主要终点的Kaplan-Meier发生率分别为12.5%和14.5%。主要终点包括:死于冠心病、非致命性心肌梗死、致命性或非致命性缺血性卒中或需要住院治疗的不稳定心绞痛。
对于纯合子FH患者,由于LDL-C受体往往没有功能,故在这类患者中使用PCSK9抑制剂对LDL-C受体降低没有作用,因此需要寻找不基于LDL-C受体而降低LDL-C的药物。
新型调脂药物在HoFH中治疗进展:
2.APOB100合成抑制剂米泊美生:反义寡核苷酸,与apoB mRNA结合使其降解→富含apoB脂蛋白(LDL、VLDL和Lp(a))降低;降LDL-C作用不依赖于LDLR的表达。
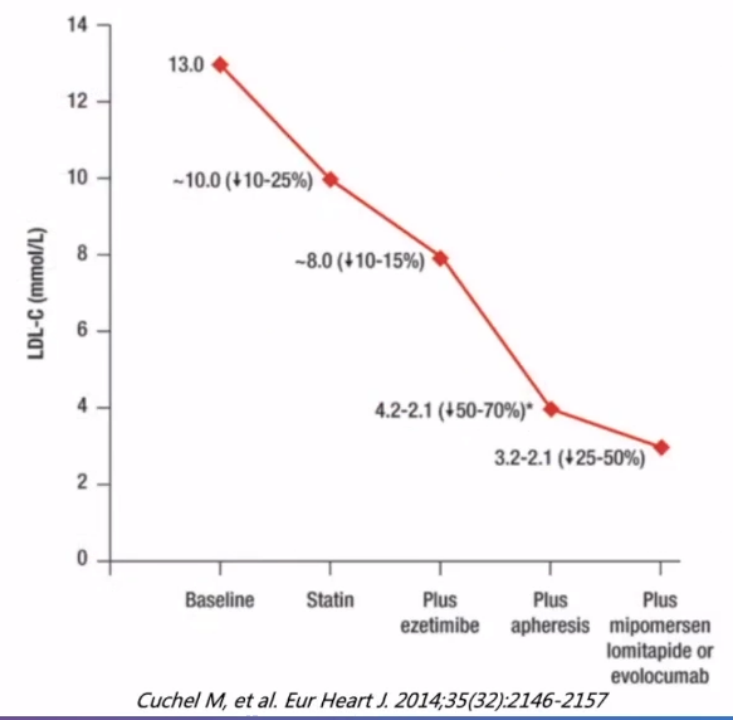
有研究显示联合治疗进一步降低HoFH患者LDL-C水平
李教授对FH的筛查、诊断和治疗作详细介绍,包括筛选和检测,临床诊断,基因检测,风险评估,临床治疗-成人和儿童,组织临床服务,建立患者网络和宣传,编码和研究登记;并强调对FH患者,要采取长期照护的模式。
截止目前,FH患者LDL-C降低的药物研发还在进行中,有很多从事基础研究的医生对胆固醇代谢的各个靶点还在进一步探索中。近期的生物制药技术,包括单克隆抗体,小分子干扰RNA,反义寡核苷酸等,一旦确认了靶点后很容易研制成新药进入临床转化。未来期待对于FH患者有更多新药物可以应用于临床,有效降低患者胆固醇水平。否则临床上对于纯合子患者而言,可供选择的诊疗方式就是非药物治疗,包括血浆置换(费用高、暂时性滤过LDL-C)和肝脏移植等。