张慧平教授:TAVR术后传导阻滞管理新模式

经导管主动脉瓣置换术(TAVR)作为中高危主动脉瓣病变患者的有效治疗方法,显著改善了患者预后,但术后传导阻滞仍是不可忽视的并发症,尤其是高度房室传导阻滞(HAVB)和左束支传导阻滞(LBBB)在TAVR术后较为常见,可能导致患者需要植入永久起搏器(PPM)。但既往研究曾表明,TAVR术后植入PPM患者的远期起搏依赖比例<50%,这提示TAVR引起的传导系统损伤可能会伴随炎症水肿消退而自行恢复。近期,北京医院张慧平教授作“TAVR术后传导阻滞管理新模式”汇报,并强调在临床工作中,我们在术前要重视CT影像分析,综合考虑患者具体情况和个体差异,制定个性化诊疗方案;术中熟练掌握TAVR操作技巧;术后密切随访,及时监测患者传导系统恢复情况;从而更好地优化患者预后、减少并发症并提高生活质量。
01
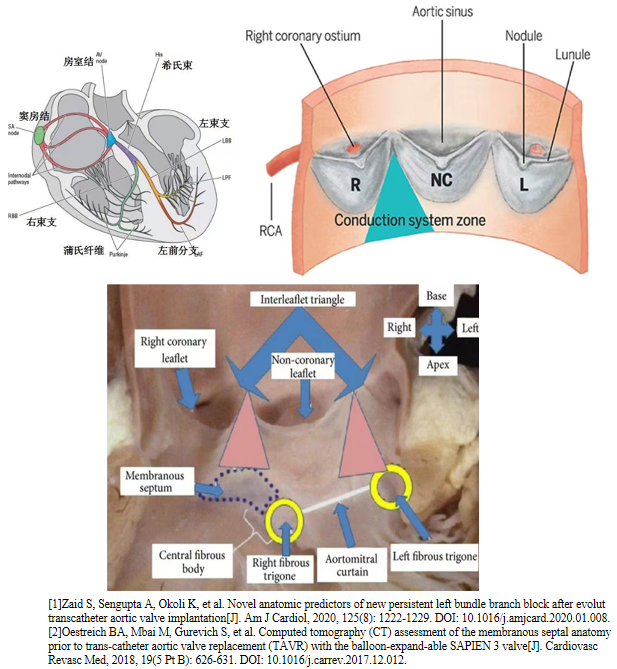
TAVR术后HAVB的解剖学基础
房室结位于冠状静脉窦和三尖瓣环间的Koch三角区。希氏束和左束支近段与无冠瓣和右冠瓣的叶间三角毗邻,接近左心室流出道的瓣膜远端着陆区。临床上,经常发现心脏的传导组织在瓣膜植入过程中可能会因受到直接或间接的刺激或压迫而受损伤。而且,在对TAVR术后新发传导阻滞并发生猝死的患者进行尸检后发现,与瓣膜膨胀处毗邻的室间隔内存在局限性血肿,并迫使希氏束受压或出现希氏束和左束支纤维萎缩。
02
TAVR术后PPM发生率及指征
TAVR术后PPM发生率
研究数据显示,大多数(86.4%)HAVB发生在TAVR手术中,球囊预扩张及瓣膜植入即刻均可能发生,迟发HAVB多发生在TAVR术后7d内,占7.2%。而且,在TAVR发展早期,术后PPM发生率约为4.0%-37.7%,现阶段为3.4%-25.9%。此外,CoreValve/EvolutR自膨瓣置换术后PPM发生率约为14.7%-26.7%,SAPIEN-3球扩瓣置换术后PPM发生率约为4%-24%。对于中国而言,TAVR多使用国产自膨瓣,早期术后PPM植入的发生率可达30%,目前约为6.54%。
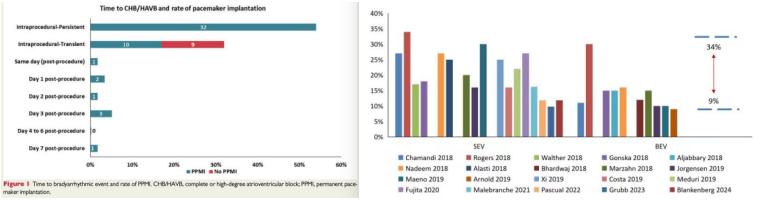
TAVR术后PPM植入指征
具体而言,不同国家对于TAVR术后PPM植入指征推荐各不相同。

03
TAVR术后PPM植入时机及起搏方式
TAVR术后PPM植入时机
关于TAVR术后PPM植入时机,不同国家也有不同的标准。2019年ACC《TAVR相关传导异常的管理》给出以下建议:
TAVR术前无右束支传导阻滞(RBBB),术后即刻无心电图改变的患者,术后可移除临时起搏器,心电远程监测24h后若出现缓慢性心律失常或新发传导阻滞,可参照下方图流程进行处理;
TAVR术前合并RBBB、LBBB、QRS≥120ms的室内传导延迟或一度房室传导阻滞,术后即刻发生心电图改变(QRS波群增宽或PR间期延长≤20ms)的患者,PPM植入时机可参照下方图的流程;
TAVR术前合并RBBB,术后即刻无心电图改变的患者,术后可留置临时起搏器24h,若24h后仍未出现心电图改变,则移除临时起搏器,并于住院期间持续心电远程监测。
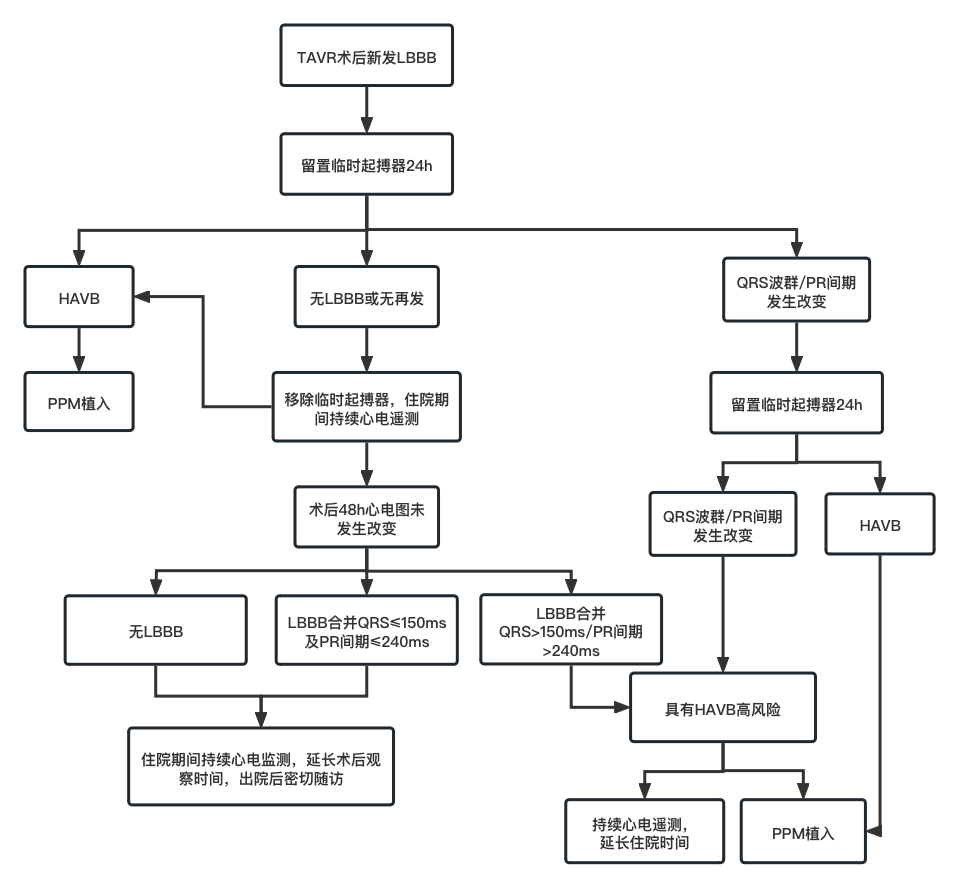
TAVR术后新发LBBB的患者,PPM植入时机可参照下方图流程:
TAVR术中出现一过性或持续性HAVB的患者,可留置临时起搏器24h;若24h后HAVB再发或出现持续性HAVB,则行PPM植入,反之则移除临时起搏器,于住院期间持续心电远程监测;若再发HAVB,应行PPM植入,若无HAVB但心电图显示传导异常,可参照上方图或下方图流程进行处理。

2021年ESC《心脏起搏和心脏同步化治疗指南》推荐:
对于TAVR术后新发HAVB、新发交替性束支阻滞的患者何时行PPM植入尚无明确阐述,对于术后其他情形下PPM植入时机的指导建议如下方图所示。

TAVR术后行PPM植入的部分患者在随访期间会逐渐摆脱起搏器依赖。REPRISE Ⅲ研究表明,起搏依赖是一种动态现象,大多数TAVR术后30d内行PPM植入患者的心脏传导并不依赖起搏器,20%-40%的患者在随访1年时摆脱起搏器依赖,持续起搏器依赖的患者约占22%-64%。
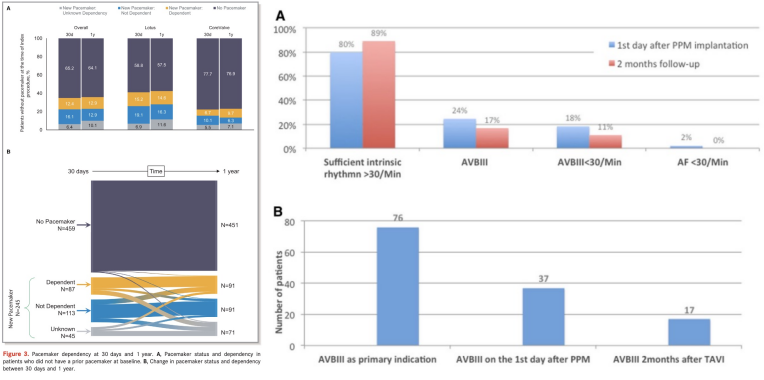
2023年中国《经导管主动脉瓣置换术临床实践指南》推荐:TAVR术后不同程度房室传导阻滞患者保留临时起搏电极48h以上,术后迟发性房室传导阻滞可视心律情况行PPM植入。由此可见,目前临床证据有限,TAVR术后PPM植入的最佳时机仍没有明确答案,PPM植入与否仍很大程度上取决于经治医生。
值得庆幸的是,心室主动电极体外临时持续起搏技术可在一定程度上避免发生传导功能延迟恢复的部分患者植入PPM,该技术可使患者尽早活动,同时不增加电极脱位的风险,将临时起搏器植入时间延长至2-4周。
TAVR术后PPM起搏方式
传统右心室起搏为非生理起搏方式,术后PPM植入的患者存在远期心力衰竭风险。生理性起搏能够恢复或维持心室收缩同步,包括心脏再同步化治疗(CRT)和传导系统起搏(CSP):前者通过双心室起搏实现,后者将心室电极植入希氏束或左束支区域,直接夺获传导系统,使心室收缩同步;TAVR相关HAVB主要与希氏束受损相关,但希氏束起搏并不能纠正房室传导,目前更推荐左束支区域起搏。此外,生理性起搏相关研究正在广泛开展中,有望在TAVR术后需行PPM植入的患者中广泛应用。

04
TAVR术后PPM植入预测因素
临床上,很多因素都会造成TAVR术后PPM植入,包括患者基线特征和围术期因素两大方面。

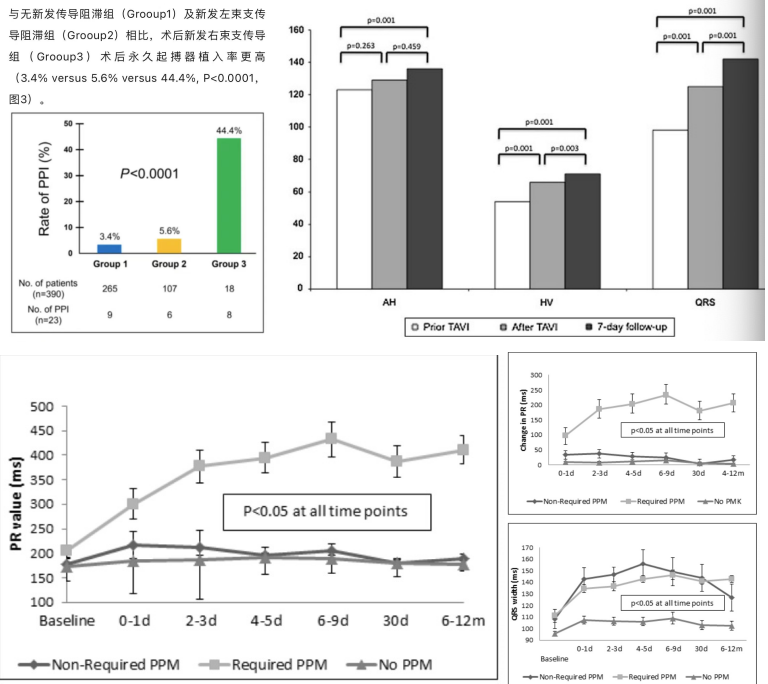
TAVR术后PPM植入预测因素——电生理因素
现已明确,基线RBBB以及术后新发LBBB显著增加TAVR术后PPM植入的发生率,尤其是术前存在RBBB的患者,TAVR术后PPM植入风险增加近5倍。TAVR术后新发LBBB较常见(13.3%~37.0%),故术后新发LBBB时,右束支传导功能的完整性对于维持剩余的房室传导至关重要。近期研究发现,TAVR术后新发RBBB也具有较高的PPM植入风险。而且,TAVR术后QRS增宽和PR间期延长可能提示房室结和希氏束以下传导系统受损。有研究发现,82%的TAVR术后PR间期延长的患者有新发希氏束-心室(HV)间期延长。当HV间期>70ms时,房室传导阻滞风险增加4倍。
TAVR术后PPM植入预测因素——解剖学因素
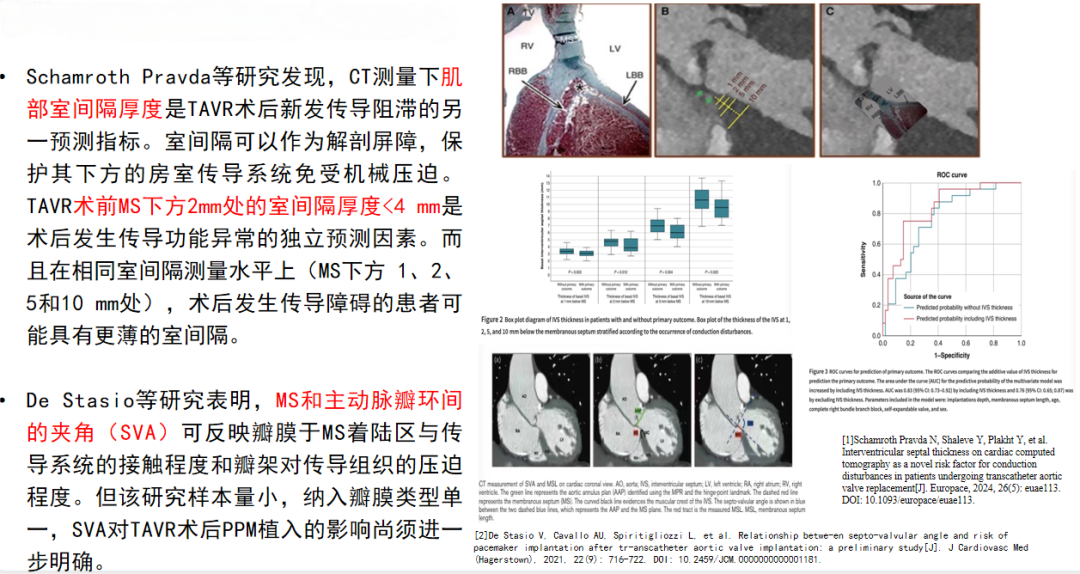
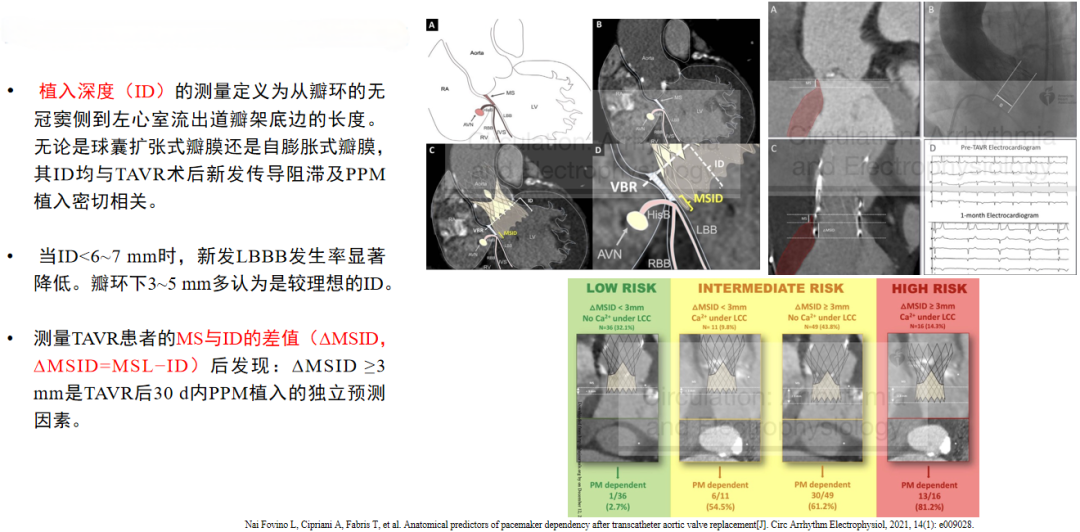
对于TAVR手术,室间隔膜部(MS)长度是必须要测量的一项指标,研究发现MS长度越短,术后PPM植入风险越高。

此外,室间隔肌部厚度也是一项重要考量的因素。研究发现TAVR术前MS下方2mm处的室间隔厚度<4mm是术后发生传导功能异常的独立预测因素。
另一项研究表明,瓣叶钙化分布不均、左冠窦下LVOT及左冠窦瓣叶显著钙化易致主动脉瓣环及其毗邻结构径向受力不均,瓣膜植入后传导通路中断,术后PPM植入风险显著增加。左冠窦及二尖瓣前叶间的三角区域——主动脉瓣-二尖瓣移行区,毗邻房室传导系统,此区钙化与TAVR术后PPM植入的风险独立相关,且钙化评分>300分时PPM植入风险最大。
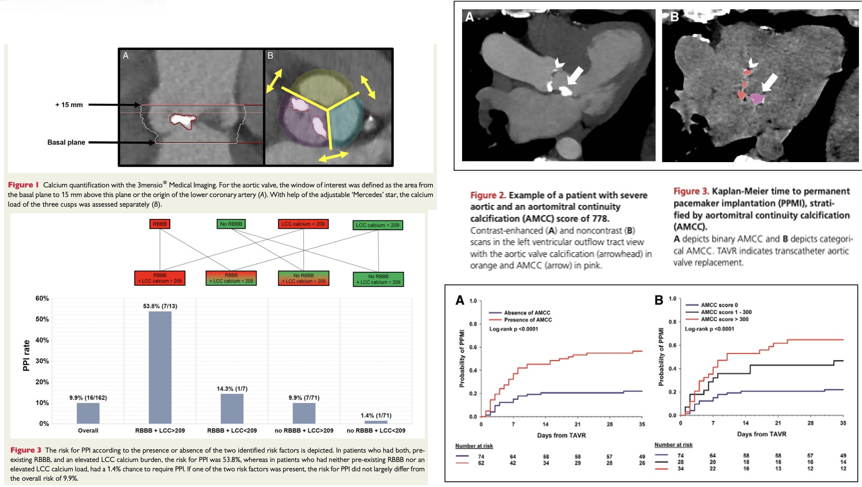
我国TAVR患者中BAV的比例高达40%。BAV常合并主动脉根部扩张、主动脉瓣环偏心率大、MS较短、瓣叶较长且形态不规则、瓣叶钙化重且呈偏心分布、瓣叶结合部粘连钙化等,这使得人工瓣膜易发生扩张不充分或延迟移位,传导系统径向受力不均,增加了TAVR术后PPM植入风险。早期BAV和TAV的TAVR术后PPM植入发生率分别为17%和26%,现阶段这一比例为9.9%和8.6%。瓷化主动脉、跨主动脉瓣高压差及偏心性LVOT均与TAVR术后PPM植入发生率增加有关。
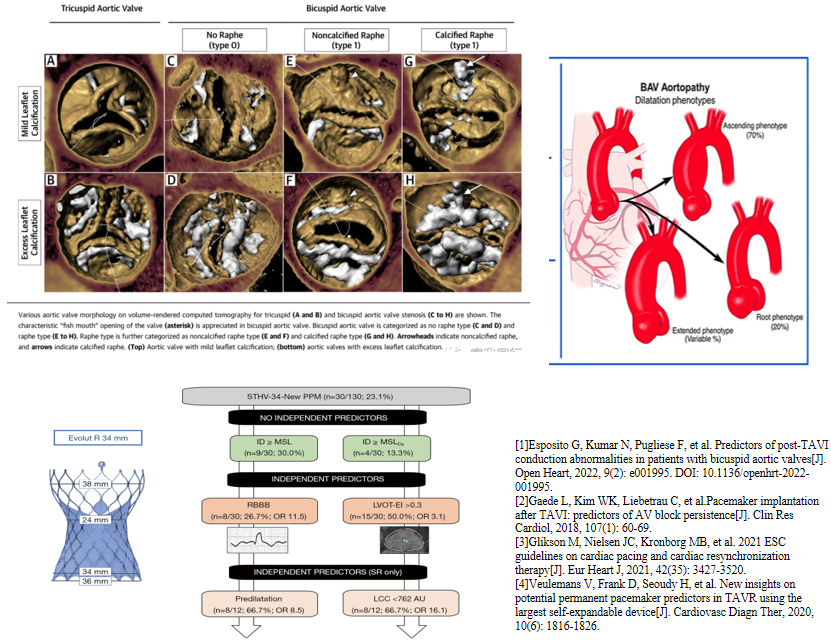
TAVR术后PPM植入预测因素——围术期因素
研究表明与球扩瓣相比,自膨瓣的TAVR术后PPM植入率更高(6.5% vs.17.4%),自膨瓣是TAVR术后PPM植入的预测因素之一。与接受球扩瓣(SAPIEN-3/SAPIEN-XT)的患者相比,植入自膨瓣(CoreValve)患者的术后PPM植入发生率高近5倍。这可能与自膨瓣的自膨胀特性和高径向支撑力有关。适当增加瓣膜尺寸,外加某些类型瓣膜的裙边设计,可有效减少瓣周漏,但也会增加新发传导阻滞风险。对于MS较短的患者,短瓣架的球囊扩张式瓣膜有助于减少对传导组织的压迫。
另两项研究表明,大型号瓣膜与TAVR术后PPM植入的需求增加有关。
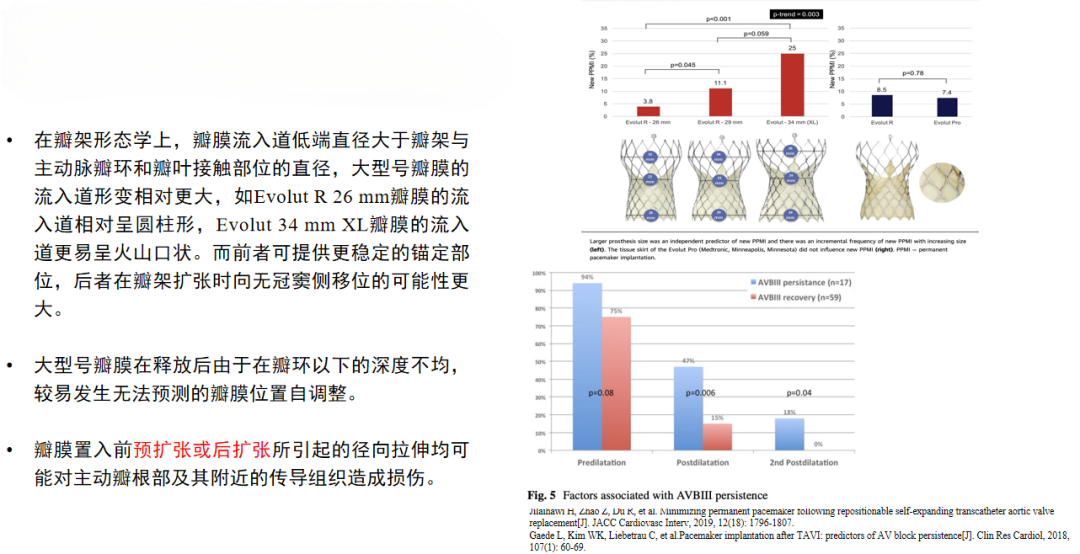
实际上,周长拉伸指数也就是oversize比率,既往研究表明瓣膜型号越大对传导组织或流出道压迫的径向力越大,也进一步增加了术后PPM植入的风险。

2021年的一篇研究指出,ΔMSID≥3mm是TAVR术后30d内PPM植入的独立预测因素。
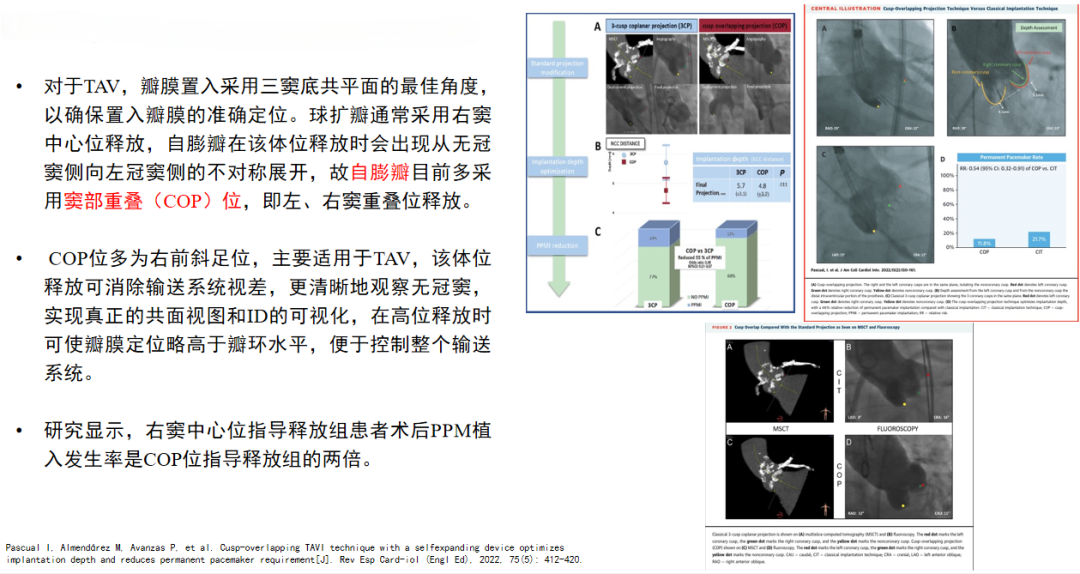
2022年的另一篇研究显示,右窦中心位指导释放组患者术后PPM植入发生率是窦部重叠(COP)位指导释放组的两倍。
此外,2020年还有研究显示,瓣架-瓣环夹角是TAVR术后PPM植入的独立预测因素。

05
TAVR术后PPM植入对预后的影响
在一项研究中,Buellesfeld等人评估了353例TAVR患者,其中27%在术后需PPM植入,随访发现PPM植入与全因死亡率、心脑血管事件发生率无关。另外一项SWEDHEART注册研究表明,接受或未接受PPM植入患者的长期生存没有差异。
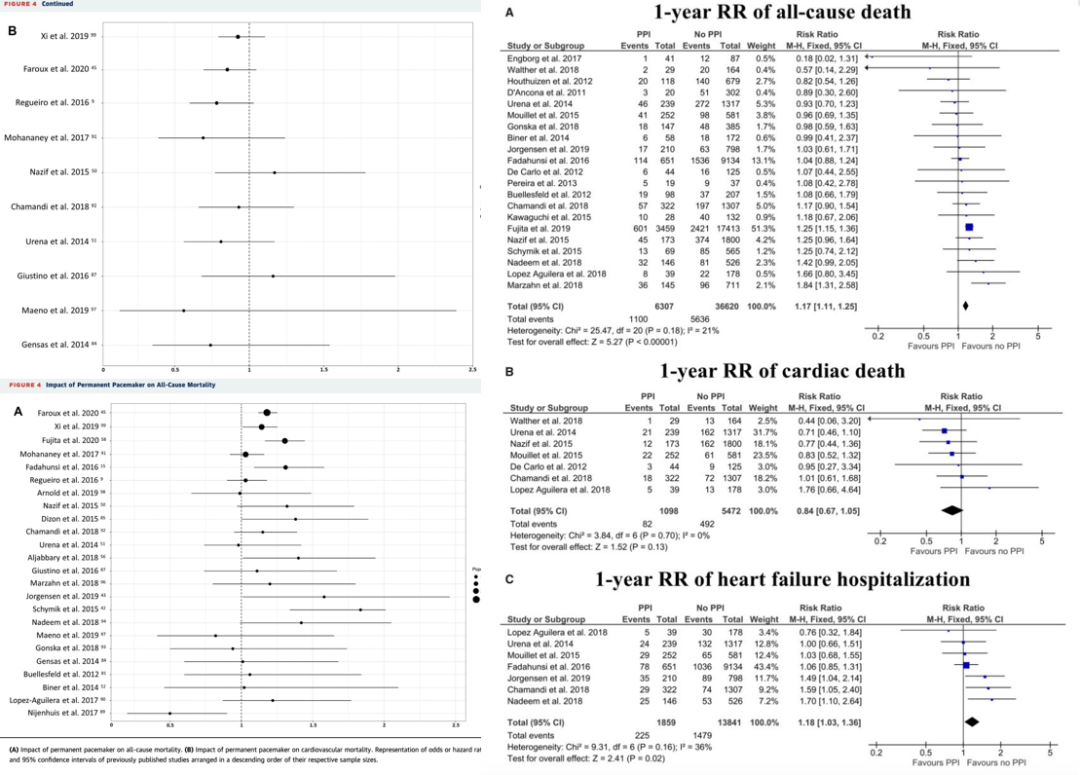
然而,有学者对42927例TAVR患者进行荟萃分析后发现,术后PPM植入增加全因死亡风险(RR=1.17),但未增加心血管死亡风险(RR=0.84)。Costa等人的研究表明,TAVR术后PPM植入患者,尤其是依赖起搏器的患者,与未行PPM植入的患者相比,随访6年生存率降低。

综上所述,关于TAVR术后PPM植入对患者预后的影响,虽然总体上对MACE事件并没有显著性差异,但是对于患者而言还是需要综合评估来决定是否进行起搏器植入,尽量减少对患者的损伤。
06
新模式之案例分享
Case1
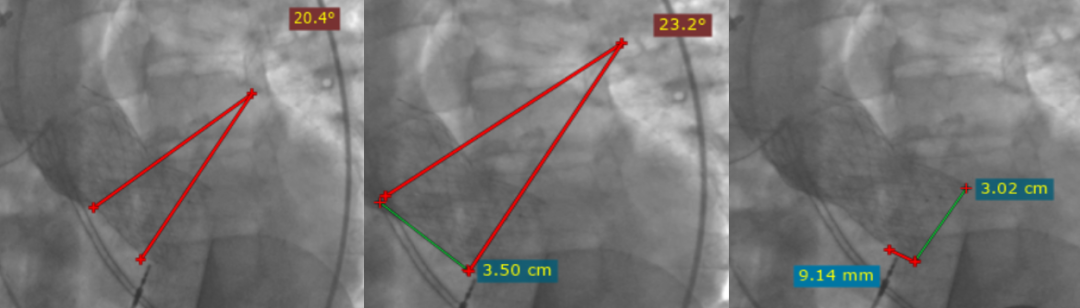
患者术前CT评估为三叶式主动脉瓣,瓣叶边缘均匀钙化,周长径25.5mm。
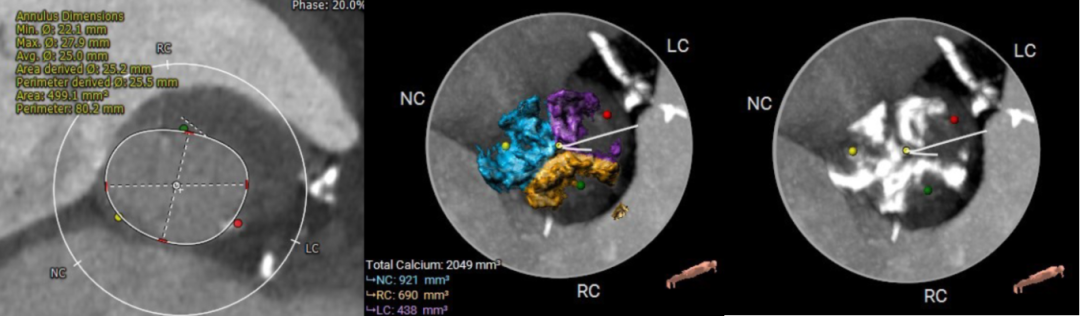
放置Venus-A Plus 29mm瓣膜,植入深度9.14mm。术后即刻发生起搏依赖,经股入路放置临时起搏器。
术后一天患者在CCU发生阿-斯综合征,考虑起搏器电极脱位,在紧急稳定电极位置后放置PPM。考虑到患者在TAVR术后,压迫、水肿消退时可以自行恢复,故给予术后观察1-2天处置,但该患者情况较复杂,以致完全依赖起搏器。

Case2
患者术前CT评估周长径23.6mm,钙化不严重。

放置Venus-A Plus 26mm瓣膜,位置适中。
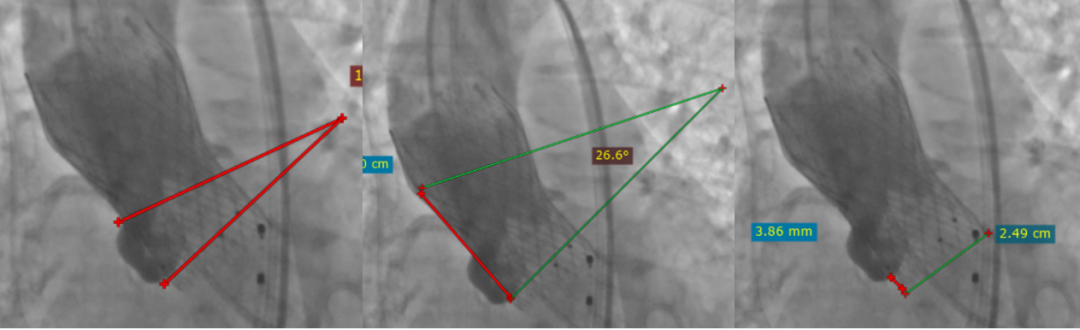
患者术后QRS波形态向LBBB趋势发展,但并没有出现明显传导异常,考虑到自行恢复的可能性更大,遂撤除主动电极。但术后5天患者出现阿-斯综合征,最终急诊植入PPM。
Case3
患者主动脉瓣反流,术前评估解剖结构适合进行TAVR手术,且瓣上结构可以提供锚定位置。
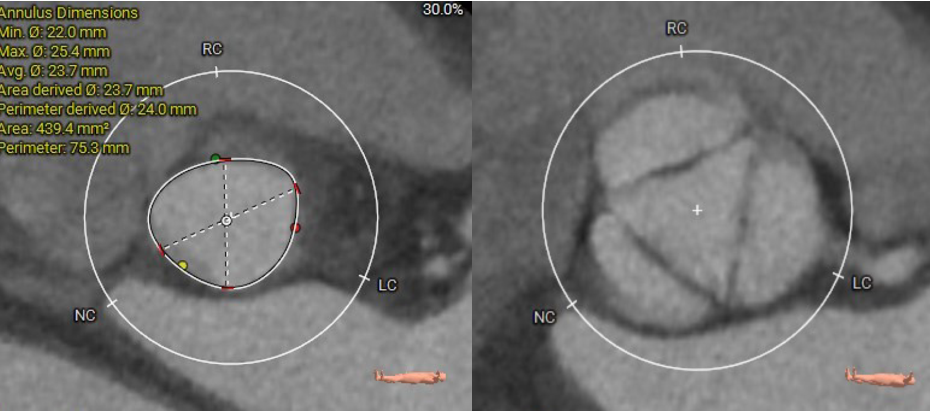
放置MicroPort TAV 30mm瓣膜,术后反流完全消失。
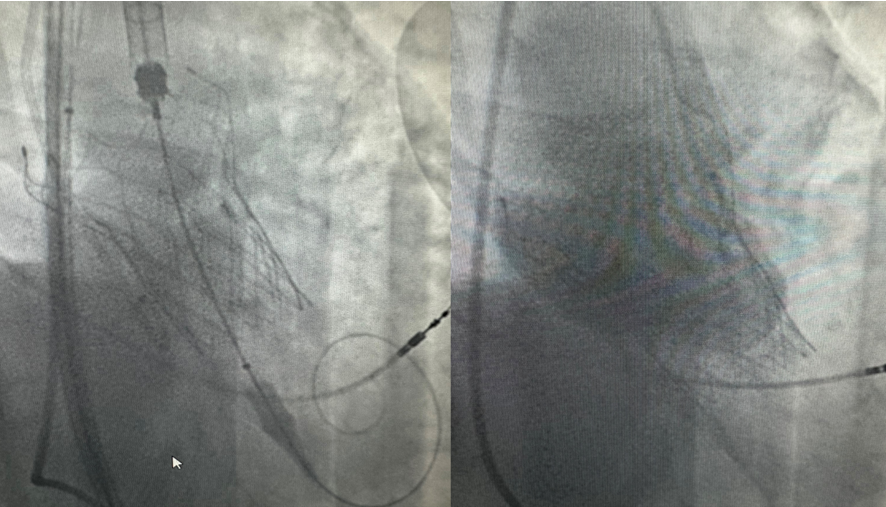
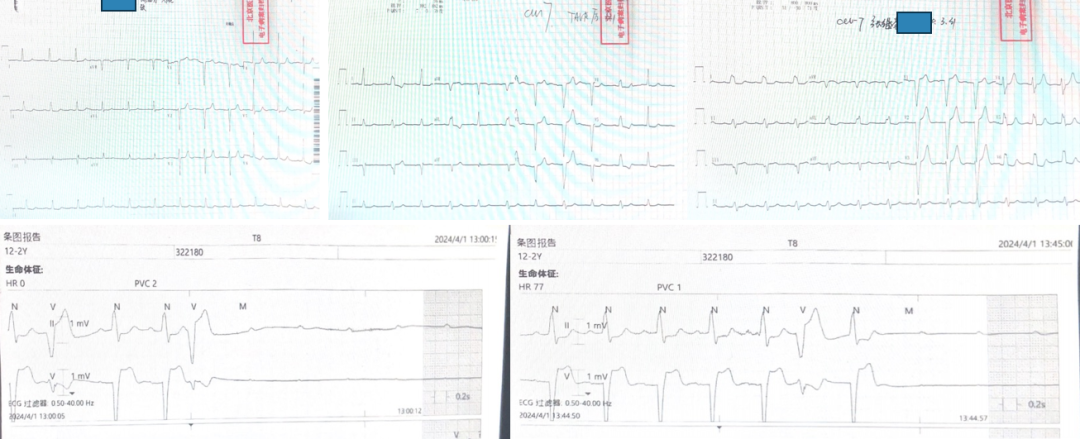
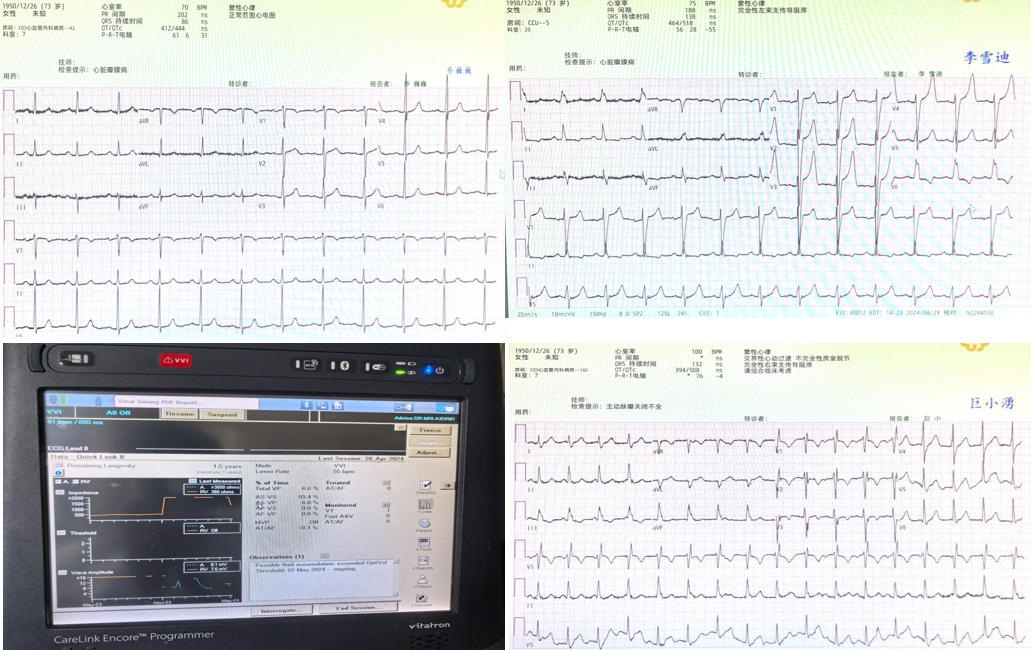
患者术前心电图正常,术后心电图提示LBBB,延长观察并给予两次起搏器程控(第一次55次/分、第二次40次/分),在恢复自主起搏后拔除主动电极,但术后17天又出现了RBBB,虽然该患者血流动力学稳定,也无其他症状,但考虑到患者的生命安全,以及指南推荐对于术后交替出现的束支阻滞需植入PPM的指征,我们最终为患者植入PPM。
总结
TAVR术后PPM植入确实存在一些好发因素,这些因素涵盖了多个方面,包括患者的解剖结构特点、手术过程中的策略技巧以及术前CT分析的准确性等。然而,值得注意的是,尽管这些因素对于预测PPM植入的风险具有一定指导意义,但具体到每位患者时,还需要根据其独特的病情和身体状况来制定个体化的策略。
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动