人体首次使用可降解封堵器经胸微创室间隔缺损封堵的安全性、有效性及并发症:一项为期12个月随访的队列研究
Qiang Zhang1, Jing Zhou1, Shanliang Zhu2, Hao Liu2, Yu Mao2, Ying Tang2, Xuming Mo3, Jun Chen2
1南京医科大学盐城临床医学院,盐城市第三人民医院超声科,江苏盐城,中国;
2南京医科大学附属儿童医院超声科,江苏南京,中国;
3南京医科大学附属儿童医院心胸外科,江苏南京,中国
背景:
室间隔缺损(VSD)是最常见的先天性心脏病之一。本研究旨在评估经食道超声心动图(TEE)引导下全降解封堵器经胸微创封堵VSD的临床价值及益处,总结手术的关键点,并分析短期和中期治疗随访结果。
方法:
我们回顾性分析了2019年6月至2022年6月期间成功使用TEE引导完全可降解封堵器进行微创封堵的24例儿童VSD病例。术前通过TEE详细检查缺损的位置、大小及其周围解剖关系,帮助选择合适的封堵器,并全程引导封堵过程。所有患者均随访1年。
结果:
在我们研究的病例中,13例为膜周型VSD,11例为合并膜部瘤VSD。术前通过TEE测得的VSD有效分流大小范围为2.8至4.9 mm,缺损距主动脉瓣的距离为2至6 mm。所使用的封堵器直径为6至8 mm。所有24例手术均成功。TEE确认封堵器紧密贴合VSD边缘。术后23例无残余分流,仅1例在封堵器边缘存在小的左向右分流(<1.5 mm)。随访时间为术后3天,以及术后1个月、3个月、6个月和12个月,所有患者的封堵器位置均保持正常。除1例患者封堵器边缘有1.2 mm的左向右分流外,其他患者均无残余分流。封堵器从术后6个月开始降解,与术后第3天相比,左右封堵器盘的尺寸显著减小(P=0.003)。
结论:
TEE引导下的全降解封堵器用于微创VSD封堵具有创伤小、安全性高、并发症少等优势,近期疗效令人满意,具有良好的临床安全应用前景。
关键词:
超声心动图;生物可降解;封堵器;室间隔缺损(VSD);经胸
划重点
主要发现
-
经食道超声心动图(TEE)引导下使用全降解封堵器的微创室间隔缺损(VSD)封堵术,具有创伤小、安全性高、并发症少的优势,近期疗效令人满意,具有良好的临床安全应用前景。
已知与创新
-
经皮介入或经胸微创封堵已被认为是治疗VSD的安全有效方法。
-
医疗和外科介入中使用的封堵器通常由镍钛合金制成,是不可降解的。
意义与未来改变
-
经食道超声心动图(TEE)引导下,使用全降解封堵器进行微创膜周型VSD封堵的治疗方法,是值得进一步临床研究的方向。
引言
室间隔缺损(VSD)是最常见的先天性心脏病之一(1,2),占所有先天性心脏病的20%-30%。经皮介入或经胸微创封堵被认为是治疗VSD的一种安全有效的方法(3-7),这不仅可以有效减少手术操作的难度和创伤,还可以避免体外循环。然而,在医疗和外科介入中使用的封堵器通常由镍钛合金(8)制成,是不可降解的。六个月后,封堵器表面内皮化,其作用消失(9)。理想的封堵器应该在内皮化后逐渐降解,直至完全消失,避免体内长期存在异物。
目前,几乎所有国内外临床上使用的VSD封堵器,都是按照Amplatzer封堵器的原理制造或改进的(10,11),尽管国内封堵器的结构和性能已经得到进一步优化,其性能优于类似的进口产品。然而,这些封堵器依然是由镍钛合金丝为主要支架,内衬阻流膜,术后金属异物将终生留在心脏内。越来越多的临床随访数据显示,一些儿童在中长期内会出现与植入的金属异物相关的并发症(12-15),特别是延迟性致命的完全房室传导阻滞(16-18)。该技术的安全性受到质疑,美国食品药品监督管理局(FDA)尚未批准Amplatzer镍钛合金VSD封堵器用于临床。各类可降解的VSD封堵器仍处于动物实验阶段(9,19-22),是否能在人类中使用仍有很多问题需要解决。
南京医科大学附属儿童医院于2019年6月至2022年6月期间,在经食道超声心动图(TEE)引导和监测下,成功使用完全可降解封堵器进行微创VSD封堵的手术。本研究旨在探讨完全可降解封堵器的临床价值及应用,同时分析TEE在微创手术中引导和监测中的重要性。我们按照STROBE报告清单撰写了本篇文章(可在https://cdt.amegroups.com/article/view/10.21037/cdt-23-361/rc获取)。
方法
伦理考虑
本研究遵循《赫尔辛基宣言》原则(2013年修订版)。研究获得南京医科大学附属儿童医院伦理委员会批准(编号:2019-02-001-F01)。所有患者的家长或法定监护人均已签署知情同意书。
参与者
这是一项回顾性队列研究。我们纳入了24名VSD患儿,均来自南京医科大学附属儿童医院,年龄在1年6个月至10年3个月之间,体重在10至58公斤之间,包括10名男孩和14名女孩。所有患者在术前均接受了经胸超声心动图(TTE)检查。其中,13例为膜周部VSD,11例合并膜部瘤VSD。除5例同时合并卵圆孔未闭(PFO)外,其余19例均为单纯的VSD。所有患儿均未出现明显的瓣膜反流现象。治疗方案在获得患者家属的知情同意后得以批准。
该临床试验中儿童的纳入标准如下:(I) 年龄≥18个月,体重≥10公斤;(II) 单纯型室间隔缺损(VSD)伴随血流动力学异常,且无其他先天性心脏畸形;(III) 膜周部室间隔缺损;(IV) 有效分流直径≥3 mm 且 ≤10 mm;(V) 缺损与主动脉瓣的距离≥2 mm,且无主动脉右冠瓣脱入室间隔缺损及主动脉瓣反流;(VI) 室间隔缺损伴膜部瘤形成,且右心室流出道正常;(VII) 无感染性心内膜炎、心内膨出或其他感染性疾病。
设备
使用了Philips IE 33和Epic 7C彩色多普勒超声诊断仪器(飞利浦,美国)。经胸探头为S8-3和S5-1探头,频率为1至8MHz,TEE探头为S7-3t多平面探头,直径6 mm,频率为4至7MHz。
封堵器
全降解封堵器(图1)由上海形状记忆合金材料有限公司生产。封堵器的结构由聚对二氧环己酮(PDO)丝材编织而成,内衬聚乳酸膜,采用PDO丝材缝合,骨架内缝有阻流膜。所有部件都是完全可降解的。封堵器植入后,充当引导内皮化的临时桥梁,直至缺损被组织覆盖,然后封堵器逐渐降解,直至完全消失。
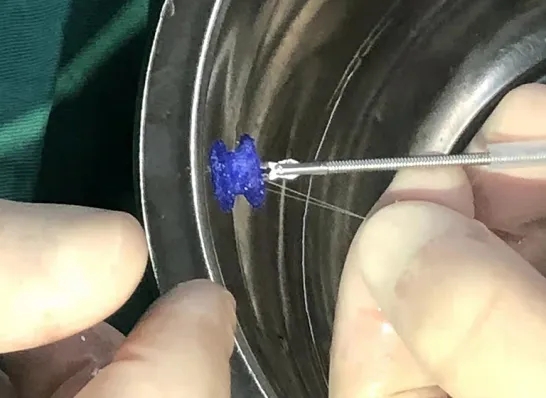
图1. 图中蓝色物体为全降解VSD封堵器。VSD,室间隔缺损
TEE引导手术技巧
术前通过TEE探头在0°-180°的范围内逐段检查,观察VSD位置及其与周围解剖结构的关系。测量VSD的大小,并选择合适的封堵器型号作为备选方案。患者仰卧位,在胸骨下方做1–2 cm的切口,纵向切开心包下部并进行悬吊。用食指轻压右心室前壁表面,避免冠状动脉。通过TEE引导,选择分流角度最小且与VSD距离最近的点作为穿刺点。通过TEE持续监测VSD的位置(图2)。
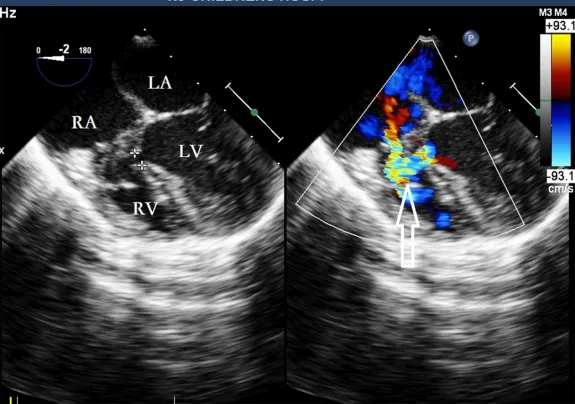
图2. 在TEE引导下选择分流角度最小且与VSD距离最近的点作为穿刺点(空心箭头)。VSD的位置通过TEE持续监测。VSD,室间隔缺损;TEE,经食管超声心动图;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
在VSD正对的点进行缝合,以便导丝尽可能垂直通过室间隔。选择20G穿刺针,悬吊后将导丝的直端插入右心室腔内(≤1 cm)。导丝通过VSD的分流束进入左心室(图3)。随后撤回穿刺针的外鞘,将9F或10F的输送鞘管沿着导丝输送到左心室腔内(图4)。通过TEE确认,在左心室腔内出现鞘管样回声,即“双轨征”(图5)。随后移除内芯和导丝。将装载好的全降解VSD封堵器插入输送鞘管,并释放封堵器的左侧伞盘(图6)。通过回拉推送杆,使左心室伞盘贴附于室间隔,过程中需小心避免损伤主动脉瓣和二尖瓣。如果伴有膜部瘤的VSD基底部靠近主动脉瓣,则需轻轻将封堵器的左心室伞盘拉入瘤体内,随后释放封堵器的腰部和右侧伞盘,使右侧伞盘贴附于室间隔的右心室表面。在TEE引导下进行多次推拉实验,确保封堵器位置正确,并通过彩色血流显影确认无残余分流(图7)。确认无误后释放封堵器(图8)。剪断成型线并沿一端将其撤出。封堵器释放后继续监测15分钟,以防止封堵器移位及其他并发症。
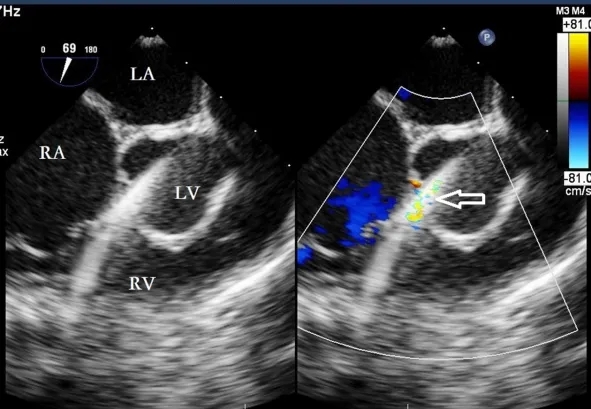
图3. 导丝(空心箭头)通过VSD的分流束进入左心室。VSD,室间隔缺损;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
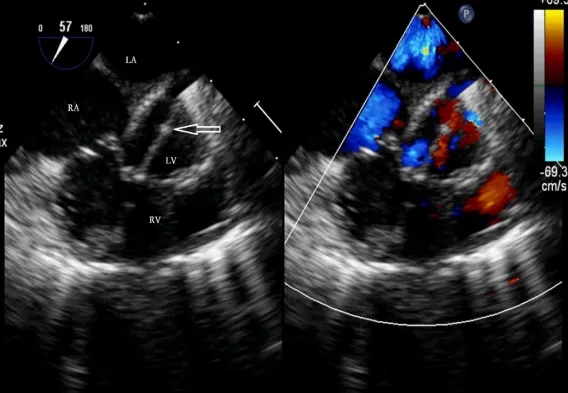
图4. 输送鞘管(空心箭头)沿着导丝进入左心室腔。VSD,室间隔缺损;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
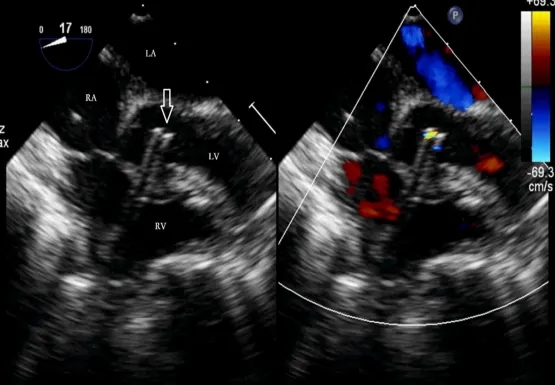
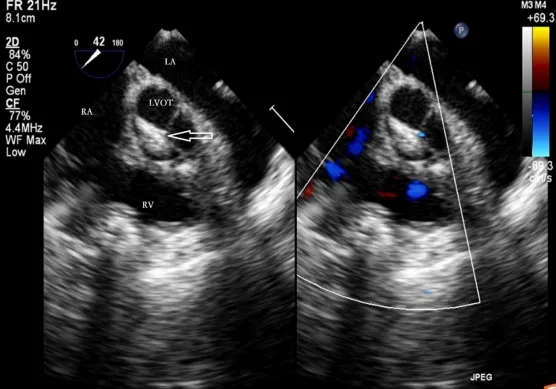
图5. 随后移除内芯和导丝。通过TEE确认,在左心室腔内出现鞘管样回声,即“双轨征”(空心箭头)。TEE,经食管超声心动图;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
图6. 封堵器的左侧伞盘已释放(空心箭头),通过回拉推送杆,使左心室伞盘附着于室间隔。RA,右心房;LA,左心房;LVOT,左心室流出道;RV,右心室。
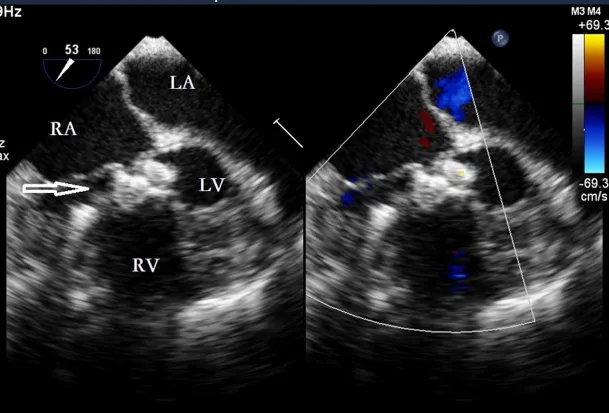
图7. TEE引导下确认封堵器位置正确,彩色血流显影无残余分流(空心箭头)。TEE,经食管超声心动图;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
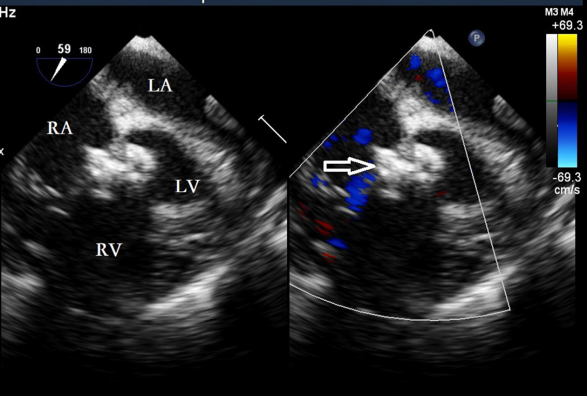
图8. 剪断成型线并沿一端撤出,封堵器被释放(空心箭头)。RA,右心房;LA,左心房;LV,左心室;RV,右心室。
结果
术前TTE检查结果
在13例膜周部VSD患者中(图9),有效分流大小为3–5.1 mm,左心室表面缺损的边缘距离主动脉瓣为2–5 mm。在11例合并膜部瘤VSD患者中(图10),瘤体基底部大小为5–10 mm,其中3例为单破口,5例为双破口,3例为多破口(≥3个破口),最大缺损破口为2.6–3.4 mm。膜部瘤的基底部靠近主动脉瓣,除1例VSD基底部距主动脉瓣3 mm外,其余10例距主动脉瓣不足1 mm。所有膜部瘤破口均距离主动脉瓣>2 mm。本组中有5例同时伴有卵圆孔未闭(PFO)。
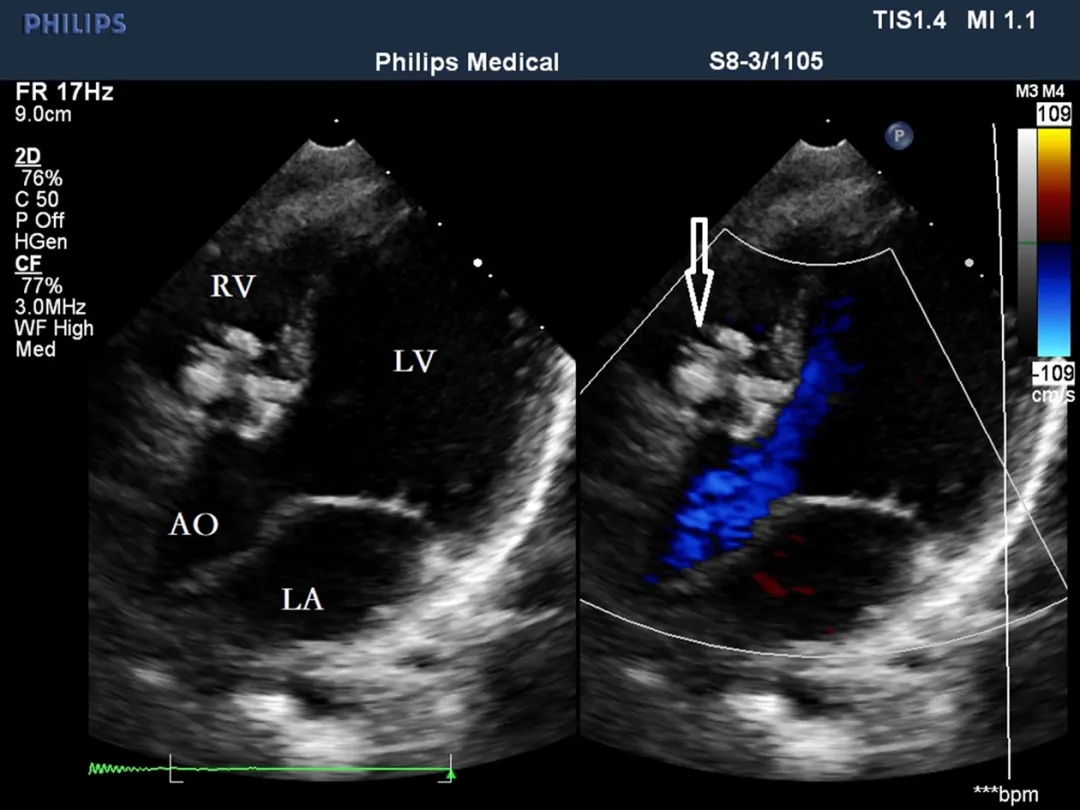
图9. 胸骨旁四腔心切面显示VSD的位置及伴膜部流入道(空心箭头)。VSD,室间隔缺损;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
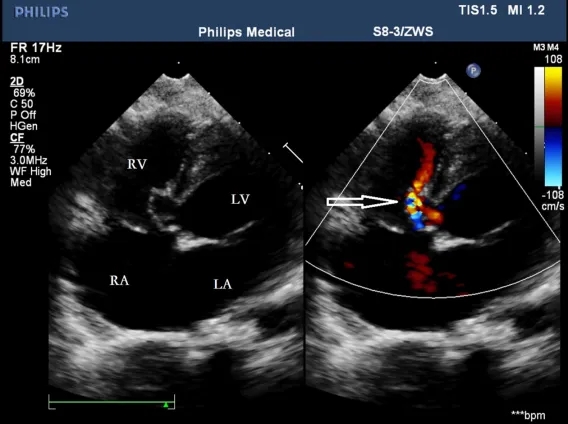
图10. 显示伴有膜部瘤形成的VSD(空心箭头)。VSD,室间隔缺损;RA,右心房;LA,左心房;LV,左心室;RV,右心室。
术中TEE检查,封堵器大小选择,即刻封堵效果评估
术中TEE测量结果显示,VSD的有效分流大小范围为2.8–4.9 mm,平均为3.31±0.45 mm。与术前TTE测量结果相比,差异无统计学意义(P>0.05)。缺损距主动脉瓣的距离为2–6 mm。所使用的封堵器直径在6–8 mm之间,平均为6.54±0.66 mm。17例患者选择了高度为2.8 mm的封堵器,7例患者选择了高度为5 mm的封堵器。对于简单的膜周部VSD,选择的封堵器型号(腰径)比实际测量的VSD直径大2–3 mm。对于合并膜部瘤VSD,选择的封堵器型号(腰径)比测量的VSD直径大2–4 mm。所有24例微创封堵术均取得成功。TEE检查显示,除了1例封堵器边缘存在轻微的左向右分流(分流束<1.5 mm)外,其余病例的封堵器均与VSD的边缘紧密贴合。封堵器未干扰主动脉瓣,且未引起二尖瓣和三尖瓣功能的恶化。没有发生封堵器移位、脱落或血栓形成的情况。
术后TTE随访结果
成功进行VSD封堵术的24名患儿均在住院期间(术后3天内)进行了随访,最长随访时间为18个月,最短为12个月,具体时长取决于手术顺序。术后12个月内随访率达到了100%(24/24)。表1列出了他们的基线情况。
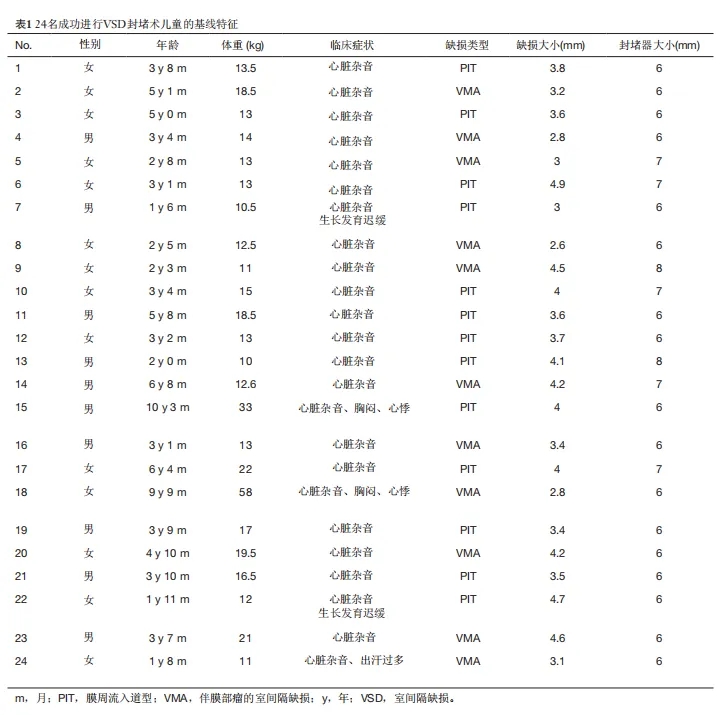
表1.24名成功进行VSD封堵术儿童的基线特征
在23例中,封堵器的位置正常,无分流或其他并发症(图11)。仅有1例存在1 mm的小残余分流(图12),被认为是轻微分流,在随访期间未出现任何并发症。通过心脏超声的多个切面(主动脉短轴切面、四腔心切面、五腔心切面)观察封堵器的位置和形态,精确测量了左右伞盘的尺寸以评估封堵器的降解情况。术后第1个月和第3个月,封堵器左右伞盘的尺寸与术后第3天相比无显著差异(P>0.05)(图13)。术后第6个月和第12个月(图14),封堵器左右伞盘的尺寸明显小于术后第3天,差异具有统计学意义(P<0.05)(表2)。
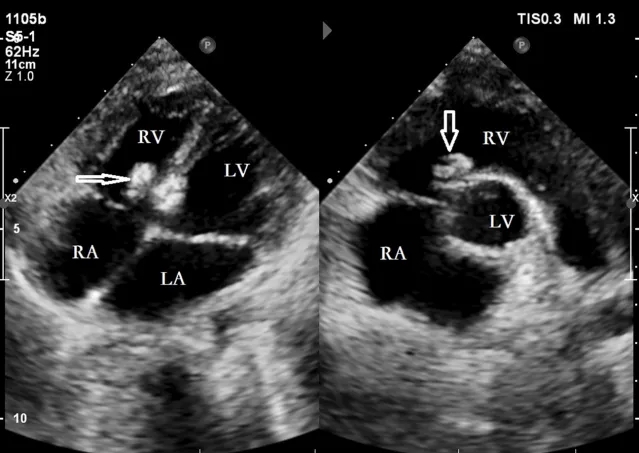
图11.手术后三天,封堵器的位置(空心箭头)正常,无分流。RA:右心房;LA:左心房;LV:左心室;RV:右心室。
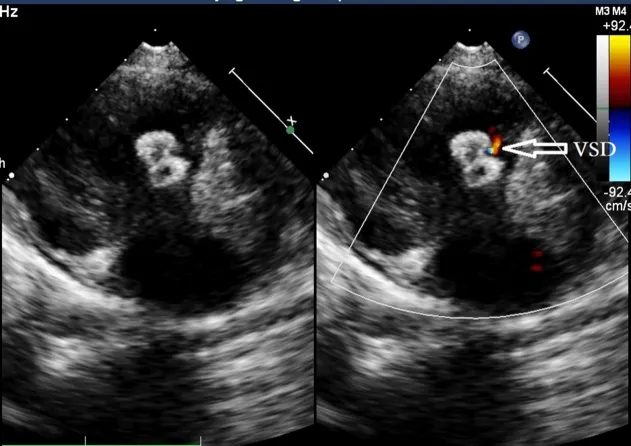
图12. 仍然存在1 mm的残余分流(空心箭头)。
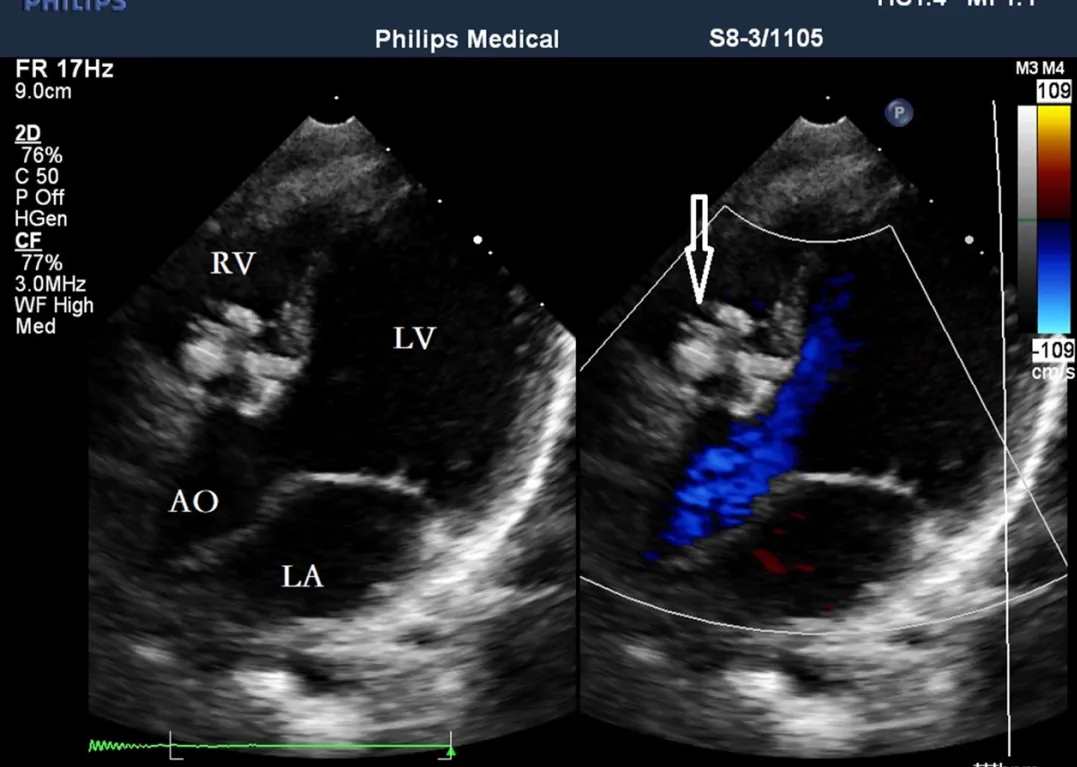
图13. 封堵器左、右两侧盘面的大小在术后三个月与术后三天相比无差异(空心箭头)。RA:右心房;LA:左心房;LV:左心室;RV:右心室。
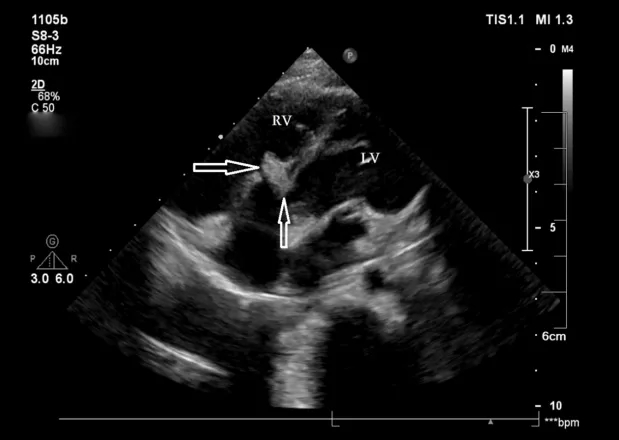
图14. 封堵器左、右两侧盘面的形状(空心箭头)在术后6个月时发生了变化,明显小于术后第3天的大小。LV:左心室;RV:右心室。
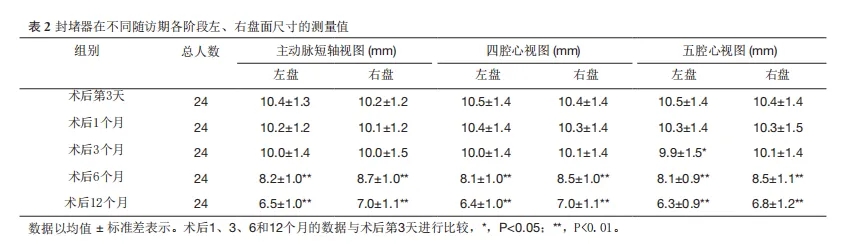
表2.封堵器在不同随访期各阶段左、右盘面尺寸的测量值
我们进行了对照研究,对30例使用传统镍钛合金封堵器进行心血管介入手术的病例进行了比较分析。通过超声心动图对封堵器的面积数据进行了分析。在对照组中,术后1至12个月内封堵器面积无显著变化(P=0.14)。而在实验组中,术后1至3个月封堵器面积无显著差异(P=0.30)(图15)。然而,术后3至6个月封堵器面积明显减小(P=0.003),且术后6至12个月封堵器面积进一步显著减少(P=0.02)(图15)。
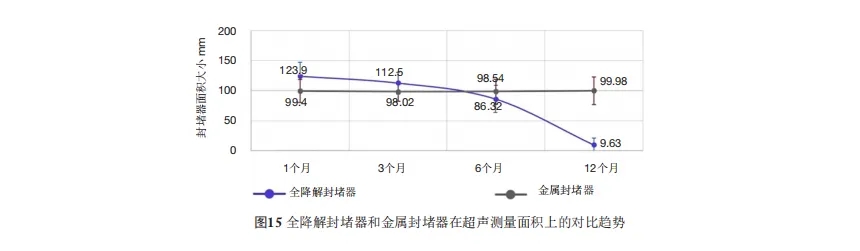
图15.全降解封堵器和金属封堵器在超声测量面积上的对比趋势
术前,所有患儿的左心房、左心室及肺动脉通道均比同龄一般人群大。术后测量的通道较术前略小(P>0.05)。在术后3个月、6个月和12个月时,这些通道显著缩小,与术前相比差异具有统计学意义,并恢复到正常水平(表3)。
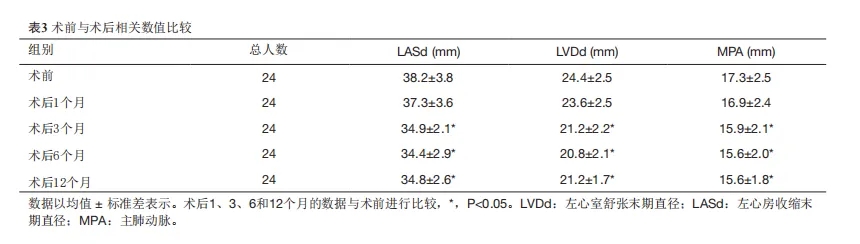
表3.术前与术后相关数值比较
讨论
本研究中使用的全降解VSD封堵器由上海形状记忆合金材料有限公司生产,是首个经相关部门批准并由南京医科大学附属儿童医院用于人体临床试验的全降解VSD封堵器。由于全降解VSD封堵器无法在数字减影血管造影(DSA)下显影,本组所有病例均在TEE引导和监测下完成微创经胸封堵。因此,TEE在术前VSD大小的测量、了解VSD部位及其与周围解剖结构的关系、术中穿刺点的定位、封堵器类型的选择、封堵器释放的引导以及术后即时疗效的评估中发挥着关键作用,这些因素都直接关系到手术的成败。
术前TEE检查
在手术开始前,需通过多个角度进一步筛查儿童,尤其是经食管中段0°的四腔心脏切面和五腔心脏切面、30°–60°的主动脉短轴切面以及110°–135°的左心室长轴切面。先前的研究表明,TEE在指导儿童VSD手术中安全有效(23,24),但在微创经胸VSD封堵术中,TEE是否优于TTE尚不明确。在本研究中,24例儿童的TEE和TTE测量结果在缺损类型和大小方面相似。然而,在观察缺损与周围结构的关系,尤其是在测量缺损与主动脉瓣之间的距离时,TEE显著优于TTE。在本组病例中,TTE测量的一例VSD与主动脉瓣的距离为2.2 mm,但术中TEE测量该距离仅为1 mm。我们因此不得不改为体外循环下的外科修补术。在手术探查中,发现缺损与右侧主动脉瓣的距离<1 mm。此外,术前TEE对于准确确定VSD的大小和选择合适的封堵器及输送鞘极为重要。尽管本病例系列使用了可降解封堵器,超大尺寸的封堵器仍有可能导致房室传导阻滞。因此,建议选择腰径比测量的VSD直径大2–3 mm的封堵器型号。TEE引导下的经胸微创封堵技术易于重复操作,如果存在残余分流,每次仅需将直径增加1 mm,直到分流消失,这可以减少使用较大封堵器的可能性。
术中TEE应用
在选择VSD病例的穿刺点时,尤其是伴有膜部瘤的病例,准确定位至关重要,应使用四腔心切面和食管中段短轴切面,以找到最小的角度和与VSD的最短距离。在我们的研究中,有两例由于初次定位不准,需重新定位后才能使导丝成功进入左心室。导丝进入后,需确保导丝指向左心室腔,避免导丝进入升主动脉,以防对瓣膜或主动脉造成潜在损伤。在释放可降解封堵器的左侧盘面时,准确定位至关重要,以避免对瓣膜结构造成损害,并在释放后仔细监测瓣膜功能。如果封堵器的形态异常或未充分展开,需要进行回收并重新释放。在一例远处有多个分流的病例中,残余的小分流被认为在血流动力学上无关紧要,因此最终释放了封堵器。在该组中,一例合并膜部瘤的VSD病例,缺损中存在多个分流,这些分流彼此距离较远。在连续更换了两个型号的封堵器后,仍然存在一个1.2 mm的小分流,但分流的流速小于3 m/s。考虑到不会有显著的血流动力学影响,封堵器得以释放。在确认室水平无分流、各瓣膜完好、封堵器充分展开后,操作人员被提示撤出鞘管,剪段成型线,并轻轻沿一端将其撤出。释放后需继续监测15分钟以上,以防止封堵器移位及其他并发症的发生。
作为首次在人类中使用可降解VSD封堵器的临床研究,尽管样本量较小是本研究的局限性,术中TEE在儿童VSD病例中的应用仍需进一步积累经验和进行更多研究。据我们所知,目前没有超声设备制造商生产专门用于儿童的TEE探头,导致无法获得来自多个平面的更丰富的空间信息,并增加了术中定位的复杂性。此外,全降解VSD封堵器是对称的,这对患者的入组标准提出了严格的要求。并且,我们组中的大多数患者随访约1年。虽然短期内降解效果显著,但这种治疗的长期疗效仍需要更多的大规模临床研究和更长时间的随访与观察。
结论
总之,应用TEE引导完全降解封堵器进行的膜周部VSD微创封堵治疗是一种值得进一步临床研究的治疗方法。
参考文献 上下滑动查看
1. Bendriss L, Sedrati M, Haddour L, et al. Ventricular septal defects: anatomic, clinical, therapeutic and prognostic aspects. 44 cases. Presse Med 2006;35:593-7.
2. Minette MS, Sahn DJ. Ventricular septal defects. Circulation 2006;114:2190-7.
3. Aluri M, Alfares F, Sandhu SK. The role of transesophageal echocardiography in device closure of perimembranous ventricular septal defects with the hybrid approach. J Card Surg 2022;37:1180-1.
4. Bai W, An Q, Tang H. Application of transesophageal echocardiography in minimally invasive surgical closure of ventricular septal defects. Tex Heart Inst J 2012;39:211-4.
5. Chen TY, Ju YT, Wei YJ, et al. Clinical Experience of Transcatheter Closure for Ventricular Septal Defects in Children Weighing under 15 kg. Acta Cardiol Sin 2021;37:618-24.
6. Jiang-Shan H, Kai-Peng S, Ning X, et al. Transthoracic closure of ventricular septal defects guided by transesophageal echocardiography. Turk Gogus Kalp Damar Cerrahisi Derg 2020;28:250-6.
7. Zhang GC, Chen Q, Chen LW, et al. Transthoracic echocardiographic guidance of minimally invasive perventricular device closure of perimembranous ventricular septal defect without cardiopulmonary bypass: initial experience. Eur Heart J Cardiovasc Imaging 2012;13:739-44.
8. Yılmazer MM, Meşe T, Güven B, et al. Recent experience with transcatheter closure of perimembranous ventricular septal defects using duct occluders. Cardiol Young 2016;26:1452-3.
9. Bu H, Yang Y, Hu S, et al. A novel biodegradable occluder for the closure of ventricular septal defects: immediate and medium-term results in a canine model. Interact Cardiovasc Thorac Surg 2019;29:783-92.
10. Marinakis A, Vydt T, Dens J, et al. Percutaneous transcatheter ventricular septal defect closure in adults with Amplatzer septal occluders. Acta Cardiol 2007;62:391-5.
11. Carminati M, Butera G, Chessa M, et al. Transcatheter closure of congenital ventricular septal defect with Amplatzer septal occluders. Am J Cardiol 2005;96:52L-8L.
12. Butera G, Carminati M, Chessa M, et al. Transcatheter closure of perimembranous ventricular septal defects: early and long-term results. J Am Coll Cardiol 2007;50:1189-95.
13. Ghaderian M, Merajie M, Mortezaeian H, et al. Midterm Follow-up of the Transcatheter Closure of Perimembranous Ventricular Septal Defects in Children Using the Amplatzer. J Tehran Heart Cent 2015;10:182-7.
14. Mandal KD, Su D, Pang Y. Long-Term Outcome of Transcatheter Device Closure of Perimembranous Ventricular Septal Defects. Front Pediatr 2018;6:128.
15. Chessa M, Butera G, Negura D, et al. Transcatheter closure of congenital ventricular septal defects in adult: mid-term results and complications. Int J Cardiol 2009;133:70-3.
16. Zhou T, Shen XQ, Zhou SH, et al. Atrioventricular block: a serious complication in and after transcatheter closure of perimembranous ventricular septal defects. Clin Cardiol 2008;31:368-71.
17. Xie L, Zhang H, Zhang R, et al. Management of LateOnset Complete Atrioventricular Block Post Transcatheter Closure of Perimembranous Ventricular Septal Defects. Front Pediatr 2020;7:545.
18. Zhu YF, Huang XM, Cao J, et al. Animal experimental study of the fully biodegradable atrial septal defect (ASD) occluder. J Biomed Biotechnol 2012;2012:735989.
19. Huang XM, Zhu YF, Cao J, et al. Development and preclinical evaluation of a biodegradable ventricular septal defect occluder. Catheter Cardiovasc Interv 2013;81:324-30.
20. Wu W, Yip J, Tang YD, et al. A novel biodegradable septal defect occluder: the “Chinese Lantern” design, proof of concept. Innovations (Phila) 2011;6:221-30.
21. Duong-Hong D, Tang YD, Wu W, et al. Fully biodegradable septal defect occluder-a double umbrella design. Catheter Cardiovasc Interv 2010;76:711-8.
22. Jux C, Bertram H, Wohlsein P, et al. Interventional atrial septal defect closure using a totally bioresorbable occluder matrix: development and preclinical evaluation of the BioSTAR device. J Am Coll Cardiol 2006;48:161-9.
23. Ye JJ, Jiang GP, Zhang ZW, et al. Transesophageal echocardiography-guided hybrid therapy for ventricular septal defects in children. Zhejiang Da Xue Xue Bao Yi Xue Ban 2009;38:311-4.
24. Bu H, Yang Y, Wu Q, et al. Results of two different echocardiography-guided approaches to closure of perimembranous ventricular septal defects. Eur J Cardiothorac Surg 2021;59:1304-11.
原文链接:https://cdt.amegroups.org/article/view/128004/html

扫描二维码下载原文

点击观看可降解学苑精彩内容
关注我们
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。

发表留言
暂无留言
输入您的留言参与专家互动