徐东杰教授:法布雷病临床病例分享
法布雷病(Fabry 病)又称“Anderson-Fabry 病”,由英国Anderson和德国Fabry分别于1898年首次报道,因此得名,我国已于2018年将法布雷病列入首批罕见病目录。它是一种X连锁遗传溶酶体贮积症,主要致病机制是基因突变导致α-半乳糖苷酶A(α-Gal A)缺乏或者活性减低,使其代谢底物三己糖酰基鞘脂醇(GL-3)及其衍生物脱乙酰基GL-3(Lyso-GL-3)在全身异常蓄积,从而导致心脏、肾脏等全身多组织器官损害。其中心脏是法布雷病最常受累的器官,常表现为心肌肥厚、瓣膜病变、心律失常及冠脉缺血等,由于其表现缺乏特异性,常易被误诊,经历较长时间才被确诊。在第二十六届全国介入心脏病学论坛中,南京医科大学第一附属医院徐东杰教授做了关于法布雷病的病例分享,该病例通过详尽的临床检查及基因检测被确诊,并成功完成了酶替代药物治疗。

01病例简介
患者:顾某某,女,53岁
主 诉:间断胸闷9年余
现病史:
9年前(2013年)因活动中胸闷胸痛于院外就诊后考虑肥厚型心肌病,服倍他乐克缓释片23.75mg Qd。
2019年11月至我院门诊就诊:
超声心动图提示左房增大42mm,心室大小正常范围,室间隔20mm,左室后壁19mm,EF 64%,左室壁除下壁基底段、侧壁基底段及心尖顶端心肌厚度正常外(约11mm),余室壁均增厚,最厚处约23mm,室壁搏动尚可,静息状态左室流出道压差约8mmHg。轻度二、三尖瓣关闭不全,左室舒张功能减退。
动态心电图提示窦性心动过缓;偶发室早(二源);房早伴非特续性房速;持续性ST压低伴T 波倒置;异常Q波(CM5);PR间期短;左室及室间隔肥厚。

2021年12月无明显诱因再次出现心前区搏动性疼痛,反复发作1周,症状逐渐加重,可持续3小时余,无胸闷,无恶心呕吐,无大汗,无畏寒发热,无咳嗽咳痰。至我院急诊就诊,查高敏肌钙蛋白T33.16ng/L,肌酸激酶同工酶10.87ng/mL,D二聚体、血常规未见明显异常。急诊予丹参多酚静脉滴注,患者症状有所缓解,复查高敏肌钙蛋白T 30.70ng/L,肌酸激酶同工酶11.52ng/mL。进一步至门诊查冠状动脉CTA提示:LAD中段心肌桥(浅表型)。左室心肌明显增厚。超声心动图提示较2019年11月大致相仿。门诊予倍他乐克缓释片23.75mg Qd口服。
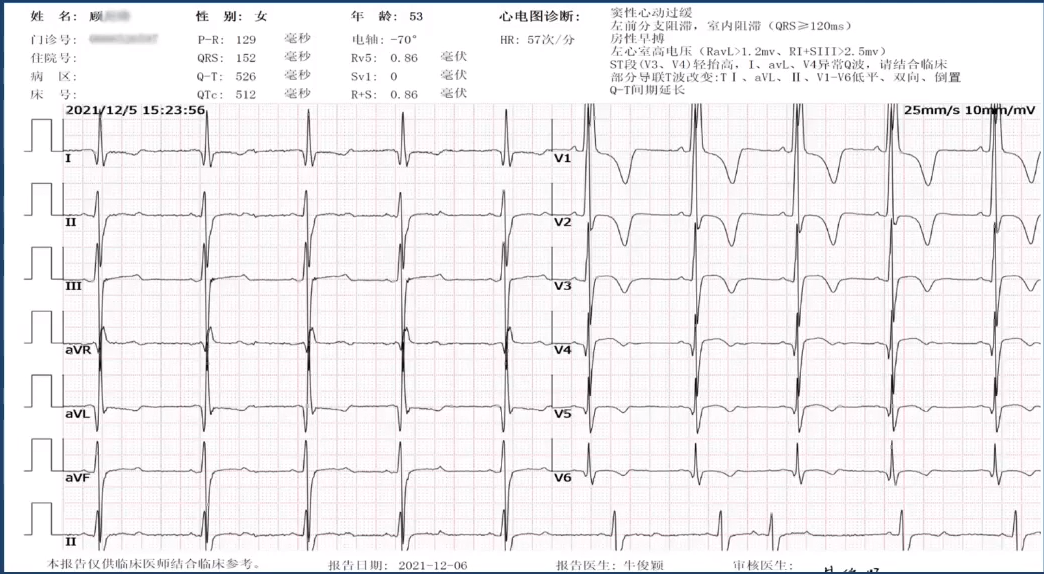
心电图提示:窦性心动过缓;左前分支阻滞,室内阻滞(QRS≥120ms);房性早搏;左心室高电压(RavL>1.2mv、RI+SIII>2.5mv);ST段(V3、V4)轻抬高,Ⅰ、avL、V4异常Q波;部分导联T波改变:TI、aVL、Ⅱ、V1-V6低平、双向、倒置;Q-T间期延长;
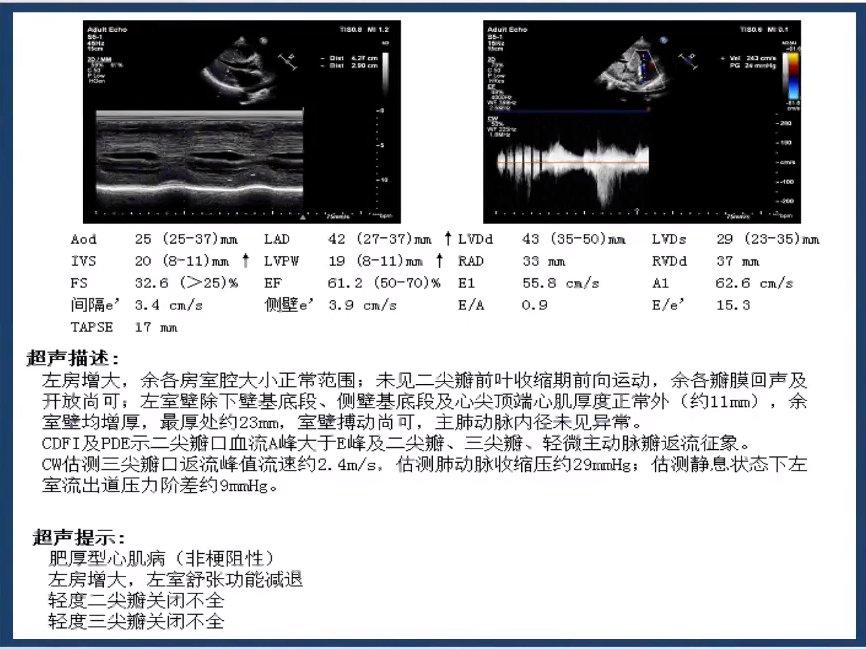
超声心动图:
提示肥厚型心肌病(非梗阻性)、左房增大,左室舒张功能减退、轻度二尖瓣关闭不全、轻度三尖瓣关闭不全。
2022年再次至我院复诊,对其既往病史进行追问。
既往史:10余岁时手指、脚疼痛,发热时异常疼痛,就医未查明原因,之前少汗怕热,近几年自我感觉症状好转,2021年查出白内障。2000年住院手术治疗预激综合征,2009年开始走路气喘后定期复诊,09年市一医院体检提示心肌肥厚,12年开始省人民医院陆续就诊,一直以心肌肥厚治疗。16年因心肌肥厚市一住院治疗。
家族史:否认家族史。
02入院后实验室检查
cTnT:33.57ug/L、

-
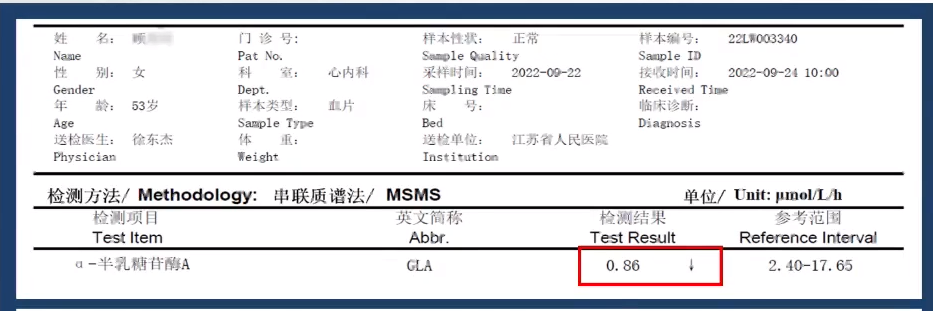
α-Gal A活性检测
α-半乳糖苷酶A活性0.86↓μmol/L/h(正常范围2.40-17.65)。
-
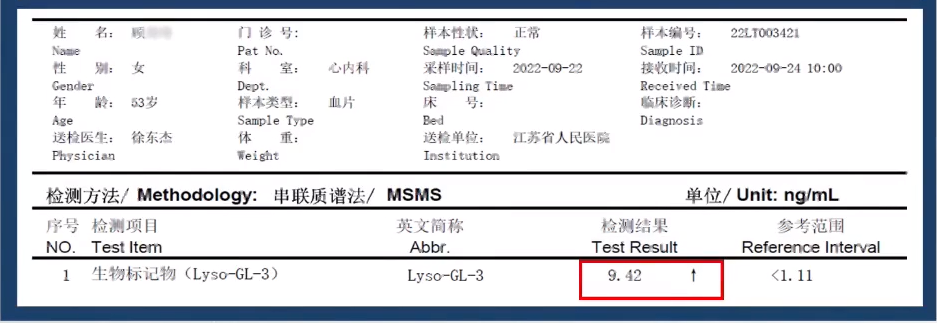
生物标志物检测
血浆脱乙酰基GL3(Lyso-GL3)9.42↑ng/ml(正常值<1.11);
-
基因检测
GLA基因提示chrX:100653826位点c.748C>A p.GIn250Lys错义突变。
结合临床病史,考虑患者诊断为Fabry病心肌病。

根据加拿大指南推荐的法布雷病诊断标准,经诊断评分为≥3分的患者诊断为法布雷病。患者肾功能正常,未见蛋白尿,肌电图检查轻度异常,经眼底检查提示:角膜涡状浑浊,累计评分大于3分,符合法布雷病诊断。

03家族基因检测
根据ACMG遗传变异分类标准与指南,致病性证据强推荐的有:患者的新发变异,且无家族史(经双亲验证)。根据患者的GLA基因检测报告,患者的变异来源属新发。对其双亲及女儿进行了基因检测。
-
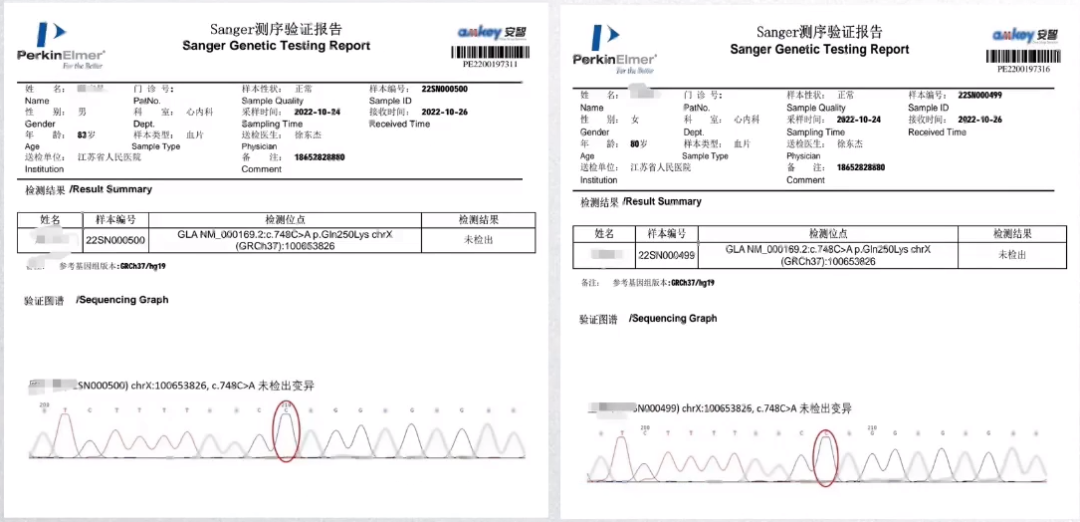
患者父母Fabry基因检测
对患者父母进行基因检测,均未发现Fabry基因突变。
-
患者女儿Fabry基因检测
基因检测结果提示GLA基因改变,GLA水平降低,Lyso-GL3水平升高。患者女儿要求药物治疗,但由于25岁,目前未婚,考虑到药物治疗对其生育的影响未知,暂未对其进行药物干预,以随访为主。

-
患者家系图
该疾病为X染色体显性遗传疾病,该患者父母Fabry基因检测阴性,患者(女性)及其女儿检测到GLA基因突变,对其进行了酶替代治疗,对其女儿进行随访。

04 法布雷病诊疗
MDT模式下的ERT起始治疗指征判断—成人患者

法布雷病多学科联合全程管理路径图

法布雷病多学科联合全程管理路径包括治疗前对病史、家族史、体格检查、生命体征、SF-36、MSSI等的评估;ERT治疗;对受累脏器包括周围神经、肾脏、心脏、中枢神经、胃肠道、呼吸系统、精神心理的对症治疗;临床监测包括对临床症状、病史、体检,包括家族史,生活质量评估及胃肠道症状;治疗方案调整。法布雷病治疗前评估即常规评估包括病史、家族史、体格检查、生命体征。根据持续临床监测,调整法布雷患者治疗方案以达到个体化治疗。
国内外法布雷病指南/共识都强调ERT是法布雷病治疗的基石。2021中国法布雷病诊疗专家共识指出:法布雷病的治疗目标为延缓疾病进展,改善生活质量,降低相关并发症的发病率,延长患者生存期。ERT通过外源性补充的基因重组α-Gal A,替代患者体内缺失的α-Gal A,减少GL-3和Lyso-GL-3在器官组织的贮积,以改善患者症状,延缓器官受损。阿加糖酶α是通过基因激活技术在连续培养的人细胞系中生产的α-Gal A,用于确诊为法布雷病(α-半乳糖苷酶A缺乏症)患者的长期酶替代治疗,适用于成人、儿童和青少年(尚未确定在0-6岁儿童中的安全性和有效性)。
该病人2022年11月启动酶替代治疗,患者体重50公斤,阿加糖酶α注射用浓溶液3支/次,每两周一次。因疫情,有几次中途未到医院就诊。经治疗预后较好。
05讨论
法布雷病是一种X染色体显性遗传的罕见病,发病机制是因位于Xq22.1的GLA基因突变,导致其编码的α半乳糖苷酶A(α-Gal A)活性降低或完全缺乏,造成代谢底物三己糖酰基鞘脂醇(GL-3)及其衍生物脱乙酰基GL-3(Lyso-GL-3)在肾脏、心脏等多组织器官中大量贮积,引起相应的病变。
法布雷病临床表现多样,常为神经、肾脏、心脏、皮肤、胃肠道、眼等多脏器受累,以GL-3和Lyso-GL-3为主的代谢产物最早在胚胎早期贮积于组织器官。患者多在青少年时期出现症状,并随病程进展而逐渐加重。其中,肾脏、心脏、脑是后期主要受累脏器。
回顾患者的既往史,10余岁时手指、脚疼痛,发热时异常疼痛,就医未查明原因,之前少汗怕热,肌电图检查轻度异常,为法布雷病周围神经病变表现。
法布雷病眼部症状包括:角膜涡状浑浊、结膜/视网膜血管迂曲、晶状体后囊浑浊、白内障等,严重者可导致视力下降甚至丧失。结合患者病史,2021年查出白内障。本次入院眼底检查提示:角膜涡状浑浊。符合法布雷病眼部病变。
心脏是法布雷病常见的受累器官,可表现为心肌肥厚、瓣膜病变、心律失常、冠脉缺血等,其中最典型的表现为心肌肥厚。患者既往出现走路气喘、活动中胸闷胸痛,心电图、超声心动图结果提示心肌肥厚,冠状动脉CTA提示:LAD中段心肌桥(浅表型)。2000年曾住院手术治疗预激综合征。符合法布雷病心脏受累主要表现。
法布雷病的诊断检测方法包括α-Gal A活性检测、基因检测、生物标志物检测、组织病理学活检。α-Gal A活性检测具有一定局限性。女性患者受X染色体随机失活的影响,α-Gal A活性水平不一,60%以上的女性患者α-Gal A活性在参考值范围内。因此,女性患者需结合基因检测、底物及衍生物水平来明确诊断。
基因检测是诊断的重要检测手段,除明确诊断外,基因检测还能确定基因突变类型协助判断临床表型,指导家系筛查。生物标志物检测包括血浆GL-3水平检测和血浆Lyso-GL-3水平检测。血浆GL-3水平是诊断法布雷病常用的生化指标,男性患者血浆GL-3水平明显高于健康人群,而女性患者普遍较低,且多处于参考值范围,因此,对女性诊断的意义有限;血浆Lyso-GL-3水平敏感度比GL-3更高,且与临床表型有良好的相关性,显著升高有助于区分经典型和迟发型。组织病理学活检具有辅助诊断意义,可检测肾脏、心脏、皮肤或神经组织。
患者血浆脱乙酰基GL3(Lyso-GL3)9.42明显升高,正常值<1.11;α-半乳糖苷酶A活性0.86(正常范围2.40-17.65);GLA基因提示chrX:100653826位点c.748C>A p.GIn250Lyn错义突变。家系图中,其父母基因检测阴性,女儿阳性,符合X染色体显性遗传特征。
根据临床表现的严重程度差异,患者确诊后在开始治疗前需对疾病严重度进行全面、准确的基线评估,为确定治疗方案提供依据。治疗方法主要分为ERT、对症治疗、分子伴侣治疗等。ERT通过外源性补充基因重组的α-Gal A,减少GL-3和Lyso-GL-3在器官组织的贮积,减轻患者疼痛程度,减少蛋白尿,并改善其他相应症状,阻止或延缓多系统病变发生。目前,ERT药物包括阿加糖酶β(推荐治疗剂量1.0 mg/kg体重,每2周静脉输注1次)和阿加糖酶α(推荐治疗剂量0.2 mg/kg体重,每2周静脉输注1次),这两种药物的基因来源相同,结构和功能相似,具有与天然人类α-Gal A相同的氨基酸序列。自2001年应用于临床后实践证明对法布雷病患者治疗效果显著,及早启动治疗患者获益更大。法布雷病累及多个组织器官,对症治疗主要是针对各脏器受累情况。需注意的是,仅通过对症治疗来管理法布雷病并不合适,对症治疗并未针对潜在的法布雷病发病机制。分子伴侣疗法是一种口服小分子药物,可选择性地、可逆性地与结构、功能有缺陷的α-Gal A结合,稳定蛋白构象,帮助蛋白正确折叠以发挥正常功能,增加或恢复α-Gal A活性,促进其运输至溶酶体,以清除贮积的底物,因此又称为酶增强治疗。目前临床使用较多的是米加司他(migalastat,已在加拿大、欧洲等国家上市,暂未在我国上市),需注意的是,米加司他仅适用于部分错义突变的法布雷病患者。此外,底物减少治疗、基因治疗及基于mRNA治疗等一些新的药物或治疗策略正在临床试验或研发中,有望为法布雷病的治疗提供新的方向。
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动