张瑞岩教授:重度钙化病变TAVR技术挑战与处理策略

对于重度主动脉瓣狭窄(AS)患者,经导管主动脉瓣置换术(TAVR)是一种有效的治疗手段。但是,对于重度钙化病变,TAVR技术却存在一些挑战。例如,重度钙化病变可能导致瓣膜位置过高、移位等情况,进而引发难以纠正的中-大量瓣周反流,从而影响患者的血流动力学稳定。近期,在CHINA VALVE HANGZHOU 2024会议中,上海交通大学医学院附属瑞金医院张瑞岩教授面对这些挑战强调道,我们可以通过合理的手术策略、术后的并发症防治以及采用新型瓣膜等手段,完全克服这些挑战。此外,还可以通过多科室的团结协作,事先制定周密的诊治计划,以确保手术的成功和患者的长期预后。

张瑞岩教授授课
背景——钙化积分与AS
首先,我们要探讨钙化与AS之间究竟有怎样的关系?从临床实践中不难发现,很多退行性变患者都伴有钙化,并且随着不同的钙化程度,治疗结果也不相同。在一些国外研究中,我们也发现主动脉瓣钙化影响AS患者生存率,而且主动脉瓣钙化积分与狭窄程度密切相关。
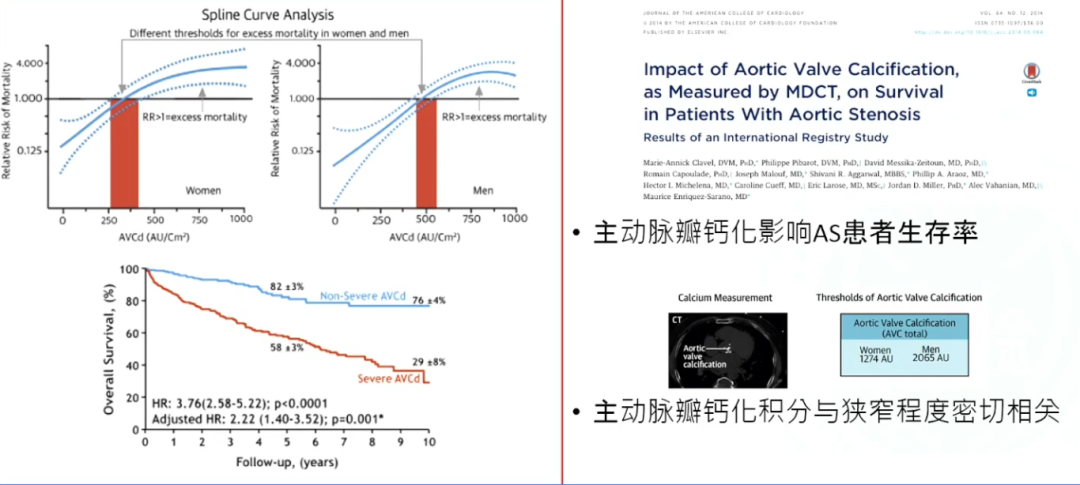
AS患者的生存率受多种因素影响,其中主动脉瓣的钙化程度是一个重要因素。主动脉瓣钙化是一种退行性改变,可能会影响患者的生存率,但具体影响程度取决于钙化的严重程度以及是否伴随其他基础疾病。
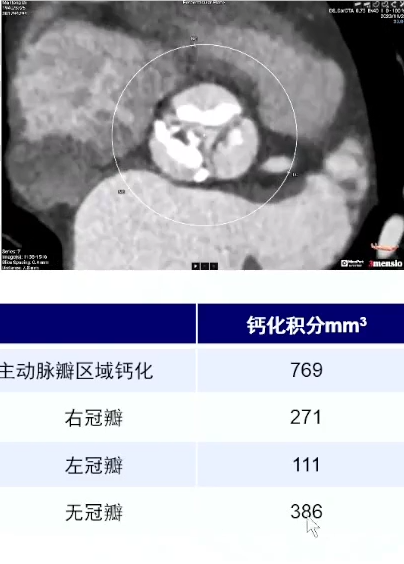
主动脉瓣钙化积分与狭窄程度之间的关系是医学研究中关注的重点。主动脉瓣钙化积分是通过特定的医学检查方法,如计算机断层扫描血管造影(CTA)等,对主动脉瓣钙化程度进行量化评估的一种指标。而AS程度则是指主动脉瓣口狭窄的严重程度,一般可以根据瓣口面积大小或心室和主动脉间的跨瓣压差来进行分级。
多项研究表明,主动脉瓣钙化积分与AS程度之间存在正相关。也就是说,主动脉瓣钙化积分越高,AS程度往往也越严重。这可能是因为钙化过程会导致主动脉瓣逐渐变硬、增厚,从而影响瓣膜的开放和关闭功能,最终导致狭窄。
风险一:瓣周漏风险
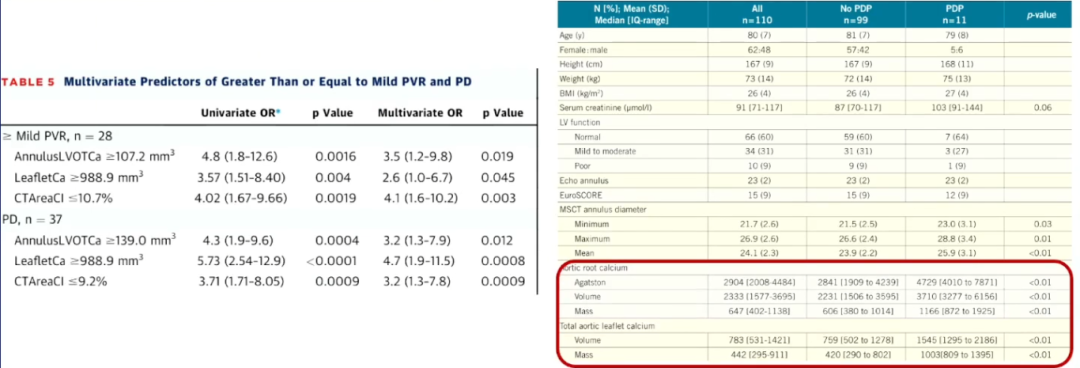
钙化患者在TAVR术后有瓣周漏(PVL)的风险。有研究表明,无论THV(经导管心脏瓣膜)压缩比,LVOT(左心室流出道)钙化及瓣叶钙化(钙化体积≥235mm3)都是PVL的预测因子。

因此,存在钙化的情况下,进行相关的手术或治疗时需要特别小心,以避免对瓣环组织造成损伤,从而减少PVL的风险。同时,对于已经发生PVL的患者,需要根据具体情况采取相应的治疗措施,以尽可能减轻症状、控制病情发展。
早期研究——后扩张比例升高
在发生PVL后,就需要进行后扩张,但后扩张也是有限度的。研究表明,瓣叶、瓣环、LVOT钙化是球囊后扩张的预测因素,而且球囊后扩张的患者主动脉根部钙化体积明显升高。
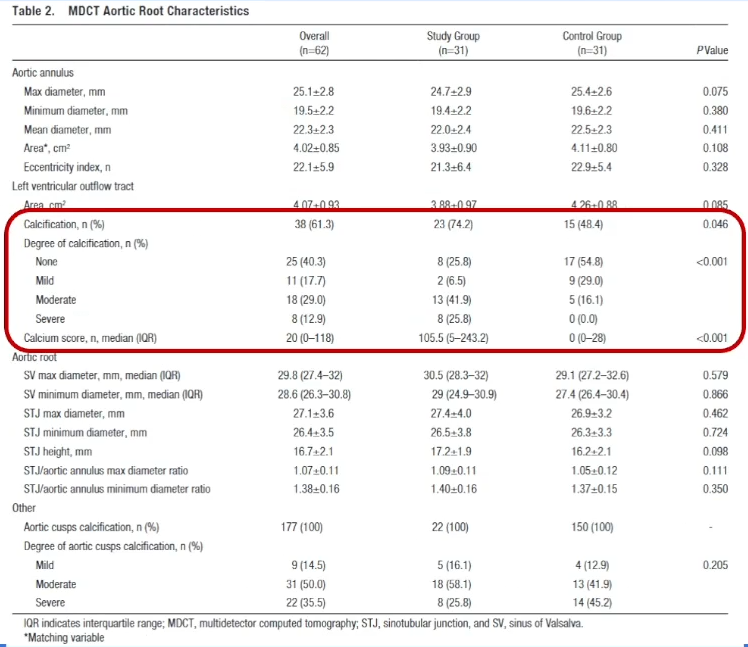
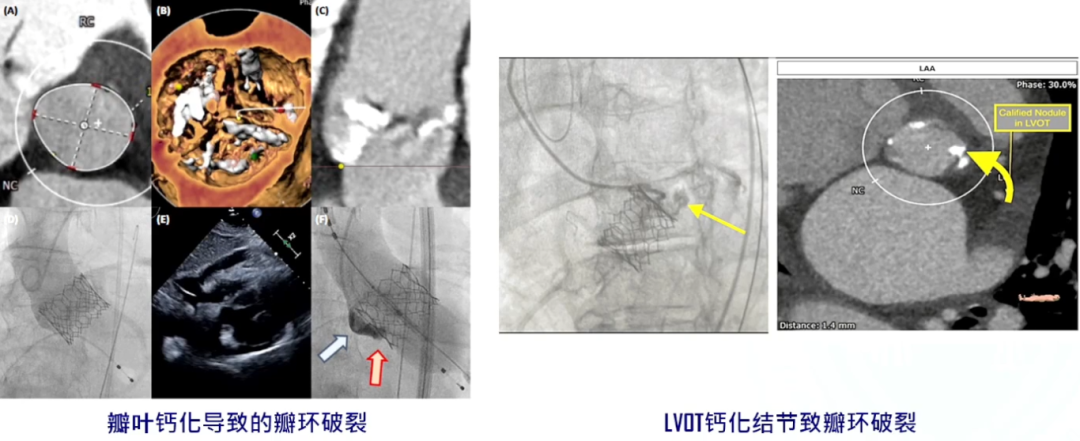
风险二:瓣环破裂风险
对于进行TAVR手术的钙化病变患者有发生瓣环破裂的风险,若钙化仅局限于瓣叶上则风险不大;但若是从流出道,到瓣环,再到瓣上的连续性钙化,除了会引发PVL外,还需要进行后扩张,这种情况下发生瓣环破裂的风险就会明显增加。从下面研究中可以看到,在31例瓣环破裂患者与31例对照组患者中,瓣环破裂组中瓣下/LVOT钙化显著高于对照组。
早期研究——钙化与预后
对于接受TAVR的患者,现在比较关注长期预后的问题。近年来,随着器械的改进(发明了可回收瓣等)、操作技术的提高以及术者经验的丰富,术中操作成功率明显增加,但从术后长远来看,关于置换瓣膜可用多长时间,也就是瓣膜退变问题成为我们不容忽视的问题。我们发现残余压差是一个不良因素,残余压差增大会导致瓣膜退化。在比较外科瓣与自膨瓣后,可以发现自膨瓣优于外科瓣,这是因为外科瓣是原位植入瓣膜,瓣环面积较小;而自膨瓣是环上瓣,瓣环面积较大,这就导致压差不同,进而影响了患者预后。
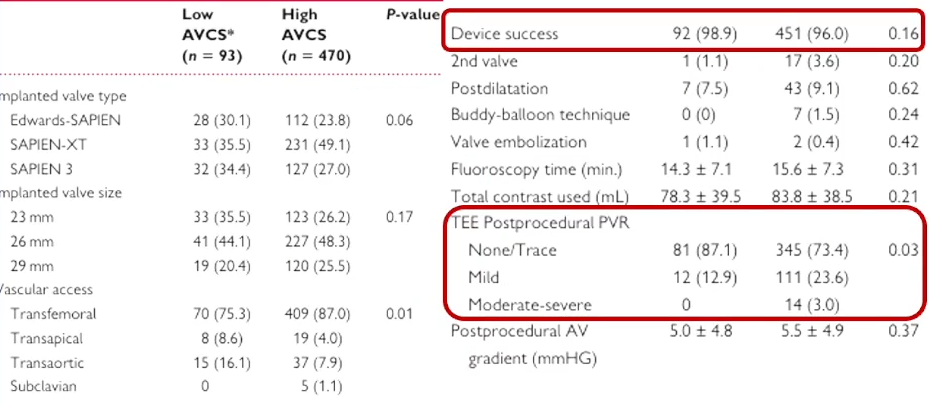
一项研究纳入93例低主动脉瓣钙化积分(AVCS)及470例高AVCS的重度AS患者,所有患者均接受球扩瓣治疗,比较两组预后;高AVCS定义为男性≥2065AU,女性≥1274AU。研究发现重度钙化AS患者中高压差患者更多见(86% vs.53.8%,P<0.001)。

18个月随访期两组间生存率无差异,30天临床结局无明显差异。
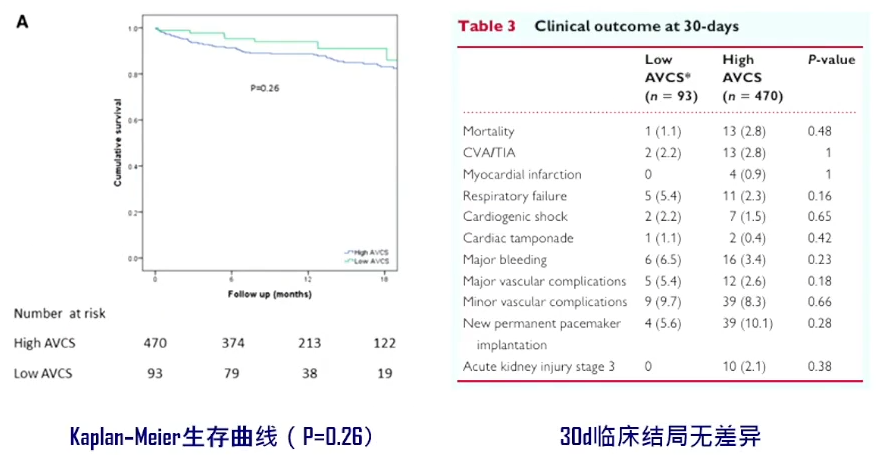
该研究还发现,两组间即刻的器械植入成功率无差异,高AVCS组中度以上PVL发生率更高(12.9% vs.26.6%,P=0.03)。
重度钙化TAVR确实面临诸多技术挑战,例如器械通过困难、球囊及瓣膜尺寸选择、PVL的处理、冠脉风险、瓣架形态与远期管理等,这主要源于钙化病变的复杂性,如钙化范围广泛、程度严重,以及可能伴随的其他心脏结构异常。
随着新一代器械以及术者学习曲线的优化,钙化积分不影响患者终点。相信,随着技术的不断进步和经验的积累,未来会有更多的患者从中受益。
Snare辅助器械通过
重度钙化病变合并大角度时,可Snare辅助器械通过。临床上主动脉角度过大/横位心合并重度钙化时,进行TAVR手术的风险和难度较高,随着术者操作技术和医疗器械的改进,借助Snare抓捕器辅助,可以顺利完成输送系统过弓、跨瓣等步骤。
瓣环破裂风险
钙化的体积和分布在预测TAVR术中瓣环破裂的风险中起着重要的作用,如左心室流出道连着瓣环的钙化,会造成瓣环破裂的风险。主动脉瓣的钙化量与瓣环破裂并不是独立相关的,需要仔细评估以下解剖特征,包括较小的瓣环尺寸(<20mm)、LVOT和瓦式窦(Valsalva窦)的直径。此外,Oversizing>20%和反复扩张是主动脉根部损伤的独立预测因素。
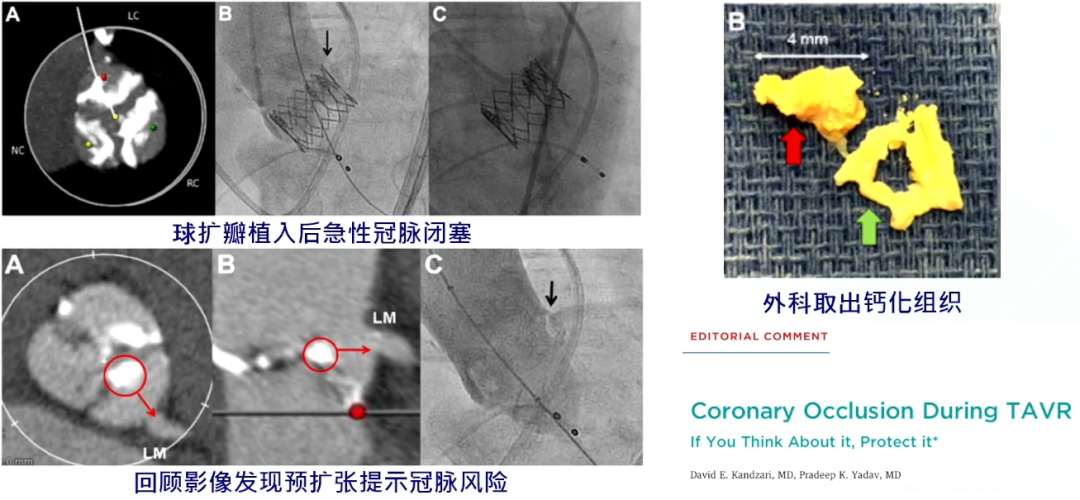
冠脉闭塞风险
冠脉闭塞与钙化虽然没有直接的关系,但也是一个值得考虑的因素。若有患者瓣叶钙化较大为团块状时,在释放瓣膜后,向外挤压的过程中会覆盖冠脉从而造成冠脉闭塞。当然,冠脉闭塞还应评估冠脉开口的高度、Valsalva窦的大小、瓣叶长度等重要参数。
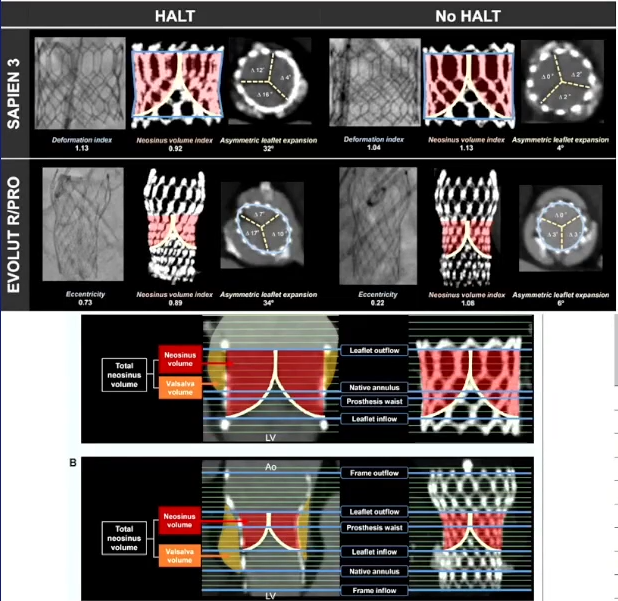
重度钙化TAVR的长期管理
目前即刻手术成功不再是我们关注的重点,而支架退变和衰败成为最令临床医生担忧的问题。HALT(低衰减瓣叶增厚)的发生与瓣架变形、瓣叶不对称性更差和TAVR新窦体积更小直接相关。严重钙化的TAVR也有更大的可能面临这些问题:钙化导致瓣架变形、瓣叶展开不对称,以及Downsize导致的新窦体积小。
Case1:器械通过、冠脉风险、PVL处理
83岁女性患者,因“胸闷4天、晕厥1次”入院。实验室检查BNP 17000pg/mL。UCG提示峰值流速6.0m/s,PGmax 146mmHg,PGmean 90mmHg。

针对该病例的“器械通过、冠脉风险和PVL处理”几项挑战,分别实施相对应的策略,如18mm球囊预扩,备外周球囊;冠脉保护;以及根据瓣架形态后扩张。

手术步骤:预扩张球囊通过困难,MUSTANG 10×60mm外周球囊预扩张一次;切线位评估,Telescope+4.0预埋支架,120bpm起搏释放瓣膜;再次评估冠脉,术后PVL评估出现异常;JL GC再次到位,导丝+延长导管保护,22×40mm后扩张;最终冠脉无影响,轻微-轻度PVL。
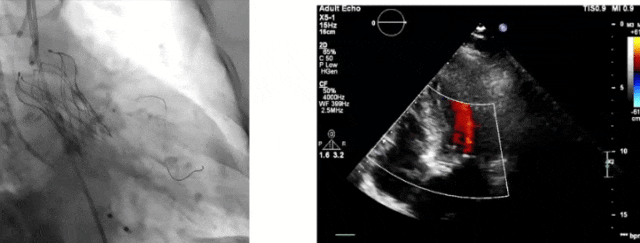
术后微量PVL
术后思考:
1.器械通过困难的处理——外周球囊扩张;或是更换相对软的导丝以及Snare辅助;
2.冠脉风险的评估——综合窦的大小及钙化分布,关注非对称钙化;
3.PVL的处理——根据原因选择后扩张或PVL封堵。
Case2:Downsize策略、PVL封堵、瓣架形态导致的HALT
74岁男性患者,因“活动后胸闷、气促半年,加重10天”入院。NT-proBNP 3033.0pg/mL。UCG提示峰值流速4.5m/s,PGmax 79mmHg,PGmean53mmHg。
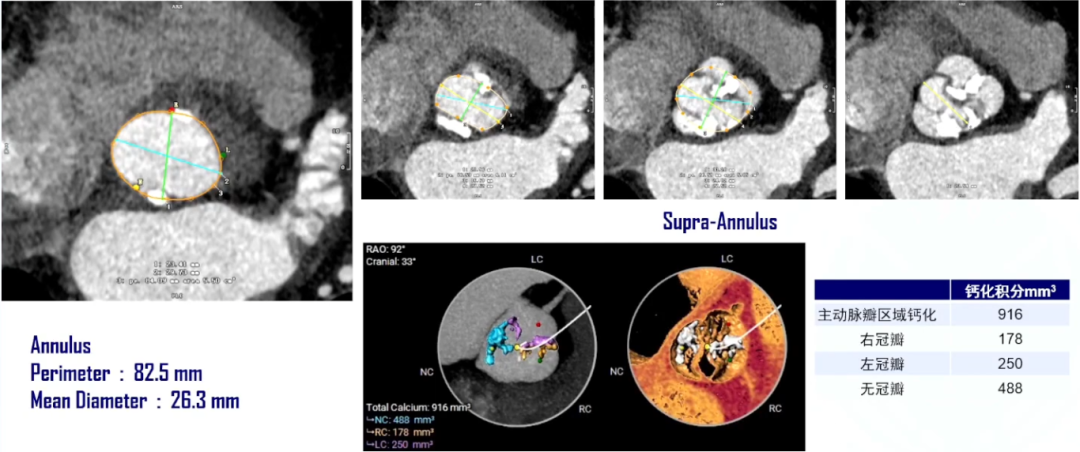
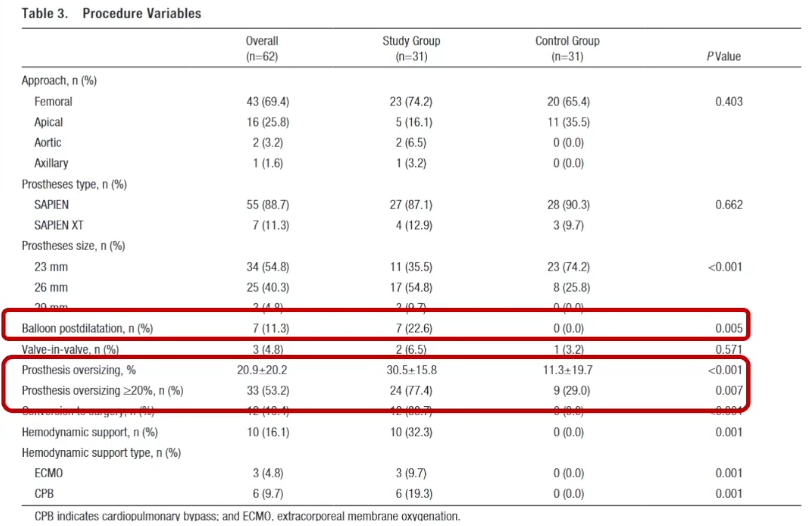
针对该病例的“Type 1型二叶瓣,瓣膜选择;钙化分布”可能导致PVL的挑战,我们采取了以下应对策略:瓣上5.6mm高度处IC 23 Downsize 27#瓣膜;18mm球囊预扩,备Amplatzer血管封堵器(AVP)。
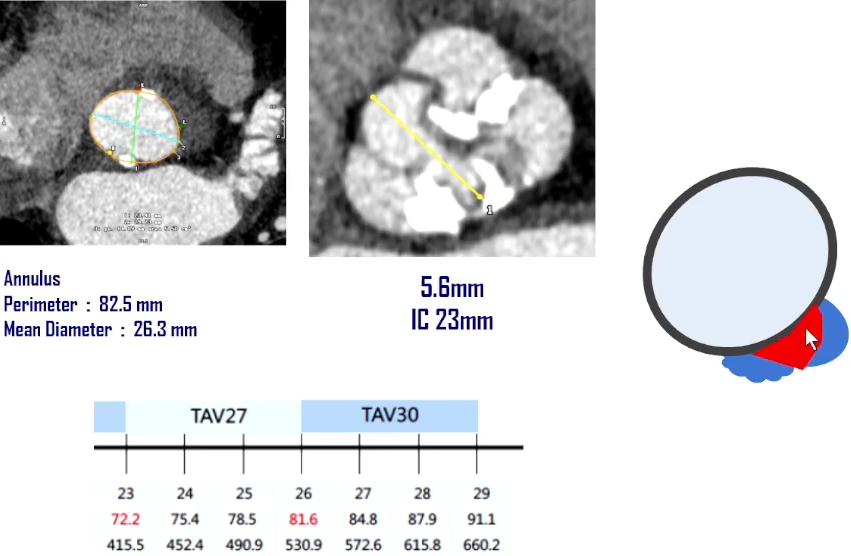
术后中量反流不能接受,对于下一步是考虑更大球囊后扩还是PVL封堵?就目前临床来看,PVL封堵还是经验丰富;AL1.75 0.035泥鳅导丝穿过PVL严重处;4.0×15mm 球囊6atm试封堵,CT评估是否对冠脉有影响;Guidezila支撑下MPA GC通过PVL释放AVP封堵器;最终术后效果良好。
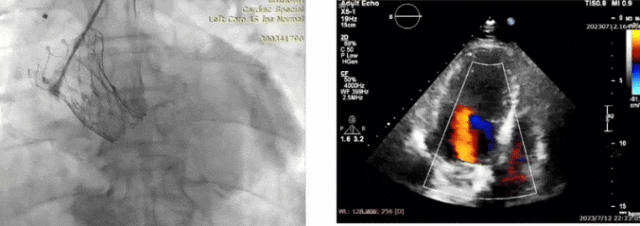
术后效果良好
术后思考:重度钙化TAVR的PVL处理
1.术前CT评估,根据瓣叶、钙化分布及时甄别PVL风险。
2.针对PVL原因决定应对策略:瓣中瓣——植入过深;后扩——改善瓣架形态,注意瓣环破裂风险;封堵——瓣架与钙化间的PVL。
该患者术后1w复查CT提示HALT,改抗凝治疗。
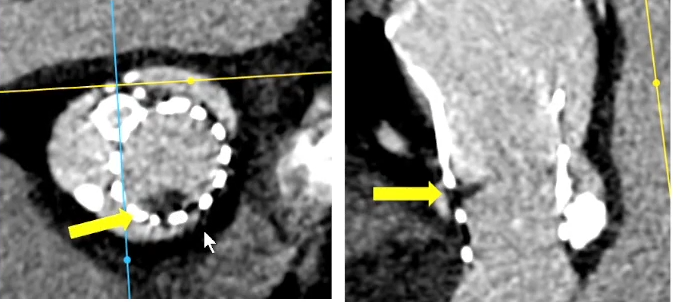
Case3:LVOT钙化导致的瓣环破裂风险、扩张球囊选择
评估患者瓣环上结构,发现钙化延伸至LVOT,该患者发生术后PVL的风险较高。

由此可见,钙化的严重程度不在于CT评估的钙化积分的高低,关键在于钙化的分布和形态。对于TAVR术者而言,术前进行详细周密的钙化分析就变得非常重要。
重度钙化病变TAVR技术确实面临着一系列的挑战,主要是由钙化病变的复杂性和患者特定的解剖结构来决定。对于器械通过困难,可以灵活运用Snare、导丝、外周球囊;对于严重钙化,尤其是二叶瓣,可以小球囊预扩张,必要时Downsize;对于PVL的处理,要分析原因,选择后扩、封堵;对于冠脉风险,要尽可能的保护;此外,在远期管理上,我们还要关注Downsize、瓣架展开不充分引起的人工瓣膜-患者不匹配、HALT等问题。
当然,处理这些挑战就需要我们通过制定严密的手术策略,精心的术前评估,术中策略和术后管理,才可以确保手术的成功率和患者的长期预后。例如,术前通过详细的影像学检查,评估患者的瓣膜和冠脉情况,为手术提供充分的信息;术中根据患者的具体情况,选择合适的瓣膜类型和尺寸,以及最优的释放技术,并密切关注冠脉血流情况,必要时采取相应措施;术后对于可能出现的并发症,如PVL、冠脉阻塞等,应提前制定好处理策略,对患者进行密切的监测和随访,确保手术效果。相信未来,随着技术的不断进步和经验的不断积累,更多患者将从中获益。
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。






发表留言
暂无留言
输入您的留言参与专家互动