JACC丨上海交通大学医学院附属苏州九龙医院心内科团队:阵发性房颤伴心外膜室性心动过速的零射线射频消融手术一例
病例信息
➤既往史
患者56岁男性,糖尿病病史4年,血糖控制良好,无高血压。因反复发作的胸闷、心悸及多次晕厥后,于2017年被诊断出肥厚型心肌病、VT和阵发性AF。在外院接受VT的射频消融手术后,放置了植入式心脏转复除颤器,并开始口服胺碘酮治疗,缓解心悸、胸闷症状。
2019年,患者出现间歇性心悸和胸闷发作,无晕厥。标准12导联心电图(ECG)显示 AF(图 1)。捕获心悸发作时心电图可见宽QRS波心动过速,确诊阵发性VT(图2)。植入式心脏转复除颤器记录了38次VT事件,触发了多次抗心动过速起搏和心脏电复律。由于病情相对稳定,患者未接受进一步RFA。
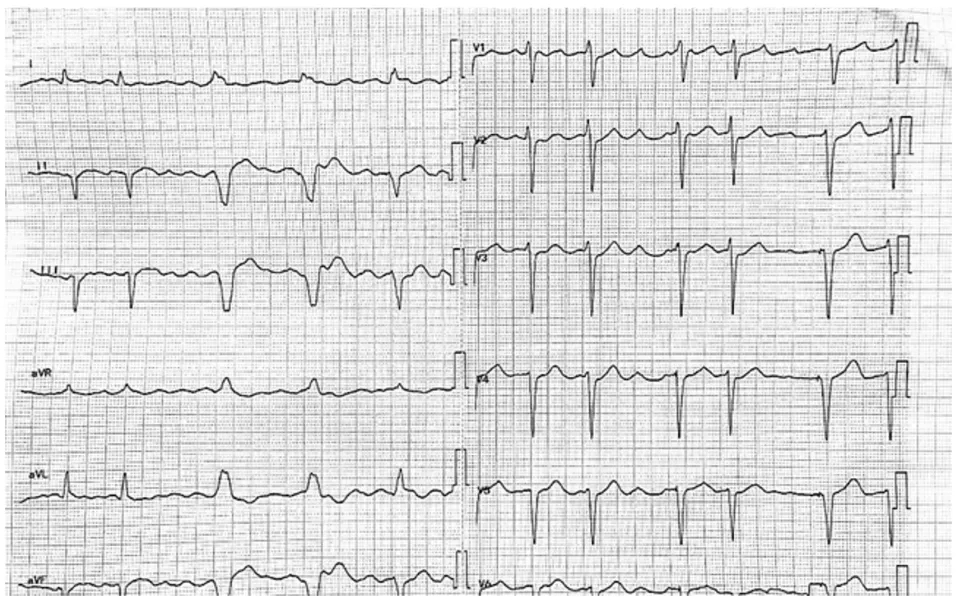
图1
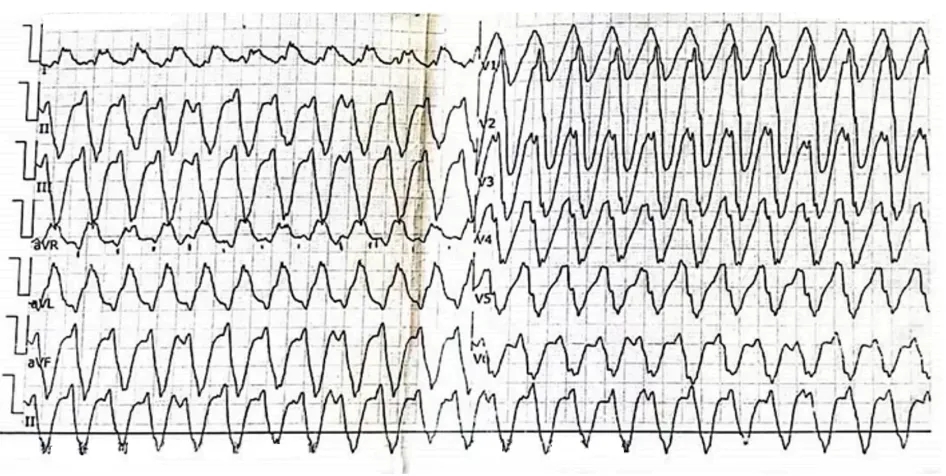
图2
➤现病史
患者因频繁出现心悸、胸闷等症状于2022年住院治疗。入院后实验室检查显示血电解质、肝肾功能、甲状腺功能均正常;超声心动图提示左心房前后径46 mm,左心室舒张末期内径56mm,左室射血分数为47%,室间隔和左室后壁厚度均为13mm。食管超声心动图检查证实左心耳内未见血栓。
手术过程
患者术前接受了至少1个月的口服抗凝药物治疗。术中给予患者100 U/kg普通肝素并全程监测激活凝血时间使其保持在250s-350s。患者在局麻下接受了经导管RFA治疗AF和VT,手术全程在T3D联合ICE引导下进行。
AF导管消融进行了40分钟,经过双侧肺静脉电隔离联合左心房顶部线消融治疗,成功恢复了窦性心律。其中环肺静脉隔离,并在其基础上辅以线性消融及复杂碎裂电位消融综合治疗以确保疗效(图3)。
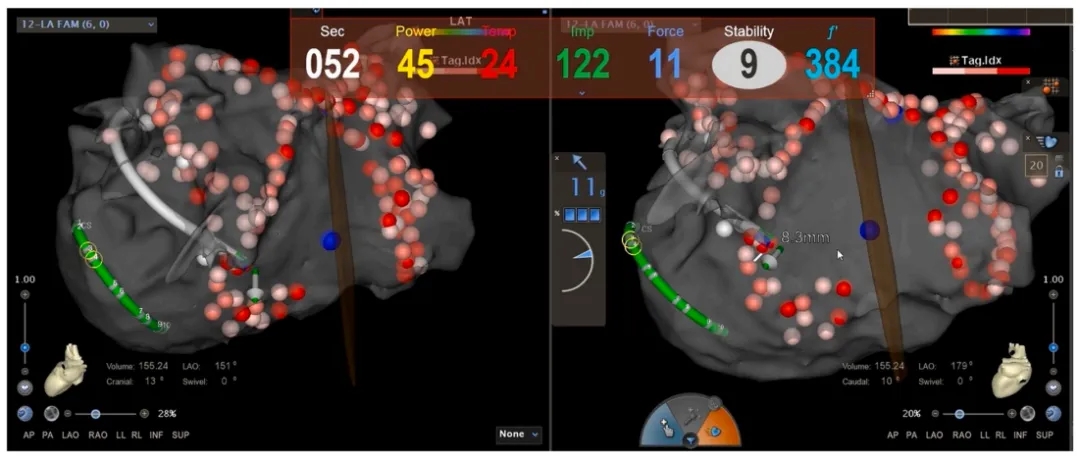
图3:左心房CARTO标测图中的消融部位
随后对VT进行了射频消融,包含30分钟的心内膜消融和40分钟的心外膜消融。患者术前存在反复且频繁的室性早搏,以及短暂的VT发作。VT发作期间的体表心电图提示心律失常起源于左心室顶部。在心内膜标测前进行了心外膜标测,使用CARTO在3D-EAM系统中构建三维解剖模型,并通过射频导管收集相关数据。整个手术消融过程中无并发症发生,随后行异丙肾上腺素负荷试验未诱发VT,证实了手术的成功(图 4)。
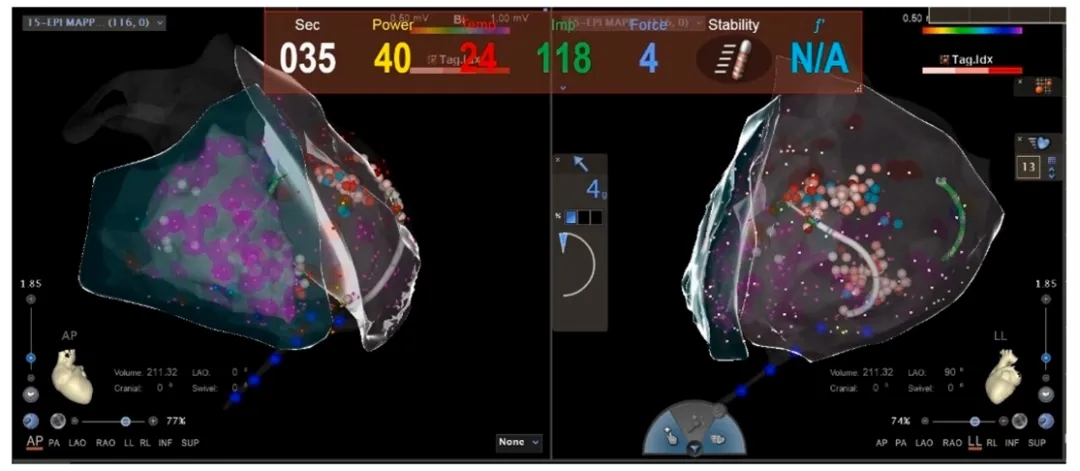
图4:经心包途径消融心外膜室速
具体操作步骤
➤ 通过CARTO三维标测系统将ICE与三维电解剖标测(EAM)系统相结合,零射线下成功进行心包穿刺术。
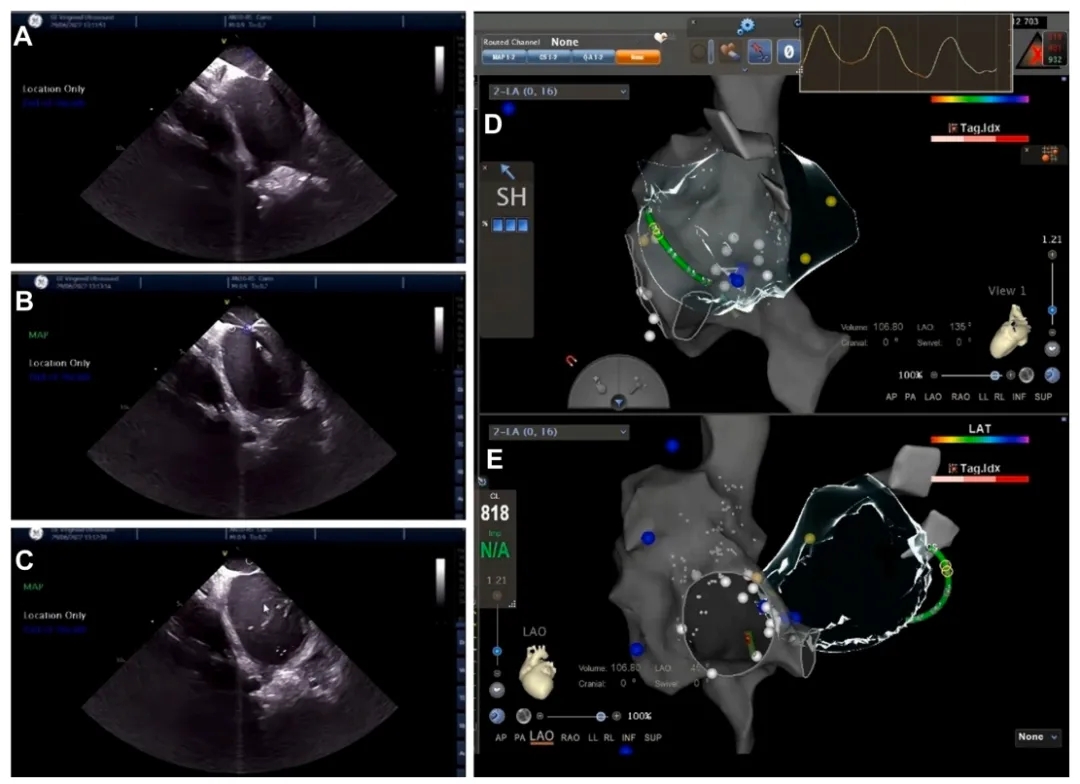
(A)ICE 提示穿刺针在房间隔顶出“帐篷征”;(B)房间隔穿刺在实时ICE引导下进行;(C)穿刺针成功进入左心房,注入盐水确认;(D 和 E)EAM对右心房、腔静脉和房间隔进行详细重建。
➤ ICE引导下划定心包边界。
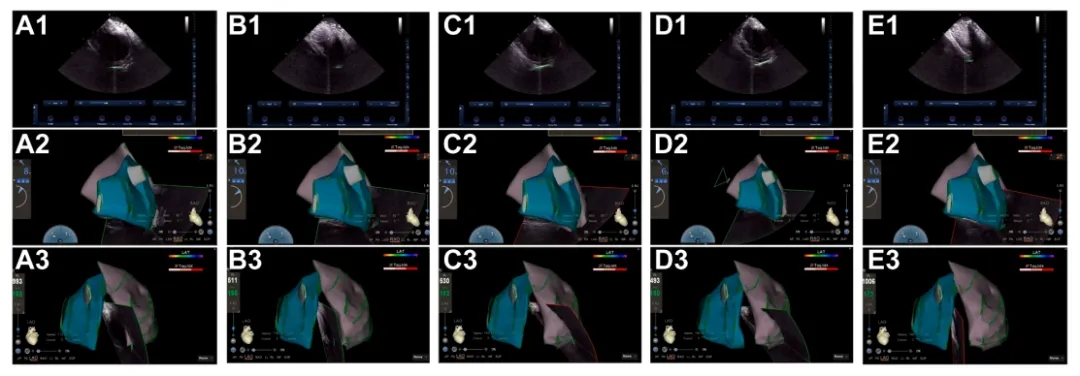
(A)左心室心尖近间隔侧;(B)左心室心尖;(C)左心室侧壁;(D)左心室游离壁;(E) 左心室心尖。
1)腔内超声平面;2)右前斜位;3)左前斜位。
➤单极导线连接到穿刺针的远端,通过与CARTO三维标测系统集成实现实时可视化。
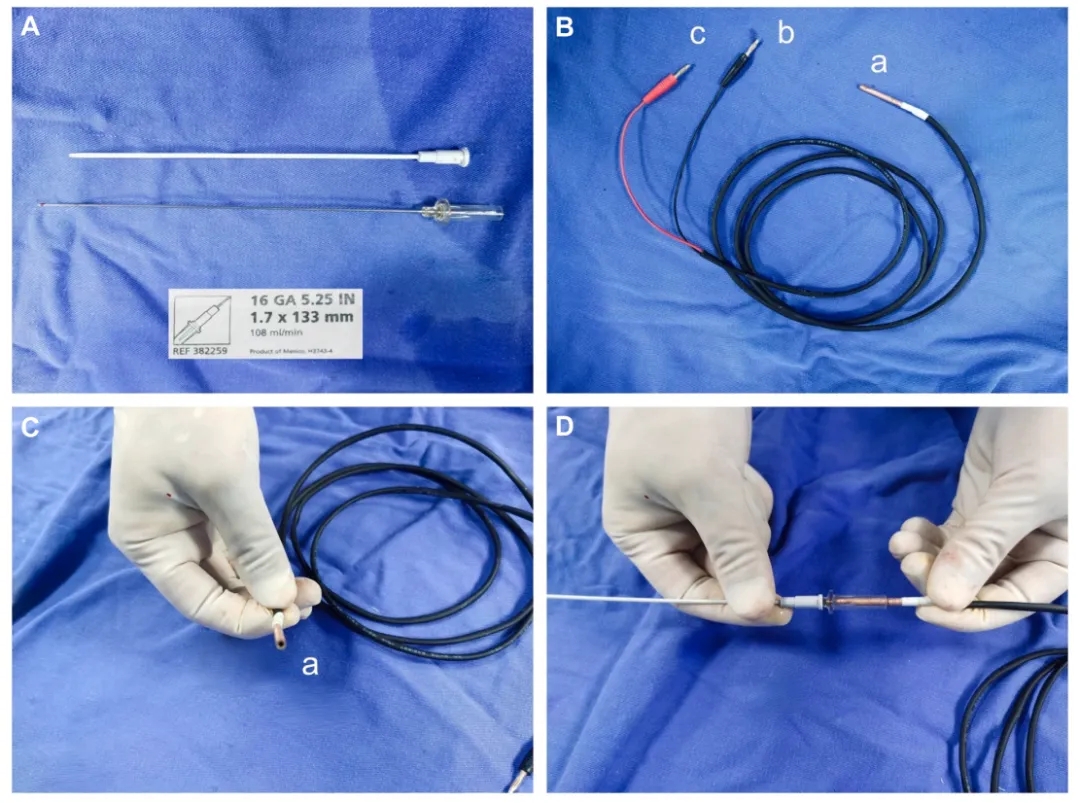
(A)血管专用穿刺针;(B 至 D)定制电缆的“a”端连接到针的尾端,而“b”和“c”端连接到CARTO系统的PINBOX。
➤ ICE/3D引导下心包穿刺术和经心包途径消融流程。
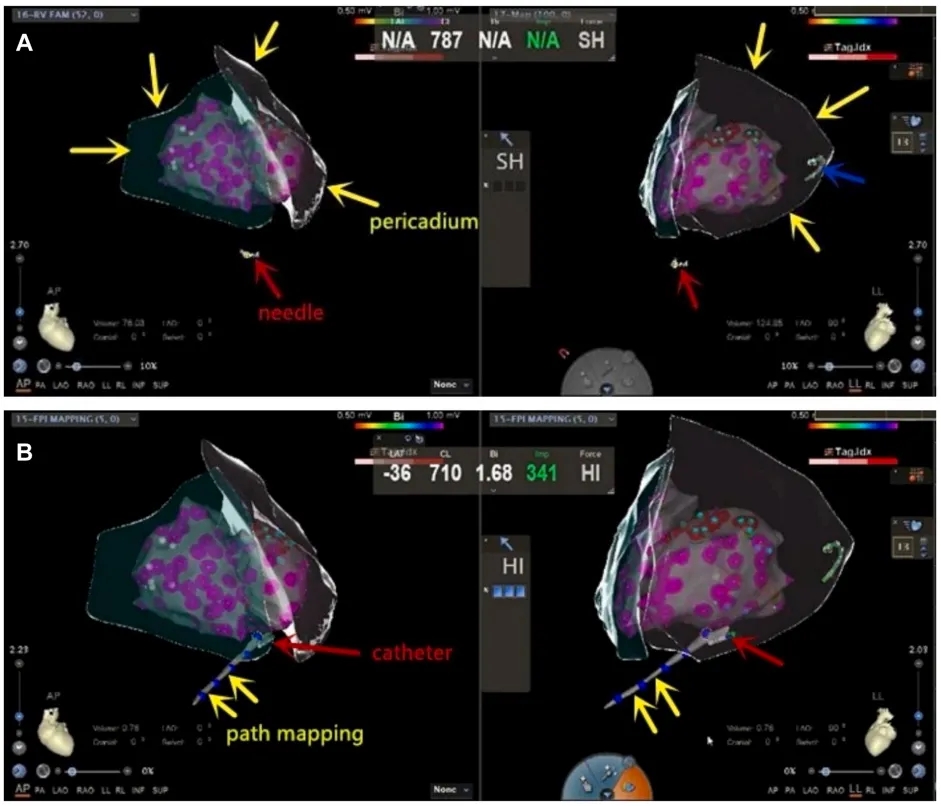
(A)在前后位和左侧位投影视图的动态监测下,针尖逐渐向心外膜推进,直至达到精确重叠,红色箭头表示CARTO系统定位的双极导管,代表穿刺针尖;黄色箭头表示通过CARTO系统使用ICE结合EAM构建的心外膜解剖模型;蓝色箭头表示位于冠状窦中的标测电极。(B)黄色箭头描绘了消融导管进入心包间隙时的轨迹,而红色箭头表示消融导管在该腔内的位置。
术后随访
患者术后未出现任何心悸或胸闷的复发。术后1年、2年定期随访未见AF/VT复发。
讨论
左心室心肌厚度通常超过10毫米,这对传统射频能量消融的有效穿透提出了重大挑战。值得注意的是,部分VT起源于心外膜,经心内膜导管消融难以取得满意结果,需要通过剑突下穿刺进行心外膜途径消融。经剑突下穿刺心外膜入路(EA)由Sosa等人于1996年首次提出,现已成为治疗复杂心外膜VT的常用方法。
心包穿刺术是心外膜消融术的基础和先决条件。传统的心包穿刺术在X线透视引导下进行,通过造影成像确认穿刺针进入心包间隙。然而,正常情况下心包腔内通常会含有少量浆液(约15mL-25mL),脏层和壁层紧密排列,使得仅在X线透视下精准定位心包腔位置极具挑战性。有研究报告表明,与心外膜穿刺、标测和消融手术相关并发症的发生率为5%-10%,严重时可能会危及生命,或者需要开胸手术。因此,改进技术,开发更精准的电生理相关心外膜干预技术至关重要。该研究展示了一种改进的心包穿刺术,可显著提高心外膜入路的安全性和精准性。
在本例病例中,ICE结合3D-EAM可以实时、高分辨率地可视化心脏和心包解剖结构。主要创新点包括左心室和右心室心外膜边界(包括侧壁、心尖和室间隔)的术前基于ICE的解剖模型,以及通过单极导线连接到穿刺针远端,使得针尖能够实现精准定位,在完全可视化的情况下完成心包穿刺。此外,在EAM系统中跟踪针尖轨迹使得整个手术过程更加安全。以上共同提高了心包穿刺术实际操作的安全性、可重复性,以及术者信心,尤其是在一些解剖学上具有挑战性或高风险的病例当中。
与传统X线透视引导下导管消融相比,联合使用ICE与 CARTO等3D-EAM系统的零射线射频消融存在显著优势。首先,整个手术过程均不需X线指引,显著减少了患者和医务人员的辐射暴露,大大降低了辐射对医护人员及年轻患者、孕妇等特殊患者健康的影响。在手术效果方面,ICE可以实时可视化心脏解剖结构和导管与组织接触情况,从而提高经房间隔穿刺术(TSP)和心外膜入路精度。在复杂心脏结构或需要心外膜消融情况下,ICE与三维电映射系统集成提供的解剖保真度有助于消除潜在的致心律失常基质。
在临床实践中,若彻底心内膜消融后,VT持续存在并怀疑心外膜起源,可以使用与本病例中描述相同的ICE联合T3D技术进行心外膜消融。
当然,零射线消融技术也存在一定局限性。该技术对操作要求较高,学习曲线长,ICE成本较高,难以在一些地区广泛普及应用。此外,在出现解剖变异或并发症(例如心包填塞)的情况下,无X线透视备份可能会给快速可视化与患者管理带来挑战。
内容来源:Liu GA,Shao B,Zhang R,You B,Liu F.JACC Case Rep.2025 Oct 8;30(31):105298.
本文为医谱学术原创,转载请标注来源。
-END-
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系


发表留言
暂无留言
输入您的留言参与专家互动