学术分享丨李菁晶教授:卒中后睡眠障碍
首都医科大学附属北京天坛医院李菁晶教授以“卒中后睡眠障碍”为题带来精彩学术授课,她从睡眠生理讲到失眠危害,还提到临床对于失眠的诊断的检查和诊断评估量表,并着重介绍了卒中后睡眠障碍的临床诊断分型及相应的治疗策略,授课内容精彩丰富,值得借鉴学习。
1.睡眠的作用
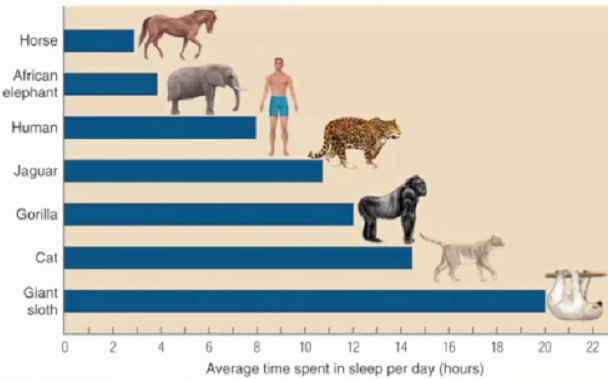
睡眠占人生的1/3,睡眠的重要作用是恢复精力和体力、促进生长发育、提高免疫力及增强记忆力等。
2.睡眠中NREM和REM交替循环出现
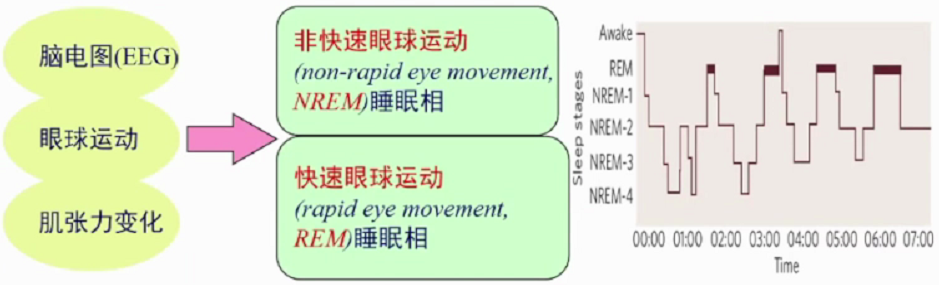
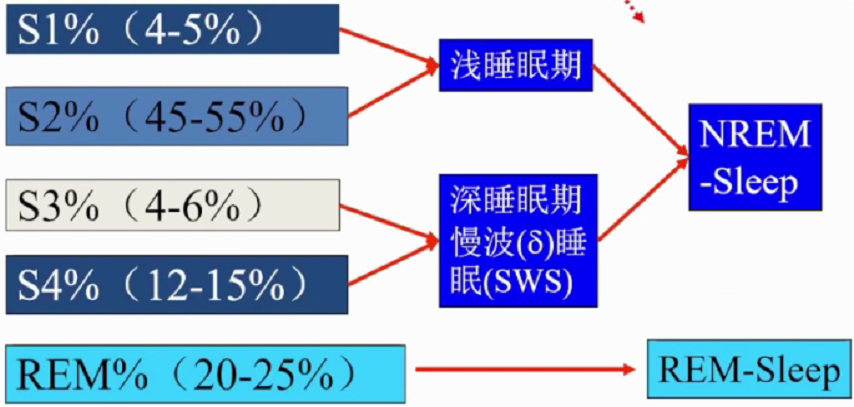
人类正常睡眠由非快动眼(NREM)睡眠和快动眼(REM)睡眠组成,二者交替循环出现于整个睡眠阶段。NREM睡眠中存在不断变化的同步皮质脑电波,同时伴随降低的肌张力及极低的心理活动。NREM可划分为1期(N1)、2期(N2)、3期和四期(N3)。 REM睡眠中脑电波去同步化,肌张力缺失,做梦为典型特征。
3.正常睡眠结构
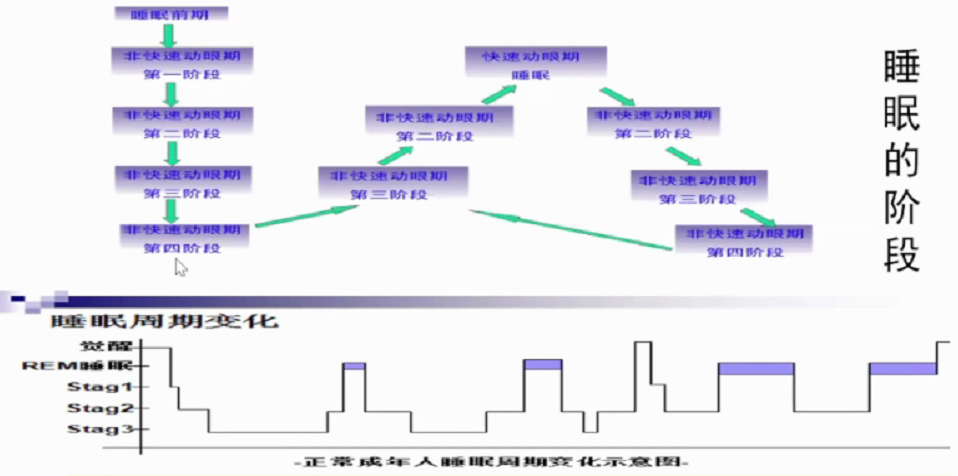
正常睡眠周期分5个阶段,1期(入睡期)、2期(浅睡期)、3期(中度睡眠期)、4期(深度睡眠期)的非快动眼睡眠时期和快动眼睡眠时期。睡眠结构顺序是浅睡眠-深睡眠-快眼动睡眠。每个睡眠周期90-110分钟。睡眠开始首先进入NREM,经过一段时间后进入REM,在整个睡眠周期中NREM和REM睡眠交替进行,一般每夜4-6个交替周期,其中NREM占75%-80%,REM睡眠占20-25%。
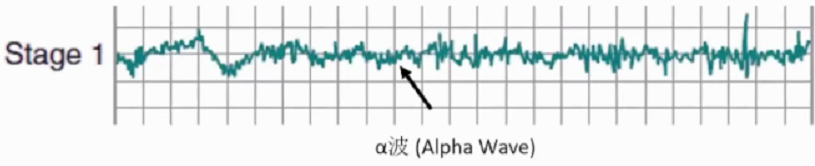
1期睡眠(Stage1)是睡眠分期循环的过渡阶段。除新生儿和发作性睡病等神经障碍外,NREM均从1期睡眠开始。第一循环中1期睡眠持续1-7分钟,占总睡眠的2-5%。这一时期易被惊醒。1期睡眠中脑电波从清醒状态(以清醒发送状态下的节律性的a波为标志)转化为低电压,混合频率的波。
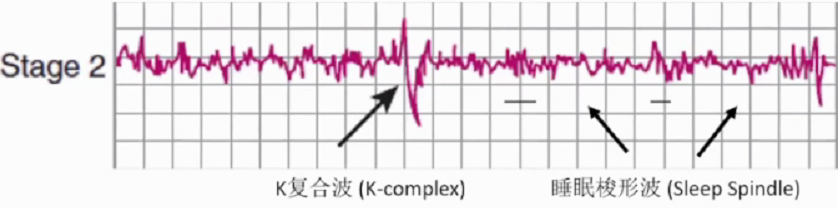
第一个循环中2期睡眠(Stage2)持续10-25分钟,每个循环逐渐延长,最终占整个睡眠阶段的45-55%。2期睡眠中惊醒需要更大的刺激。2期睡眠中脑电波显示相对较低的电压及混合频率的活动,这一阶段以睡眠梭形波和K复合波为特征。其中睡眠梭状波与记忆密切相关。
3期睡眠+4期睡眠是慢波睡眠,更深度的睡眠。2期睡眠中高电压(至少75μV)慢波(2cps)--δ波活动开始出现,当慢波活动占据20-50%时,达到3期睡眠标准。3期睡眠持续数分钟,占3-8%。当慢波活动达到50%以上时,进入4期睡眠,第一个周期中4期睡眠持续20-40分钟,最终占睡眠总时间的10-15%。3,4期睡眠需要更大的刺激才能导致醒觉,3,4两期睡眠常合称慢波睡眠(SWS),δ睡眠或是深睡眠。
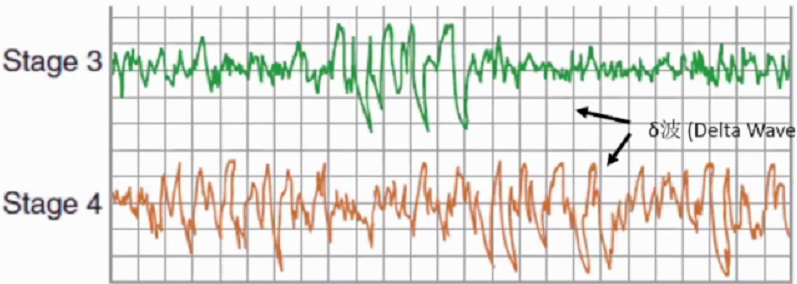
REM睡眠是睡眠进行中可能的调控阶段。REM睡眠定义为去同步化(低电压,混合频率),肌张力缺失,眼部快速移动。其间,锯齿波(Sawtooth wave),θ波和慢α波活动为特征。最初REM仅持续1-5分钟,随着睡眠的推移不断延长。与NREM睡眠主要满足睡眠基本功能不同,据推测,REM的生理作用可能为推动NREM的持续。

4.NREM 睡眠和REM 睡眠有着不同的功能
在NREM睡眠中,生长激素分泌明显增高,特别是在S4,达到个体24小时分泌的最高点,因而推测NREM睡眠主要与人的生长发育有关。交感神经系统活动降低包括,呼吸平稳心率减慢血压体温下降;全身代谢减慢,对外界的反应减少包括,脑血流量减少,神经元活动降低,肌张力降低,无明显眼球运动。
在REM睡眠时期,人的做梦也主要发生在这个阶段。在此阶段,中枢神经系统各部分神经元活动增高,故推测此阶段的意义在于对儿童发育中的神经系统成熟以及成人突触联系的维持,此期与脑的髓鞘形成有大致平衡的关系,认为在神经系统的发育中有重要作用。脑内蛋白的合成增加。此阶段主要与人的某些心理功能有关。REM睡眠期脑活动和EEG表现与清醒时相似,脑代谢与脑血流量增加,大部分神经元活动增加。此外,自主神经不稳定包括心率、血压、呼吸明显而不规则的阵发性变化,会出现某些意外事件-脑血管病、心绞痛、哮喘等;各种感觉功能明显减退;EMG中肌肉活动减少或消失,除眼肌中耳肌,其他肌张力极低。
1.高血压风险
宾夕法尼亚队列研究提示慢性失眠患者高血压风险为睡眠正常者的2.2倍。该队列研究纳入1741例完成实验室睡眠评估的人群,其中786无高血压,平均长达7.5年的随访。记录高血压事件的发生数。使用正常睡眠者结果作为基准,矫正其他两组OR。慢性失眠患者高血压风险OR=2.24(1.19-4.19 C1=95%,矫正年龄、性别、睡眠呼吸障碍、肥胖等风险因素)。与正常睡眠时长的患者比较,慢性失眠且睡眠时长<6h的亚组,OR=3.75(1.58-8.95;Cl=95%)。
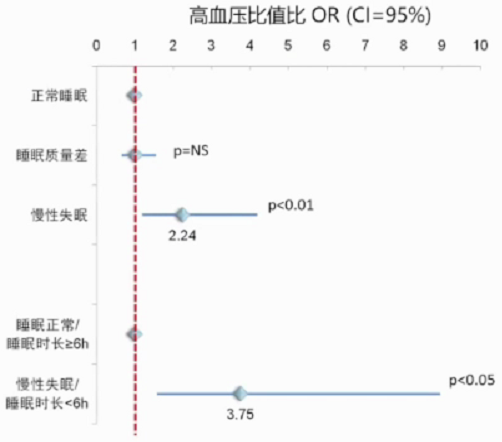 高血压事件定义为自述存在因较高的血压获得相应治疗。慢性失眠定义为抱怨出现为期一年以上的失眠症状。睡眠质量差定义为存在中度至重度的睡眠问题抱怨,包括难以入睡、睡眠难以维持、早醒或是睡后无恢复。睡眠正常者为排除以上两类外的人群。
高血压事件定义为自述存在因较高的血压获得相应治疗。慢性失眠定义为抱怨出现为期一年以上的失眠症状。睡眠质量差定义为存在中度至重度的睡眠问题抱怨,包括难以入睡、睡眠难以维持、早醒或是睡后无恢复。睡眠正常者为排除以上两类外的人群。
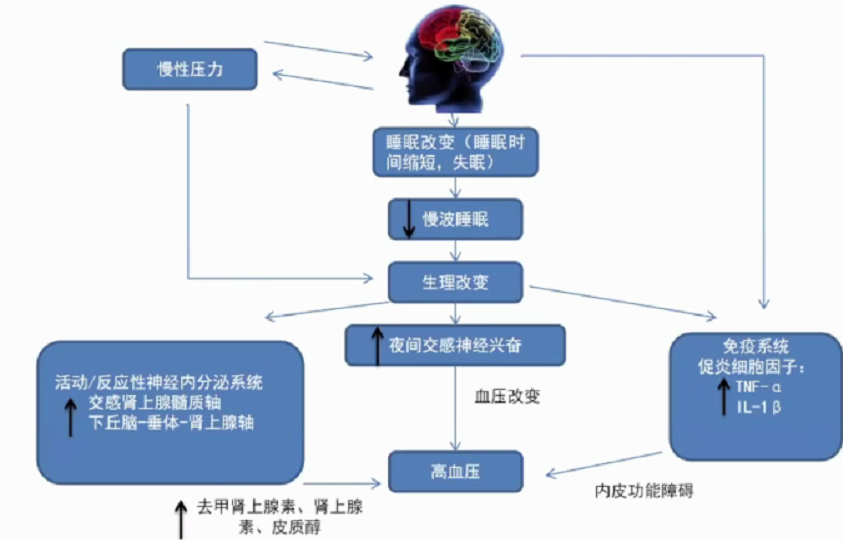
维持各期睡眠的意义,SWS缩短可能增加高血压风险。
2.Ⅱ型糖尿病风险
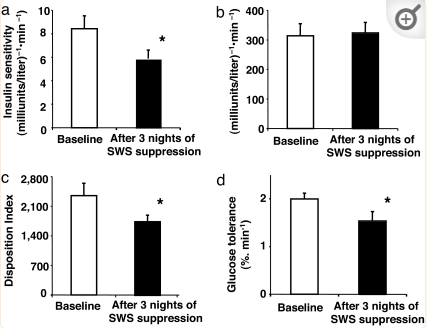
一项研究纳入9名年轻瘦体质健康人,选择性抑制SWS,评估其对葡萄糖代谢平衡的影响。受试者先进行连续2晚的“基线”睡眠,后进行三晚的SWS抑制睡眠,具体采用2期睡眠替代SWS的方法(总睡眠时长不变)。监测8波,同时采用静脉血糖容限测试评估血糖稳态。SWS抑制时,胰岛素敏感度(SL)、葡萄糖处置指数(DI)及葡萄糖耐量均显著低于基线水平。研究显示,睡眠质量下降伴随SWS水平降低(常见于老年人和肥胖个体)可能增加Ⅱ型糖尿病风险。
3.心血管疾病风险
一项含有2011年12月之前发表的13项前瞻性研究的荟萃分析,覆盖共计122501名患者,随访时间3-20年。共计发生6332例心血管事件(含急性心肌梗死、冠心病、卒中及因上述疾病死亡者)。研究提示失眠显著增加心血管疾病患病风险,RR=1.45 (95% Cl,1.29-1.62:p<0.0001)。
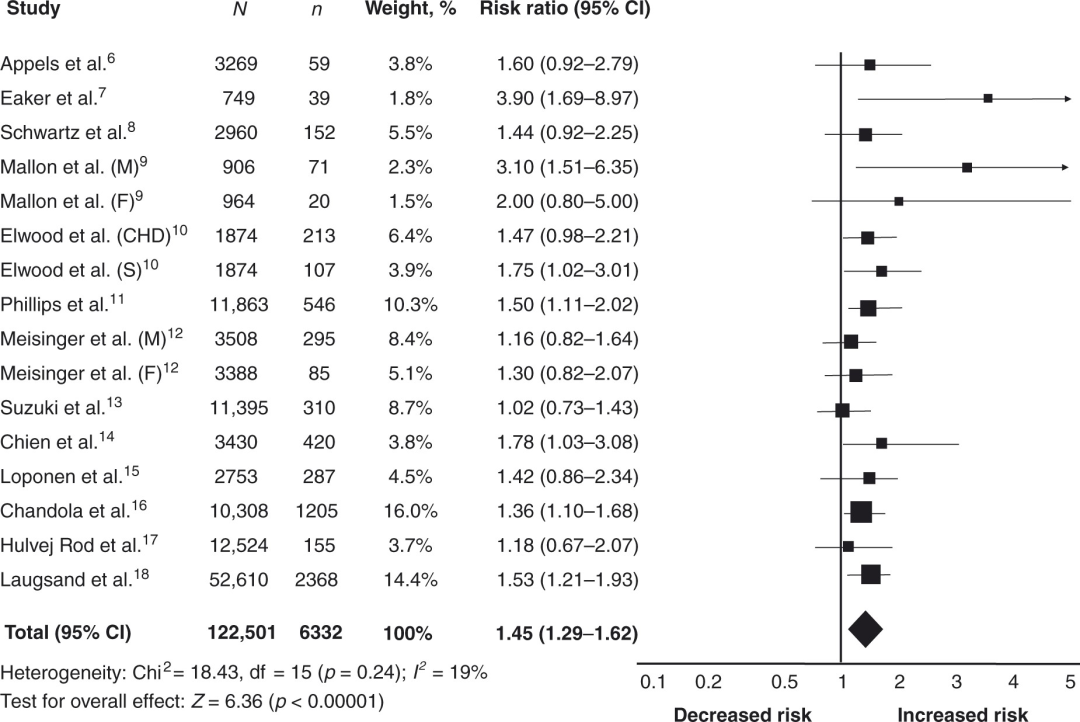
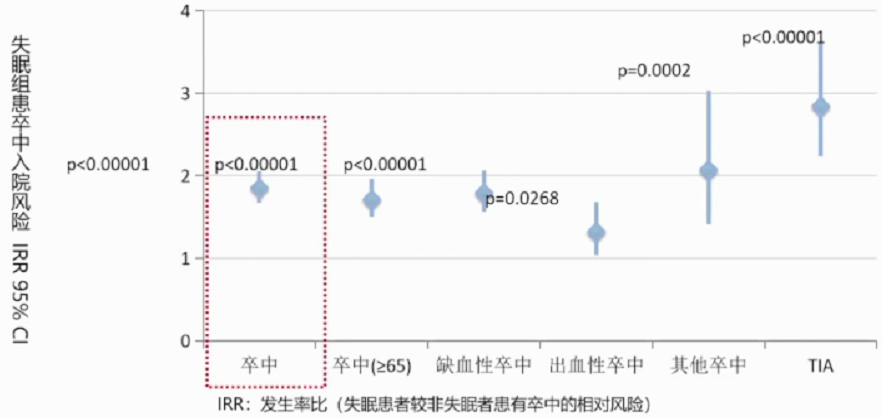
4.卒中风险
一项纳入21438名失眠患者和64314名非失眠者的长达四年的回顾性队列研究。人群数据来源于台湾健康保险数据库。使用国际医学操作分类(第九版修订稿)ICD-9-CM定义失眠及卒中,并排除睡眠呼吸暂停患者。所有试验者试验开始前均未被诊断为卒中、睡眠呼吸暂停和失眠。主要结局指标为第一次卒中急性发作入院治疗。研究结果显示,失眠患者的卒中患病风险比非失眠者高54% (IRR=1.85;矫正风险比HR=1.54;95% CI 1.38-1.72)。65岁以上组,失眠同样显著增加卒中风险(IRR=1.71,p<0.0001)。
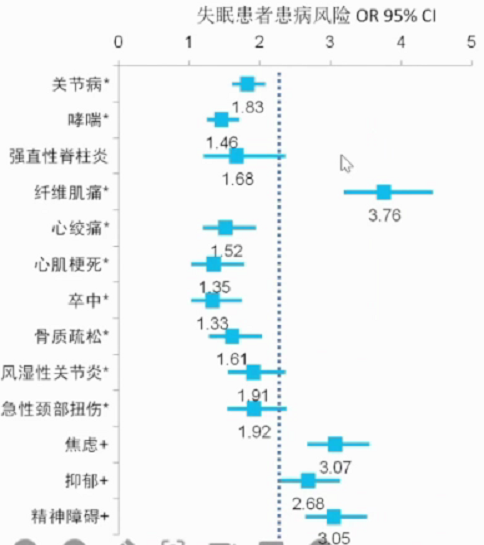
5.多种疾病风险
HUNT研究提示失眠可能与罹患多种疾病有关。HUNT试验数据来源于挪威北特伦德拉格健康研究(HUNT2:1995-1997;HUNT3:2006-2008)平均11年的随访,人群样本24715例,用以评估失眠作为风险因素对身体及精神疾病发生的影响。DSM-Ⅳ用以评估失眠,身体及精神状况为自述诊断结果,其中精神问题使用HADS、DSM- III、DSM-IV、ICD-8、ICD-9等进行评估。研究结果显示,失眠患者为下图多种疾病的危险因素(CI=95%,OR>1)。
1.失眠的定义及表现
失眠是患者对睡眠时间和/或质量不满足并影响日间社会功能的一种主观体验。其表现为:入睡困难(入睡时间>30分钟);睡眠维持障碍(整夜觉醒次数≥2次),夜间清醒时间≥30分钟;早醒,醒来时间提前至少30分钟(晨间早醒);睡眠质量下降;同时伴有日间功能障碍(核心要素)。失眠症可孤立存在或者与精神障碍、躯体疾病或物质滥用共病,可伴随多种觉醒时功能损害。
2.临床评估和诊断
病史+量表+仪器=主观症状+客观评估;
临床评估:病史采集,准确诊断的基础和核心;
量表测评:简单易行,量化直观,治疗效果评价及调整治疗的重要依据;
客观评估:共病排查及鉴别诊断的可靠手段。
病史采集:系统回顾明确是否存在其它各种类型的躯体疾病;是否存在心境障碍、焦虑障碍、记忆障碍,以及其他精神障碍;药物或物质应用史;过去2-4周内总体睡眠状况;进行睡眠质量评估;对日间功能进行评估,排除其他损害日间功能的疾病。
3.失眠状况的量表评估
睡眠质量评估量表—PSQI 匹兹堡睡眠质量指数;
日间思睡评估量表—ESS Epworth思睡量表;
其他辅助评估量表—Beck抑郁量表、疲劳严重程度量表、生活质量问卷(SF-36)、睡眠信念和态度问卷、ISI失眠严重程度指数。
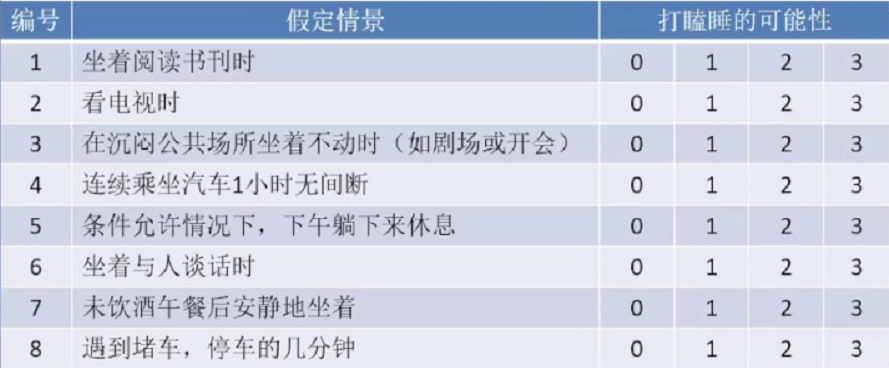 ESS是日间行为评估的简单工具。0:不会打瞌睡;1:打瞌睡可能性很小;2:打瞌睡可能性中等;3:很有可能打瞌睡。ESS(Epworth思睡量表)的分数为以上8个场景打分的总和。7-8分为平均值。当分值高于10分时即可认为存在日间行为异常。
ESS是日间行为评估的简单工具。0:不会打瞌睡;1:打瞌睡可能性很小;2:打瞌睡可能性中等;3:很有可能打瞌睡。ESS(Epworth思睡量表)的分数为以上8个场景打分的总和。7-8分为平均值。当分值高于10分时即可认为存在日间行为异常。
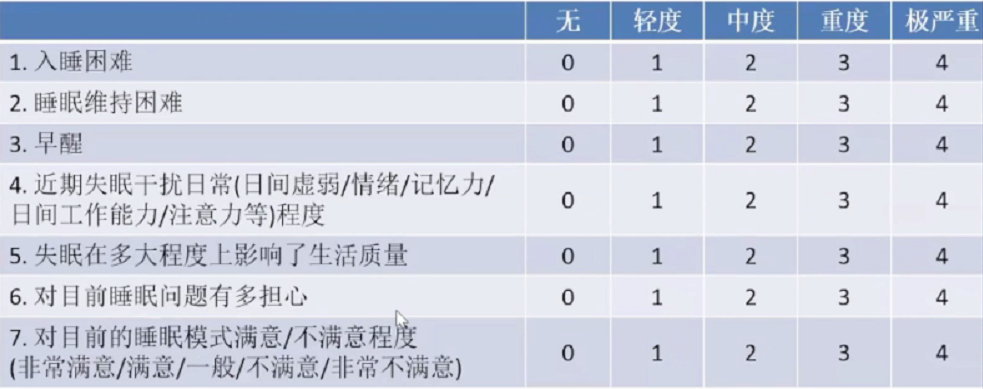 ISI是失眠严重程度评估的简单工具。ISI(失眠严重程度指数)的分数为以上7个问题的总得分。0-7:无临床上显著的失眠症;8-14:轻度失眠;15-21:临床失眠症(中重度);22-28:临床失眠症(重度)
ISI是失眠严重程度评估的简单工具。ISI(失眠严重程度指数)的分数为以上7个问题的总得分。0-7:无临床上显著的失眠症;8-14:轻度失眠;15-21:临床失眠症(中重度);22-28:临床失眠症(重度)
4.临床评估和诊断
客观评估:
-
主要用于睡眠障碍的评估和鉴别诊断,不作为常规检查;
-
多导睡眠图(polysomnogram,PSG);
-
多次睡眠潜伏期试验(multiple sleep latency test,MSLT);
-
体动记录仪(actigraphy)。
1.流行病学
从流行病学来说,睡眠障碍是一个普遍的问题,正常人群失眠发生率约为1/5, 脑卒中失眠发生率达到了3/5,急性卒中失眠发生率为57.9%,故PSSD应引起重视。
2.相互关系
PSSD与卒中部位、发病年龄及发病时间存在一定关系。
卒中部位:丘脑>大脑半球>基底节>脑干,左半球>右半球;下丘脑或第三脑室侧壁→持久昏睡;桥脑顶盖部内侧病灶→睡眠周期减少。发病年龄:患者年龄越大,发生率越高。发病时间:卒中的急性期,入院时无意识障碍者,入院后3-5 d内发生,有意识障碍者,清醒后3d内发生,部分4-14d内。
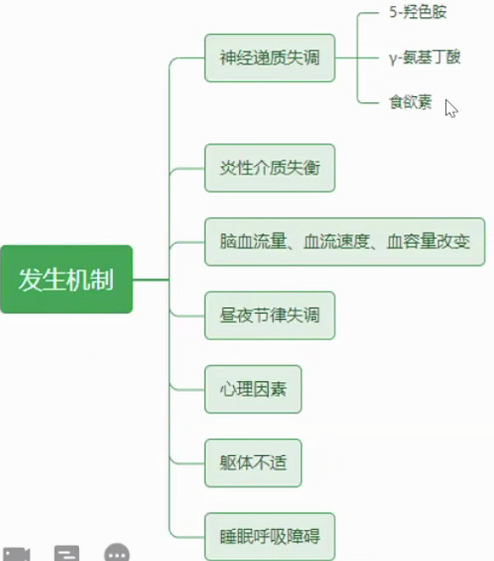
3.发生机制
4.分类
国际睡眠障碍分类:失眠障碍,睡眠相关运动障碍, 睡眠相关呼吸障碍,异态睡眠,睡眠-觉醒昼夜节律障碍和中枢性过度嗜睡障碍。
5.卒中后失眠障碍诊断标准
卒中后失眠诊断的前提是发生了卒中事件,同时满足失眠诊断标准,日间功能受损是诊断失眠障碍的必要条件。失眠的诊断标准(以下1-5必须全部满足):
(1)患者自述或照料者观察到患者出现以下1种或者多种症状:
-
入睡困难;
-
睡眠维持困难;
-
比期望起床时间更早醒来。
(2)患者自述或照料者观察到患者因为夜间睡眠困难而出现以下1种或者多种症状:
-
疲劳或缺乏精力;
-
注意力、专注力或者记忆力下降;
-
社交、家庭、职业或学业等功能损害;
-
情绪易烦躁或易激惹;
-
日间思睡;
-
行为问题(多动、冲动或攻击性);
-
驱动力、精力或动力缺乏;
-
易犯错或易出事故;
-
对睡眠质量感到忧虑。
(3)这些异常不能单纯以睡眠时间不充足(如充足睡眠时间)或睡眠环境不佳(如环境安全、黑暗、安静、舒适)所解释。
(4)睡眠紊乱和相关日间症状出现至少每周3次。
(5)上述症状不能用其他睡眠疾病更好地解释。
6.卒中后睡眠呼吸障碍
卒中相关睡眠呼吸障碍(SDB),主要以间歇性夜间缺氧、睡眠中断和嗜睡为特征。包括:
-
阻塞性睡眠呼吸暂停(OSA)
-
中枢性睡眠呼吸暂停(CSA)
-
混合性睡眠呼吸暂停
根据ICSD-3诊断标准,成人OSA的诊断需要具备以下第1+2项或第3项:
(1)以下表现至少出现1项:
-
患者主诉困倦、非恢复性睡眠、乏力或失眠;
-
因憋气或喘总从睡眠中醒来;
-
同寝室或其他目击者报告患者在睡眠期间存在习惯性打鼾、呼吸中断或二者皆有;
-
已确诊高血压、心境障碍、认知功能障碍、冠心病、脑血管疾病、充血性心力衰竭、心房颤动或2型糖尿病。
(2)PSG或者睡眠中心外监测(OCST)证实:PSG或OCST监测期间,发生以阻塞性为主的呼吸事件≥5次/h(包括阻塞型呼吸暂停、混合型呼吸暂停、低通气和呼吸努力相关性觉醒)。
(3)PSG或者OCST证实:PSG或OCST监测期间发生阻塞性为主的呼吸事件≥15次/h(包括呼吸暂停、低通气或RERAs)。
7.卒中后睡眠呼吸障碍治疗
首先避免可能加重睡眠呼吸障碍的因素,如催眠药的使用。在卒中急性期,对于轻-中度OSA及体位性 OSA患者,体位干预治疗是一种简单、易行、费用低且有效的方法,患者及家属依从性较好。而对于中重度及体位治疗无效的OSA患者, CPAP(持续正压通气治疗)是治疗卒中相关 OSA的一线方法。对于经无创气道正压治疗仍不能纠正缺氧和频繁呼吸暂停者,或意识障碍进行性加重、呼吸道感染、窒息及中枢性肺通气不足者,可考虑有创辅助通气治疗。在卒中恢复期,应尽量保证侧卧位睡眠或抬高床头,戒烟戒酒、谨慎服用镇静催眠药物,并进行长期随访以确定是否需继续治疗。
8.卒中后昼夜节律失调性睡眠-觉醒障碍
它是一种因昼夜时间维持系统、诱导系统变化或内源性昼夜节律与外部环境间不同步所引起的各种睡眠觉醒障碍,分为睡眠时相延迟障碍、睡眠时相提前障碍、非24h睡眠觉醒节律障碍和无昼夜节律的睡眠障碍。
根据ICSD-3诊断标准,CRSWDs总体诊断必须满足以下第1-3项:
(1)睡眠-觉醒节律失调长期或反复发作,主要由于内源性昼夜节律定时系统改变,或者由于个人内源性昼夜节律与期待或需求的生理环境或社会/工作作息时间之间不匹配所导致。
(2)昼夜节律失调导致一系列失眠或嗜睡,或两者兼有。
(3)睡眠-觉醒节律失调导致有临床意义的痛苦或心理、生理、职业、教育等社会功能的损害。
治疗方面抗组胺类药物能延长卒中后CRSWDs患者睡眠时间并减少中途觉醒,进而缩短入睡潜伏期。褪黑素及其受体激动剂能调节睡眠-觉醒生物节律,从而减少睡眠潜伏期和觉醒频率。
9.卒中后不宁腿综合征/睡眠中周期性肢体运动
卒中后不宁腿综合征(RLS)是一种常见的睡眠相关运动障碍,患病2.3%-15.1%。卒中后睡眠中周期性肢体运动临床相对少见,PLMS的数量增加到一定程度引起的临床睡眠障碍称周期性肢体运动障碍(PLMD)。卒中患者的RLS及PLMD通常同时存在。
卒中相关RLS/PLMD诊断应同时符合卒中及RLS/PLMD诊断标准。RLS的诊断标准必须同时满足以下第1-5项:
(1)有活动双下肢的强烈愿望,常伴随双下肢不适感,或不适感导致了活动欲望。
(2)强烈的活动欲望及不适感出现在休息或不活动(如患者处于卧位或坐位)时,或在休息或不活动时加重。
(3)活动(如走动或伸展腿)过程中,强烈的活动欲望及不适感可得到部分或完全缓解。
(4)强烈的活动欲望及不适感在傍晚或夜间加重,或仅出现在傍晚或夜间。
(5)以上表现不能单纯由一种疾病或现象解释,如肌痛、静脉瘀滞、下肢水肿、关节炎、下肢痉挛、体位不适、习惯性拍足等。
RLS的诊断不需要多导睡眠图评估。PLMD的诊断主要评估手段是PSG监测,诊断标准要求成人每小时睡眠有15次以上PLMS(儿童有5次以上),导致有临床意义的睡眠障碍或者精神、躯体、社会、职业、教育或行为方面的损害,且不能由其他疾病所解释。
治疗方面:
(1)首先需要控制危险因素,保证营养,纠正可能的铁缺乏,适度运动,可采用散步、骑车、浸泡患肢和腿部按摩等方法缓解症状;
(2)药物疗法,电压门控钙通道配体(如普瑞巴林、加巴喷丁),多巴胺能药物(如普拉克索、罗匹尼罗),阿片类,苯二氮卓类;
(3)PLMD的治疗方法与RLS相似;
(4)严重的RLS通常需终生用药,难治性患者可考虑联合用药。
10.卒中相关异态睡眠
异态睡眠是睡眠和觉醒过程本身的疾病,是在睡眠过程中表现出的中枢神经系统、自主神经系统活动改变和骨骼肌的活动干扰了正常睡眠。主要发生在部分唤醒、完全唤醒或睡眠不同阶段的转醒期,这些异常行为包含运动行为、情绪、感知、做梦和自主神经系统功能相关的睡眠异常,可能导致自伤或伤及同床者、睡眠中断、不良健康效应和不良的心理社会效应。
卒中相关RBD的诊断需同时满足卒中和RBD的诊断标准,根据ICSD-3诊断标准,RBD诊断需要同时符合下列第1-4项:
(1)重复发作的睡眠相关的发声和/或复杂动作。
(2)PSG证实这些行为发生在REM期,或基干梦境扮演病史,推测该行为发生在REM期
(3)PSG证实REM睡眠期无肌张力缺失。
(4)不能用其他睡眠障碍、精神障碍、内科疾病、药物或物质滥用解释。
治疗方面:
(1)减少行为事件和防止睡眠相关损伤,尽可能停用或避免使用已知会加重 RBD的药物,包括5-羟色胺能抗抑郁药,同时治疗并发的其他睡眠障碍,如 OSA等。
(2)褪黑激素和氯硝西泮均能有效抑制大多数患者的RBD行为。
睡前给予大剂量褪黑激素(6-18mg)可增强REM睡眠时的肌张力降低并改善RBD症状;氯硝西泮可在睡前小剂量给药(0.5-1mg),但是针对卒中相关RBD患者使用氯硝西泮时需要考虑卒中病变部位,尤其是脑干梗死的患者,需权衡呼吸抑制、肌松及跌倒风险等。
(3)胆碱能药物(卡巴拉汀、多奈哌齐)和多巴胺能药物(如左旋多巴、普拉克索、罗匹尼罗)的使用存在争议。
11.卒中后日间思睡
卒中后日间思睡是指无法在日间主要清醒期间保持觉醒和警觉,并且几乎每日都会在无意间或在不适当的时间睡觉,持续至少3个月。临床主要表现为在白天应该维持清醒的主要时段不能保持清醒和警觉,出现难以抑制的困倦欲睡,甚至突然入睡,造成意外风险,可能伴有注意力、记忆和认知的下降。
根据ICSD-3诊断标准,由疾病引起的EDS诊断必须满足以下第1-4项:
(1)每日出现难以克制的闲倦欲睡或非预期的白天入睡。
(2)日间嗜睡是明确的基础疾病或神经系统疾病的结果。
(3)如果进行MSLT(多次睡眠潜伏期试验),可见平均睡眠潜伏期<8 min,睡眠起始REM期少于2次。
(4)嗜睡和/或MSLT 结果不能以其他未治疗的睡眠疾病、精神疾病和药物或毒品作用而更好地解释。
卒中后EDS应着力于治疗基础疾病并尽可能提供对症治疗:
非药物治疗主要包括:(1)积极睡眠卫生管理,包括良好的睡眠环境、规律的作息时间、日间适量的运动、睡前行为指导等。(2)高压氧治疗、康复训练可能有益。
药物治疗:多巴胺类药物、莫达非尼、哌甲酯等中枢兴奋剂等可能有效。卒中患者EDS与RLS(不宁腿综合征)、肥胖、糖尿病相关,积极控制相关危险因素可能减少卒中相关EDS发生,改善EDS临床症状。
12.失眠的药物治疗
失眠的药物治疗常见镇静催眠药物。苯二氮卓类受体激动剂。传统的苯二氮卓类药物BZDS,GABAA上不同的α亚基,具有镇静、抗焦虑、肌松和抗惊厥作用;新型非苯二氮卓类药物,non-BZDs,GABA上的α1亚基更具选择性,主要发挥催眠作用。
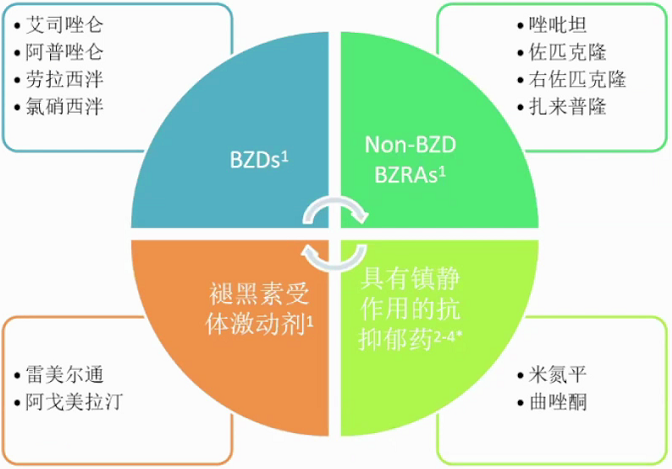
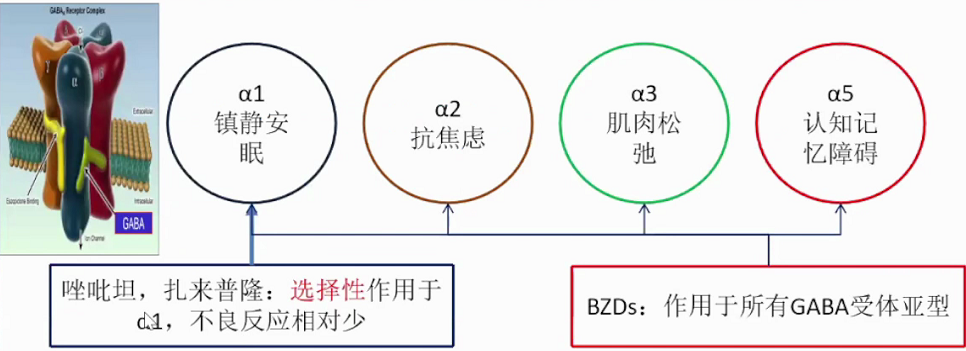
BZDs类药物的非选择性可能导致其多种不良反应。与BZRAs结合的GABAA受体α亚基主要分为α1、α2、α3、α5四种亚型,以唑吡坦为代表的non-BZDs选择性作用于α1,不良反应相对较少。
传统的苯二氮卓类药物不良反应包括日间木倦、头昏、肌张力减退、跌倒、认知功能减退等;反跳性失眠,戒断症状;老年患者应用时尤须注意药物的肌松作用和跌倒风险;禁用于妊娠或泌乳期的妇女、肝肾功能损害者、阻塞性睡眠呼吸暂停综合征患者以及重度通气功能缺损者。
非苯二氮卓类药物,如唑吡坦、唑吡坦控释剂、佐匹克隆、右佐匹克隆和扎来普隆,这类药物半衰期短,一般不产生日间困倦,长期使用无显著药物不良反应,有可能会在突然停药后发生一过性的失眠反弹。
褪黑素和褪黑素受体激动剂。褪黑素受体激动剂阿戈美拉汀,缩短睡眠潜伏期、增加总睡眠时间,以入睡困难为主诉的失眠以及昼夜节律失调性睡眠障碍,作为不能耐受BZDs药物患者以及已经发生药物依赖患者的替代治疗。
抗抑郁药物选择性5-羟色胺再摄取抑制剂(SSRIs),通过治疗抑郁和焦虑障碍而改善失眠症状;部分SSRIs延长睡眠潜伏期,增加睡眠中的觉醒,减少睡眠时间和睡眠效率,减少慢波睡眠,可能增加周期性肢体运动和NREM睡眠期的眼活动;一般建议SSRIs在白天服用。
抗抑郁药物5-羟色胺/去甲肾上腺素再摄取抑制剂(SNRIs),文拉法新、度洛西汀,不良反应同SSRIs。其它抗抑郁药物包括小剂量米氮平(≤15mg/d)、小剂量曲唑酮(25-100mg/d)、治疗失眠和催眠药物停药后的失眠反弹。
对于伴有呼吸系统疾病的特殊类型失眠患者的药物治疗:BZDs在慢性阻塞性肺病、睡眠呼吸暂停低通气综合征患者中慎用;高碳酸血症明显的COPD急性加重期、限制性通气功能障碍失代偿期的患者禁用BZDs;non-BZDs唑吡坦和佐匹克隆可用于治疗稳定期的轻、中度COPD的失眠患者;褪黑素受体激动剂雷美尔通可用于治疗睡眠呼吸障碍合并失眠的患者。
13.PSSD治疗
对于失眠患者,应根据失眠类型选择不同种类的药物:入睡困难选择速效镇静催眠药物如唑吡坦,扎来普隆等;早醒选择中或长半衰期镇静催眠药物如艾司唑仑、地西泮等;睡眠维持困难(频繁觉醒)选择艾司唑仑等镇静催眠药物;伴有焦虑或抑郁,选用非苯二氮革类药物,如唑吡坦等可加用选择性5-羟色胺或去甲肾上腺素再摄取抑制药治疗;过度睡眠,选用中枢兴奋剂如莫达非尼、哌甲酯(利他林)等。
睡眠障碍是卒中后一个重要的并发症,不仅影响患者的生活质量、身心健康,而且会加重糖尿病、高血压等卒中危险因素的程度,甚至诱发卒中的再发。卒中后睡眠障碍其病因、发病机理复杂,发病类型多种多样,治疗方法也不尽相同,应给予足够的重视,并给予积极治疗,改善睡眠质量和/或增加有效睡眠时间,恢复社会功能,提高患者的生活质量,减少或消除与失眠相关的躯体疾病或与躯体疾病共病的风险,避免药物干预带来的负面效应。