全球首例外科途径脉冲电场消融技术治疗心房颤动
刘健1, 2,刘方舟1, 2,郭海江1, 2,林炜东1, 2,刘浩忠1, 2, 3,谭桐1, 2,马坚锐1, 2, 3,黄焕雷1, 2,薛玉梅1, 2,陈寄梅1, 2,庄建1, 2,郭惠明1, 2
1. 广东省心血管病研究所 南方医科大学附属广东省人民医院 (广东省医学科学院) 心血管外科(广州 510080)
2. 广东省华南结构性心脏病重点实验室(广州 510080)
3. 汕头大学医学院(广东汕头 515041)
通信作者:郭惠明,Email:guohuiming@gdph.org.cn
关键词:心房颤动;外科治疗;脉冲电场消融;新型能源;病例报告
引用本文:刘健,刘方舟,郭海江,林炜东,刘浩忠,谭桐,马坚锐,黄焕雷,薛玉梅,陈寄梅,庄建,郭惠明. 全球首例外科途径脉冲电场消融技术治疗心房颤动. 中国胸心血管外科临床杂志, 2023, 30(11). doi: 10.7507/1007-4848.202307020
LIU Jian, LIU Fangzhou, GUO Haijiang, LIN Weidong, LIU Haozhong, TAN Tong, MA Jianrui, HUANG Huanlei, XUE Yumei, CHEN Jimei, ZHUANG Jian, GUO Huiming. Pulsed field surgical ablation treatment for atrial fibrillation: The first case report. Chinese Journal of Clinical Thoracic and Cardiovascular Surgery, 2023, 30(11). doi: 10.7507/1007-4848.202307020
摘 要
心房颤动(房颤)是临床常见的心律失常,目前临床上成熟的房颤消融能源主要包括射频消融和冷冻消融。近年来,具有组织特异性的新型消融方式——脉冲电场消融逐渐应用于临床。本文介绍了全球首例房颤患者接受经外科途径脉冲电场消融治疗的诊治经过,患者同期接受瓣膜与冠状动脉的外科干预,术中复律后呈窦性心律。1、3个月后复查24 h动态心电图均未见房颤,患者症状、心功能及生活质量明显改善。
正 文
心房颤动(房颤)是发病率较高的心律失常类型之一[1]。房颤常伴随卒中、心力衰竭等不良事件的出现,房颤患者发生卒中的风险是普通人5倍以上[2]。房颤的非药物治疗方式主要分为导管消融和外科迷宫消融术,较为成熟的房颤消融能源包括射频消融和冷冻消融。Cox-Maze Ⅳ作为外科射频消融的首选术式,对于有症状合并瓣膜病或冠心病的房颤患者建议同期进行开放式手术消融(Ⅰ类推荐,证据级别B),此类患者术后1年维持非房颤心律比例达60%~90%,同时有约9%的患者术后发生各种不良反应[3]。为提高射频消融的有效性、降低复发率,可采取提高电消融能量以增加心肌组织透壁率[4],但这也可能引起影响房颤射频消融安全性相关的并发症,如肺静脉狭窄、周围组织损伤、冠状动脉损伤及术后心力衰竭、低心排血量等。冷冻消融技术同样存在类似的局限性,对血管结构的损伤可能引起组织出血、血肿、血栓等并发症[5]。脉冲电场消融(pulsed field ablation,PFA)因其心肌组织选择性和操作便捷性弥补了现有技术的缺陷。随着真实世界的数据积累,PFA治疗成果不断得到验证。本研究基于PFA和外科治疗房颤原理,首次提出使用外科脉冲电场消融(pulsed field surgical ablation,PFSA)技术治疗房颤,该技术将扩大脉冲消融的适应证,为房颤消融治疗开拓了全新思路。
临床资料
患者,女,57岁,以“心悸、活动后气促1个月余”入院。1个月余前因感染新型冠状病毒后出现心悸、气促不适,休息后可缓解,无咳嗽、发热、胸痛等不适。至当地医院检查提示二尖瓣、三尖瓣重度反流,予利尿等治疗后症状缓解但仍反复发作。既往房颤病史多年,规律口服利伐沙班抗凝治疗。
入院查体
体温36.6℃,房颤心律,心率100次/分,呼吸16次/分,血压140/70 mm Hg,身高165 cm,体重71.5 kg。经胸超声心动图提示双房扩大,左房49 mm,右房70 mm,左室舒张期末及收缩期末内径分别为54 mm、36 mm;瓣膜形态可,瓣环扩张,重度二尖瓣反流,重度三尖瓣反流,轻度主动脉瓣反流;左室射血分数61%,右心室面积变化分数37%。常规15导联心电图及24 h动态心电图示快速型房颤,平均心率119次/分。冠状动脉造影提示左前降支中段狭窄80%,狭窄以远并心肌桥,前向血流心肌梗塞溶栓(thrombolysis in myocardial infarction,TIMI)0级。术前诊断:重度二尖瓣反流,重度三尖瓣反流,轻度主动脉瓣反流,冠状动脉粥样硬化性心脏病,房颤,纽约心脏协会心功能Ⅲ级。经多学科讨论与协商,拟行外科二尖瓣成形术、三尖瓣成形术、一根桥的冠状动脉移植术,同期行PFSA。其余检查未见手术禁忌。
手术过程
患者静脉吸入复合麻醉,行双腔气管内插管。胸骨正中切口开胸,先行取左侧乳内动脉备用。切开并提吊心包,暴露心脏。肝素化后行主动脉及上下腔静脉插管,置左心引流,建立体外循环。运用PFSA系统(图1)行Maze-Ⅳ消融。用一次性脉冲消融钳先行隔离钳夹右肺静脉(图2a),后阻断上下腔静脉,右房做纵切口;按照消融路线,继续消融上腔静脉-下腔静脉连线、切口至心耳和三尖瓣前瓣环连线(图2b);三尖瓣峡部采用一次性消融笔进行补充消融(图2c)。而后降温,阻断主动脉,灌注心肌保护液,停跳心脏,于心包腔置入冰屑。继续进行消融,钳夹和隔离左肺静脉,并切断马氏韧带。切除并缝闭左心耳,消融左心耳-左肺静脉连线。经房间隔暴露左房,经右上肺静脉消融左房顶作左肺静脉-右肺静脉连线,经右下肺静脉分别消融右下肺静脉-左下肺静脉连线以及右肺静脉-二尖瓣连线。而后再次使用一次性脉冲消融笔补充消融二尖瓣峡部,完成完整的Maze-Ⅳ消融术。PFSA总时间为110 s。分别探查二尖瓣、三尖瓣,可见二尖瓣、三尖瓣瓣环明显扩大。测量二尖瓣瓣环大小,予间断缝合固定人工成形环,注水检查未见明显反流即缝合房间隔。继续行三尖瓣成形术,步骤基本同前。最后完成冠状动脉旁路移植术,跨过左前降支狭窄部位,吻合左乳内动脉-左前降支中段。排气,开放主动脉及左乳内动脉-左前降支桥血管,复温,缝闭右房。分别于下腔静脉、左心房外膜上缝合荷包,预埋标测导管;心脏自动复跳,逐渐转为窦性心律,应用环肺电极通过预埋鞘管分别在左右房心内膜进行激动标测及基质标测(Ensite Navx 三维标测系统),标测提示肺静脉电位消失,后壁隔离,三尖瓣峡部阻滞。经食管超声检查明确瓣膜功能良好,桥血管通畅,术毕。出院当天复查心电图提示窦性心律。体外循环总时间277 min,主动脉总阻断时间104 min。患者术后转至ICU行监护治疗5 d,住院时间8 d。

图 1 外科脉冲电场消融系统
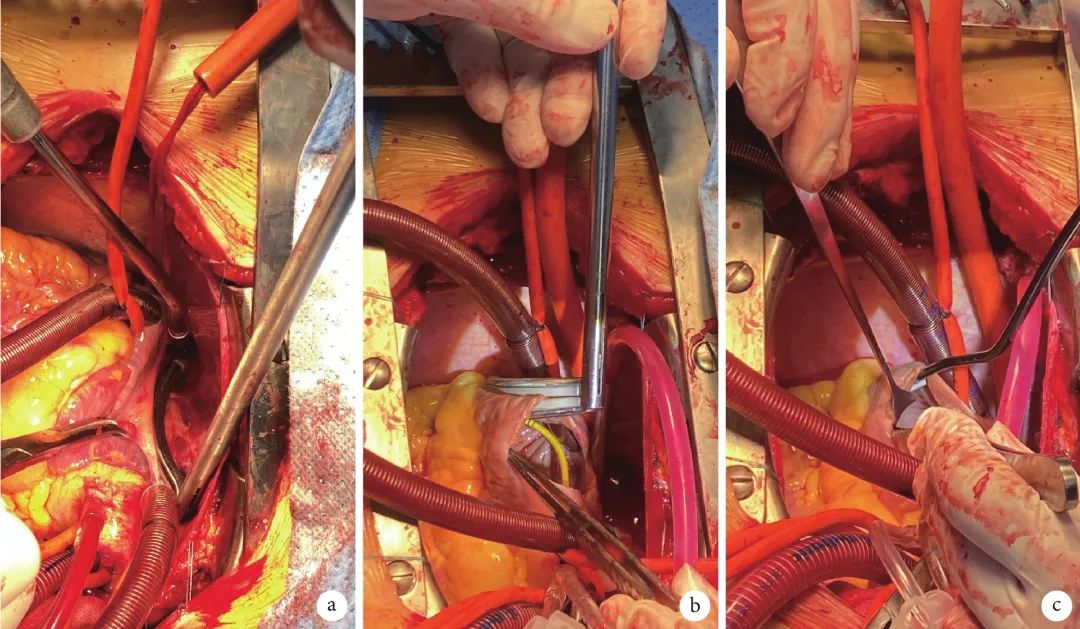
图 2 外科脉冲电场消融的手术应用
a、b:脉冲消融钳的应用;c:脉冲消融笔的应用
术后随访
患者遵嘱服用胺碘酮、地高辛等药物,按时完成术后1、3个月两次门诊随访。术后1个月随访,患者称症状较前明显好转,复查心脏彩色超声提示二尖瓣未见明显反流,三尖瓣轻度反流;24 h动态心电图提示:(1)窦性心律;(2)阵发性心房扑动。术后3个月动态心电图随访维持窦性心律。
伦理审查:本研究经广东省人民医院伦理审查委员会批准, 伦理批准号:QX2023-003-02。
讨论
近年来,随着在房颤治疗领域对能源的探索和发展,PFA突破“冰与火“的界限,并迅速在导管消融中得到应用。PFA 的原理来自库伦定律,即两个点电荷之间的相互作用力同它们的电荷量的乘积成正比,与它们的距离的二次方成反比,当在细胞膜的磷脂双分子层结构施加一定强度的电场力时,会导致心包膜出现“穿孔”,从而使细胞膜失去维持渗透性的功能,当细胞内平衡丧失的程度足够大或持续时间足够长,细胞就不能恢复正常功能,并通过直接坏死过程或各种程序性细胞凋亡实现对心房细胞的不可逆损伤,从而达到消融的目的[6]。Reddy等[7-9]在2019—2021年先后报道经皮导管PFA治疗房颤的初步和随访结果,一致表明PFA具有良好的隔离肺静脉效果且不致其狭窄。PULSED AF Pivotal试验[10]评估了阵发性和持续性房颤患者接受PFA治疗术后12个月内的安全性和有效性,结果显示技术并发症发生率仅0.7%,表现为轻度脑血管不良事件和心包积液;而术后肺静脉隔离率则达100%,房颤治疗临床成功率达到约80%。对于PFA与传统能源消融效果的对比研究目前仍较少,其中一项非随机对比研究[11]结果发现,PFA术后S-100β与高敏肌钙蛋白I的含量比值低于冷冻球囊消融术(P<0.001),说明PFA 导致神经元损伤更少,对组织的保护作用优于冷冻消融。上述研究均表明PFA在导管消融中具有广阔应用前景,但用于外科手术的PFA技术仍无报道。
本例同时罹患心脏瓣膜疾病、冠心病合并房颤,病情复杂,有明确的手术适应证。对患者而言,若在外科手术同期处理房颤是相对较好的时机,可避免术后再次消融手术,利于改善患者症状且提高术后生活质量。然而实现一站式手术的难题是本次消融术式的选择:Maze-Ⅳ手术治疗房颤的应用最为广泛,但无论使用射频或冷冻能源,在此复杂手术中仍会导致主动脉阻断时间、体外循环时间延长,扩大创伤并增加并发症出现的风险。经讨论,决定对患者实施全球首例PFSA 以治疗房颤。PFSA 操作顺利并成功达到术中窦性心律转归的良好效果。我们认为,其优质的治疗效果源自PFSA 的能源选择和独特设计带来的优势。首先,PFSA具有高选择性——区别于射频消融使用热能产生的细胞凝固性坏死和冷冻消融利用降温破坏细胞组织电活动,PFSA在高电压电场的作用下,永久改变细胞膜的通透性并导致细胞凋亡[12]。这种不可逆电穿孔仅在电势超过心肌细胞对应阈值能量水平(400 V/cm)时产生[13],且该阈值在心肌周围组织中最低,因此对食管、膈神经、冠状动脉等组织无损伤,展现了该技术良好的安全性[14-15]。其次,PFSA 是基于外科途径设计的技术,在保留外科消融技术优势的基础上,运用新型能源消融治疗房颤,使术者在心房、瓣膜、心耳等结构充分暴露的环境中,直视下进行操作,对于部分消融钳难以夹持的位置,可用脉冲消融笔进行补充,提升了峡部消融的安全性和组织透壁率,同时加强了消融治疗房颤的有效性。另外,PFSA 在短时间内即可产生高电压电脉,无论是对比传统的“逐点式”导管消融还是外科射频消融,都极大地缩短了操作时间、消融时间及主动脉阻断时间。本例组织消融时间累计2 min内,说明该技术在外科手术中操作直观、便捷,对于合并房颤的复杂外科手术案例更加具备推广普及的潜质。
本文报道了全球首例PFSA治疗房颤,术后患者即刻转复窦律,术后1、3个月短期随访结果良好,维持窦性心律。本例为治疗复杂房颤提供指导意义,但该技术的有效性与安全性仍待前瞻性临床研究及长期随访结果验证。
利益冲突:无。
作者贡献:刘健负责临床诊治和手术操作、初稿撰写、修改;刘浩忠、郭海江、黄焕雷、薛玉梅、谭桐负责临床数据整理;陈寄梅、庄建负责论文修改;马坚锐负责文献检索;刘健、郭惠明、刘方舟、林炜东负责临床诊治和手术操作;郭惠明负责全文审校。
致谢 本文受广东省属科研机构创新能力建设稳定性支持专题2021(Guangdong Special Funds for Science and Technology Innovation Strategy, China (Stability Support for Scientific Research Institutions Affiliated to Guangdong Province-GDCI 2021)支持。
参考文献略。
专家简介
关注我们
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动