荆志成教授:国人肺动脉高压遗传模式、发病机制与新药研发

肺动脉高压是一大类因肺动脉压力增高而引起心力衰竭致残致死的恶性疾病,被公认为心血管疾病中的“恶性肿瘤”。广东省人民医院荆志成教授长期从事肺动脉高压(PAH)领域临床研究,以20多年亲历研究发展为例,分享了“国人PAH遗传模式、发病机制与新药研发”精彩讲题,从PAH发病机制、遗传学研究、新药研发多角度进行详细讲解。医谱学术根据讲题内容特此整理,以供参考。
PAH发病机制
PAH是一类由多种病因导致肺血管病理闭塞、肺动脉压持续升高,造成心力衰竭、致残致死的心肺血管疾病。其特点是肺动脉和肺小动脉的血压升高,导致心脏右心室负荷增加和心功能障碍。病理因素主要包括内皮细胞增殖或平滑肌细胞细胞功能障碍等。其发病机制复杂多样,是多种因素相互作用的结果,遗传因素是重要发病机制之一。
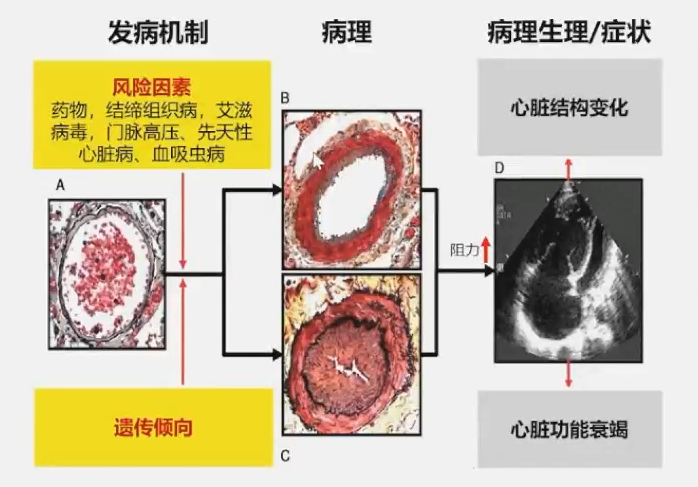
PAH遗传研究进展
BMPR2基因与PAH的发病关系密切,在所有类型的PAH中均能发现其表达降低,但肺动脉平滑肌细胞中BMPR2的缺失与PAH发病机制之间的功能和分子联系值得进一步研究。
2000年在Nature genetics发布了一项关于BMPR2基因的相关研究,在对8个家系的研究中,鉴定了7位先证者的BMPR2基因序列变异。发现了两个移码突变,两个无义突变,三个错义突变。
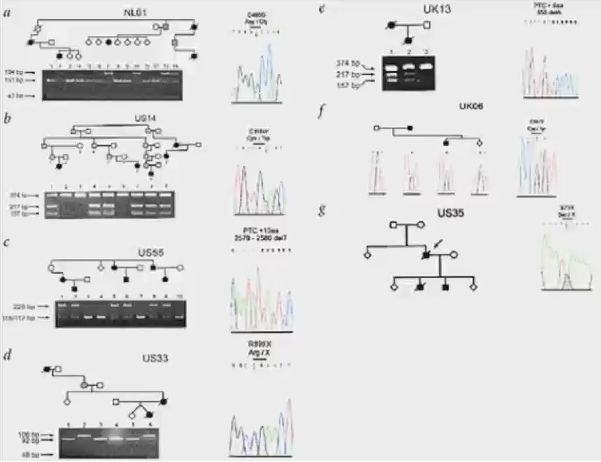
2001年,发布于英格兰医学杂志的一项研究历经20年,追踪了7代家系,在超过200名后代中一共发现18名PAH患者(女性16人,男性2人)。通过基因突变检测,发现至少23人(女性12人,男性11人)携带致病基因,他们具有相同的BMPR2突变,即3号外显子的354位置胸腺嘧啶突变为鸟嘌呤。(箭头所指为先证者。)
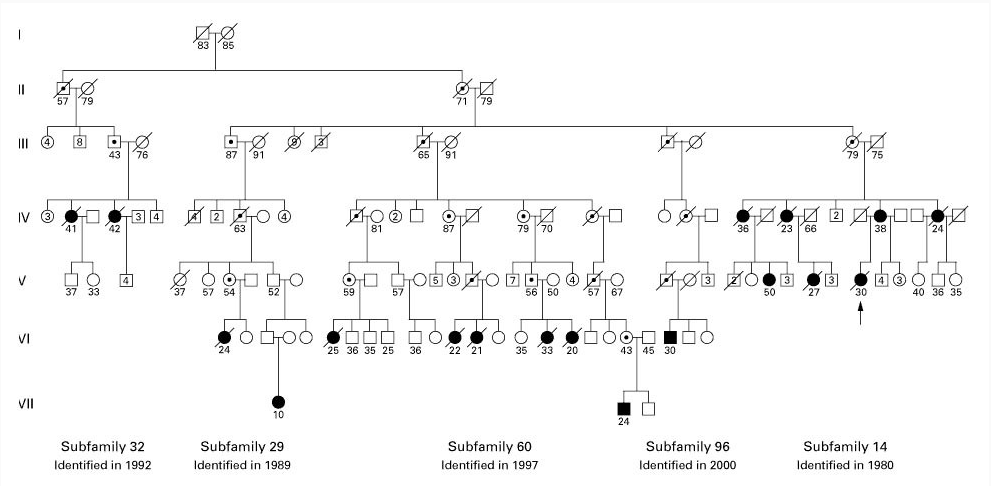
基于基因突变的PAH病因学研究,荆志成教授等专家学者首先从遗传学入手,2002年首次报道了中国遗传性PAH家系的临床特征,发现中国家族性PAH患者存在BMPR2基因突变。
随后,2003年,在国家“十五”攻关重大专项支持下,荆志成教授团队在国内率先开展PAH临床队列组建和生物样本收集与保护工作。对“我国重大疾病遗传资源收集保护和利用”这一子课题进行研究。
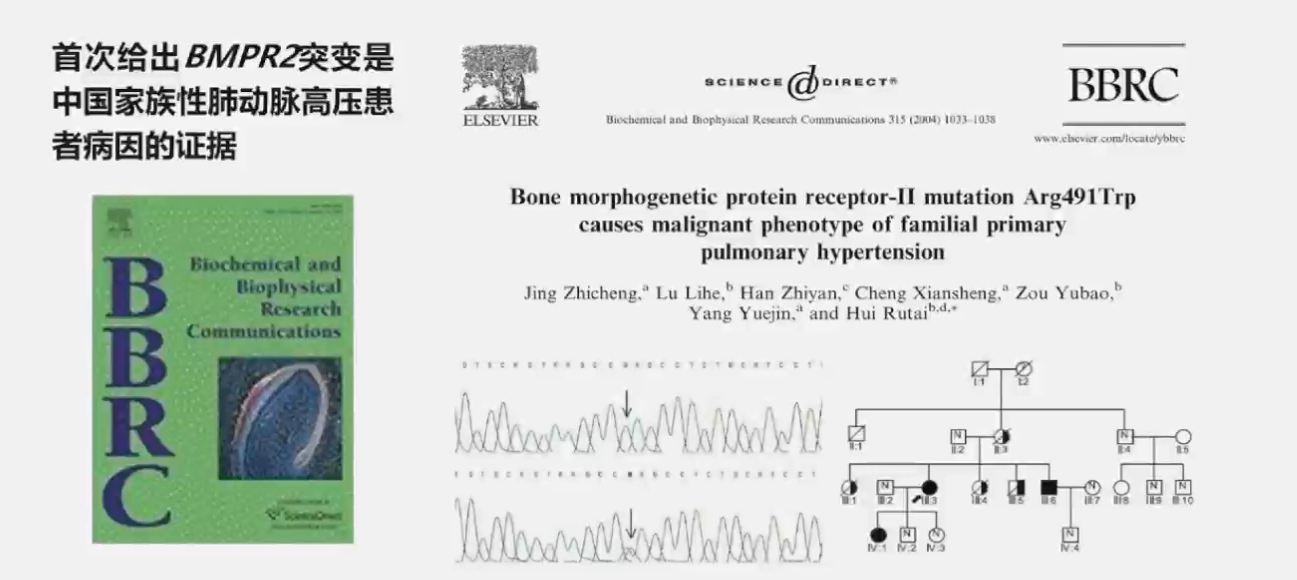
2004年,荆志成教授团队发表论文,首次报道了中国家族性PAH的遗传缺陷,首次给出BMPR2突变是中国家族性PAH患者病因的证据。
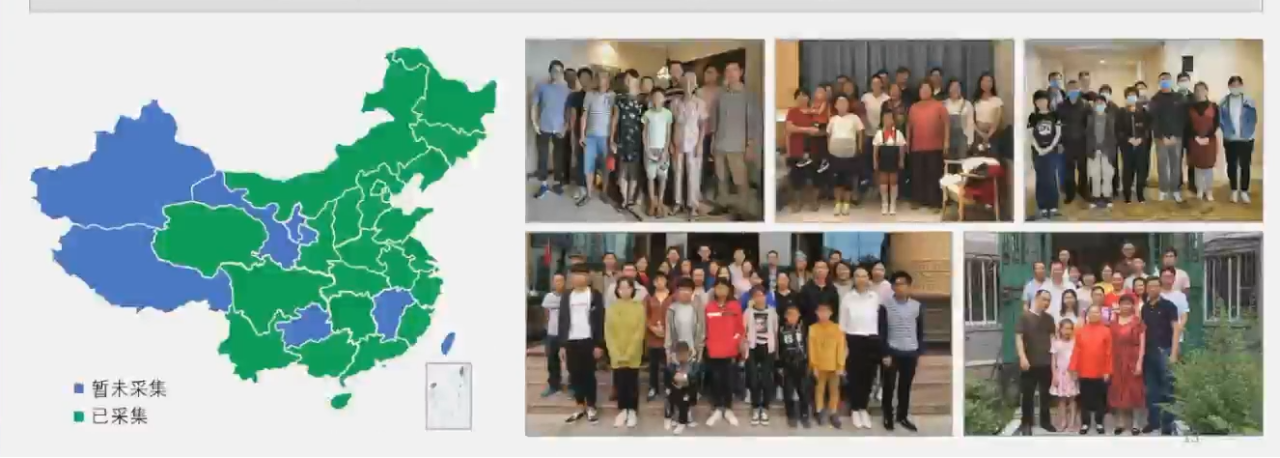
为实现国人PAH家系资源收集保护,荆志成教授项目团队走访全国25个以上省市自治区,长期在全国范围收集保护珍贵的PAH家系遗传资源,现已保存PAH相关家系超130例。
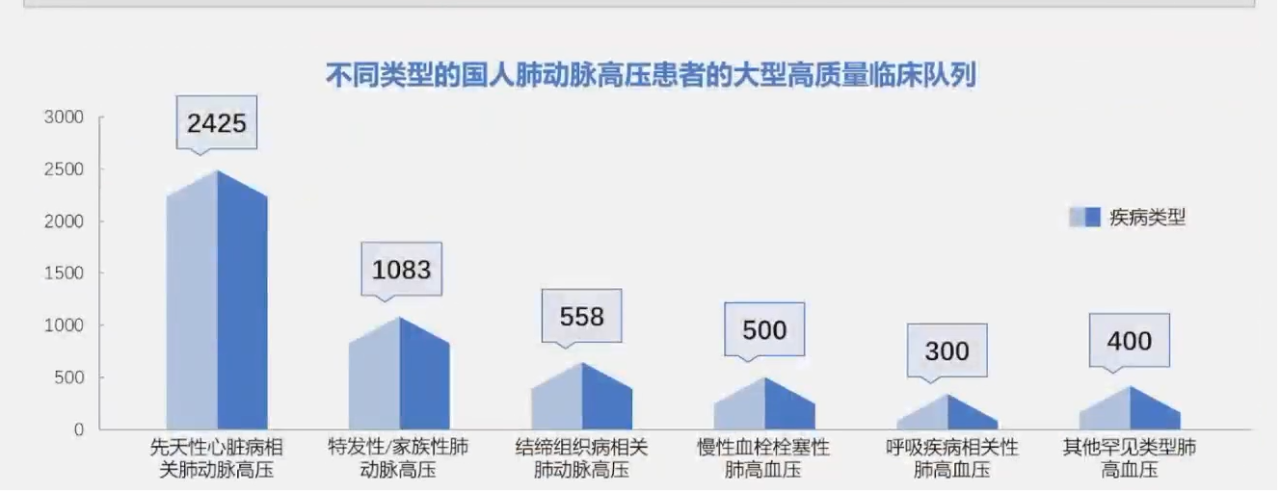
同时,针对不同类型的国人PAH患者,荆志成教授团队构建了类型全面、诊断准确、随访规范的中国PAH患者临床队列,现入组各种类型的PAH患者病例超过5000例,已建成国际最有影响力PAH患者队列之一。
并且荆志成教授团队依托国家级医学研究中心,建立全链条、全维度、高质量的生物样本银行。系统采集血清、血浆、核酸、iPSCs、永生化淋巴细胞、活检组织、消化道微生物等多样生物样本。血浆血清生物样本采集达34.5万份。

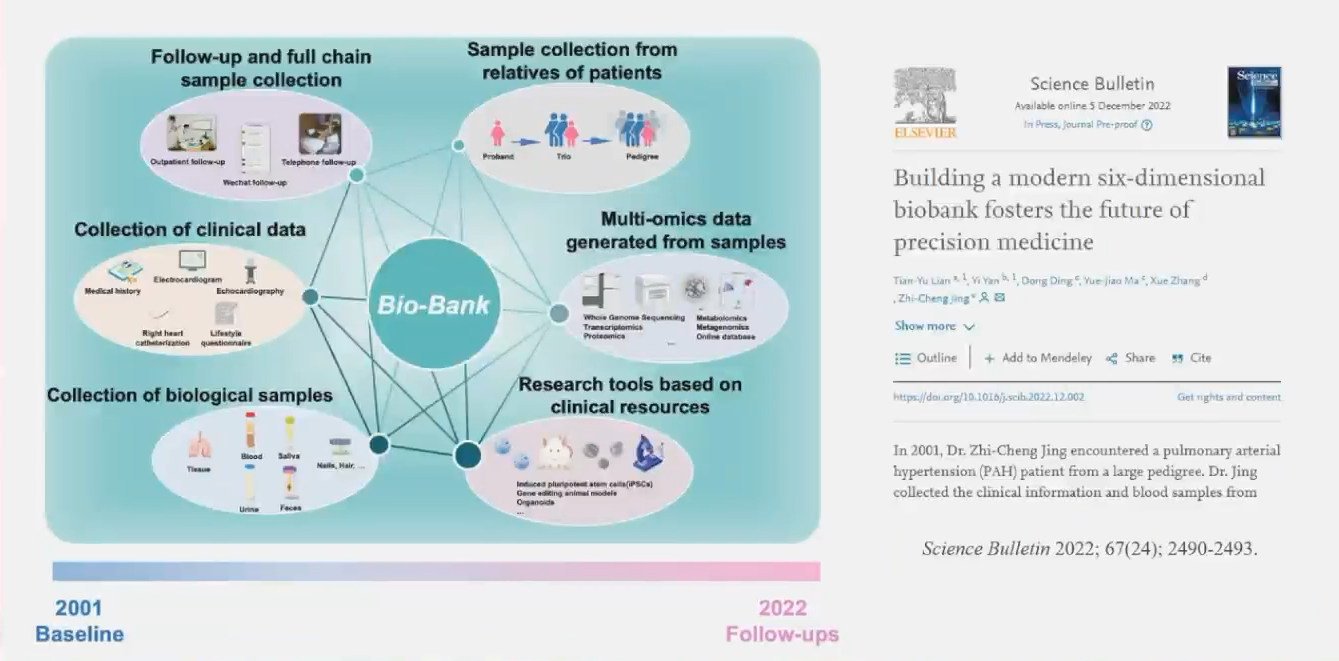
2007年,荆志成教授团队完成中国第一个家族性PAH注册研究,首次报告了中国特发性和家族性PAH患者流行病学数据。在此基础上,研究团队持续探索关联深度,2012年完成了中国PAH患者BMPR2突变谱的初步筛查,发现14.5%的特发性以及53.5%的家族性PAH患者均携带BMPR2突变。随后报道BMPR2基因突变严重影响患者的临床表型及预后,携带基因突变的患者总体死亡风险比不携带突变的患者高2倍。
2016年其团队参与全球多中心研究,整合了大样本BMPR2突变对PAH临床表型的原始数据的系统分析,进一步明确了在全球范围内BMPR2突变携带者较非携带者平均诊断年龄早7年,临床表型更差,死亡风险更高;年龄对BMPR2突变携带者的临床表型有显著影响,相对于年龄较大的患者,携带BMPR2基因突变的年轻患者预后更差。
2018年荆志成教授团队发现新的PAH致病基因BMP9。BMP9突变可解释6.7%特发性PAH患者病因,使PAH发病风险上升21.2倍(2.67×10-19),致病性仅次于BMPR2突变。
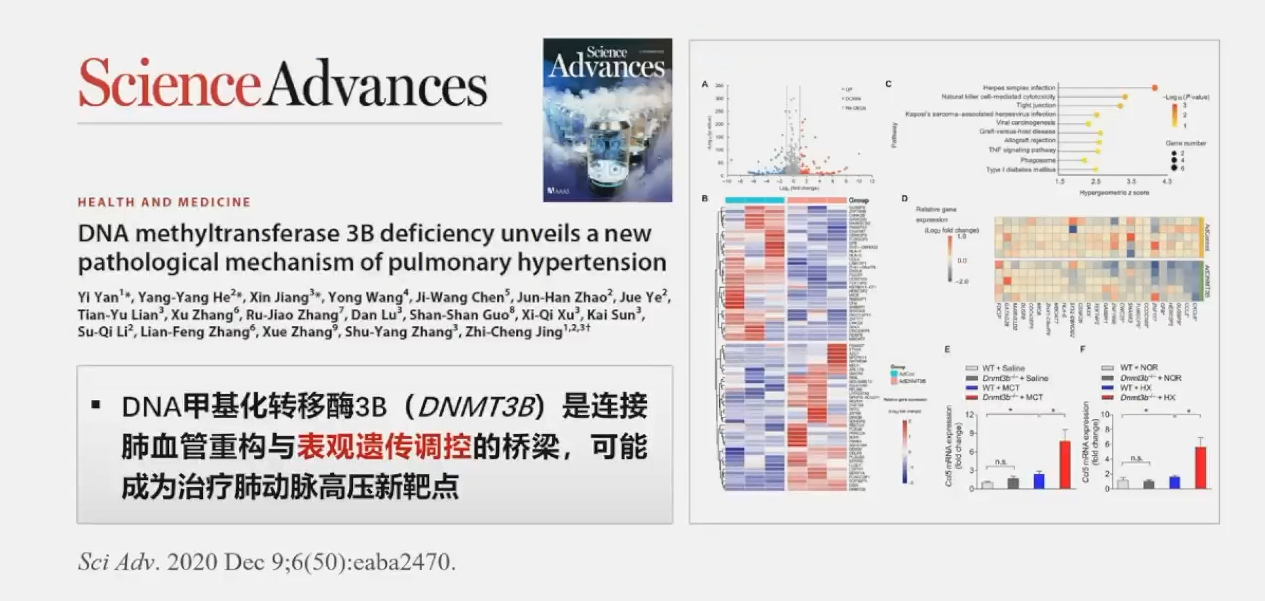
2020年荆志成教授团队发表DNMT3B是PAH保护性靶点以及PAH新致病基因PTGIS相关文章,这两项重大突破分别在Sci Adv.和JAMA发表。

研究新发现
随着遗传学研究的深入,对很多其他类型的PAH病因有了新的认识。既往认为先天性心脏病(先心病)合并PAH多为继发性,肺动脉血压升高由先天性心脏缺损所导致。2016年的一项研究中,从临床研究队列中入选了294例先心病合并PAH患者,161例先心病无PAH患者,检测了所有入选者BMPR2基因的突变情况,首次发现中国先心病相关PAH中,7.5%的患者携带BMPR2突变,在先心病术后出现PAH的患者中,BMPR2基因突变比例高达12.6%,提示相当数量的先心病合并PAH患者PAH表型由基因突变引起,属于原发性PAH。
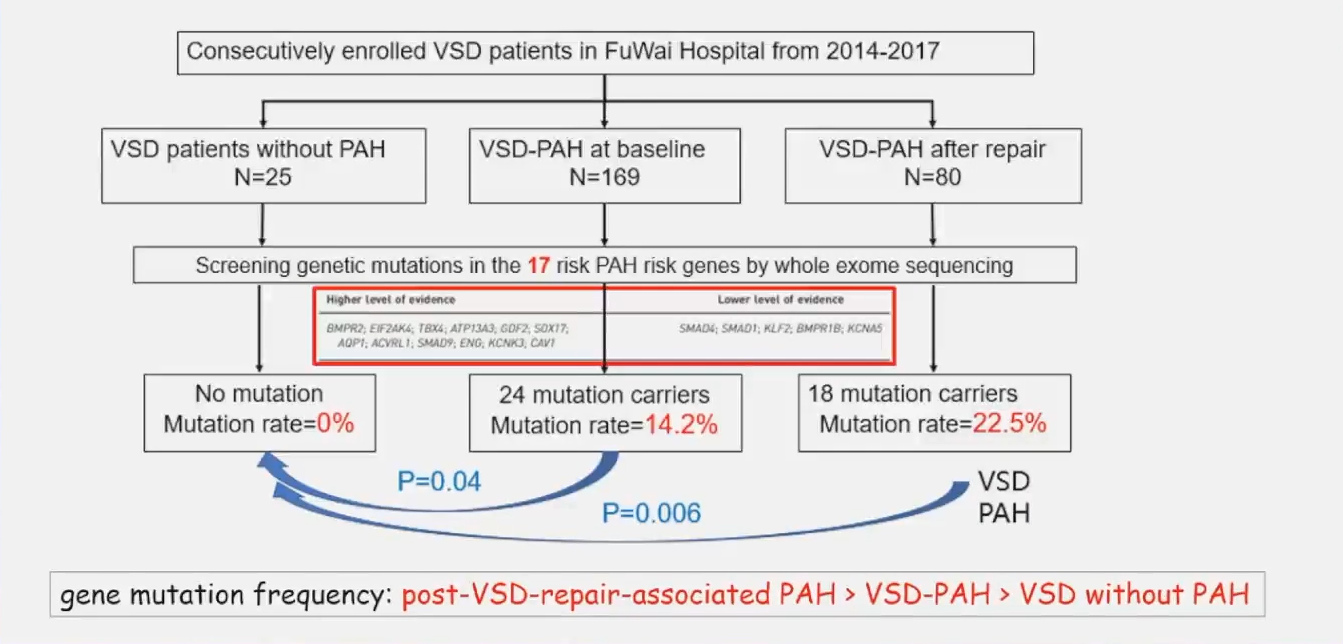
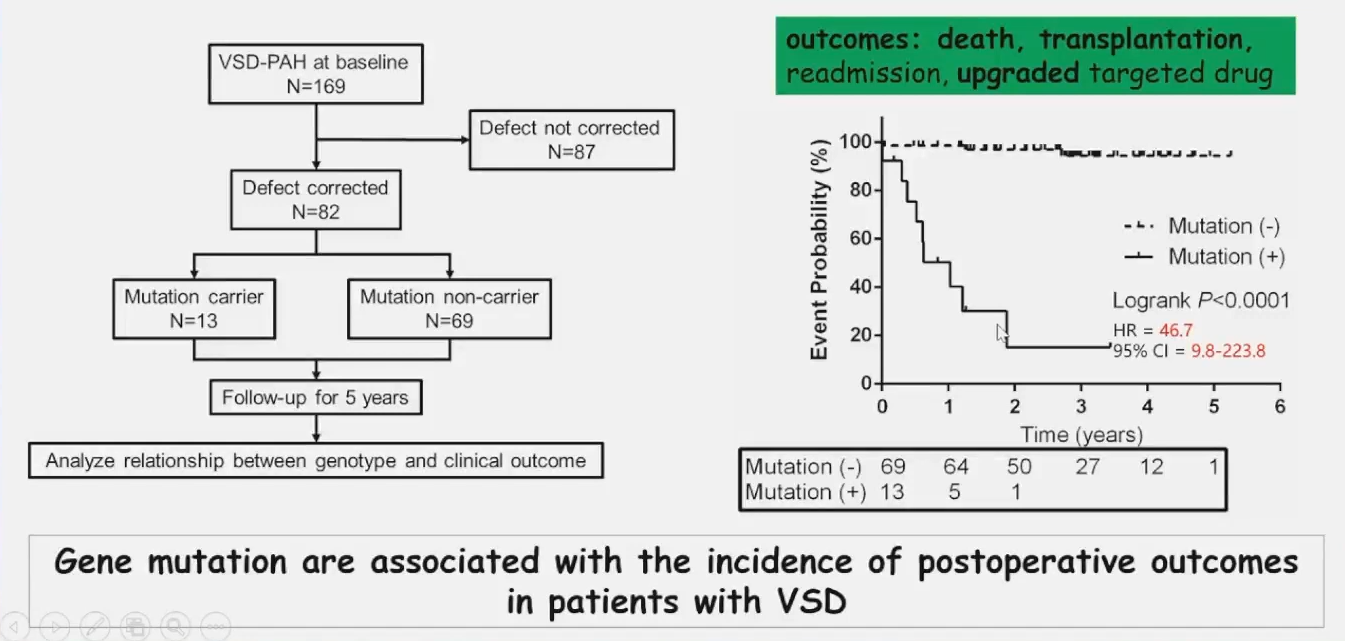
2014-2017年间荆志成教授团队在阜外医院陆续入组登记VSD患者,发现携带PAH基因突变的患者室间隔术后效果差,不携带任何已知PAH致病基因患者术后预后效果最好。
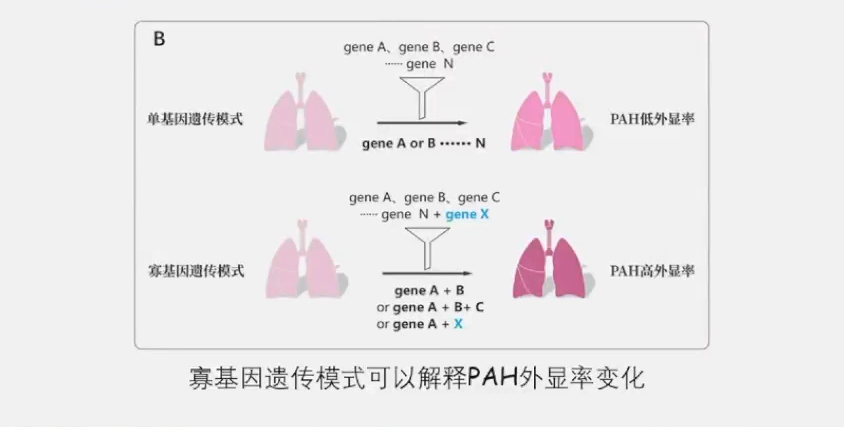
过去常从单基因角度分析PAH病情,然而近年却发现了新的遗传特征,先证者携带双重杂合突变而发病,父母携带单基因相同变异而未发病,据此可以推测,PAH并非单基因决定突变决定,少数多个基因突变存在协同效应并加重了病情,符合寡基因遗传模式。对此,荆志成教授团队提出科学假说:国人PAH患者可能存在寡基因遗传模式,大量目前诊断为单基因突变的患者极有可能存在尚未被发现的修饰基因X,而多基因突变叠加协同才是PAH发病的核心机制。

新药研发进展
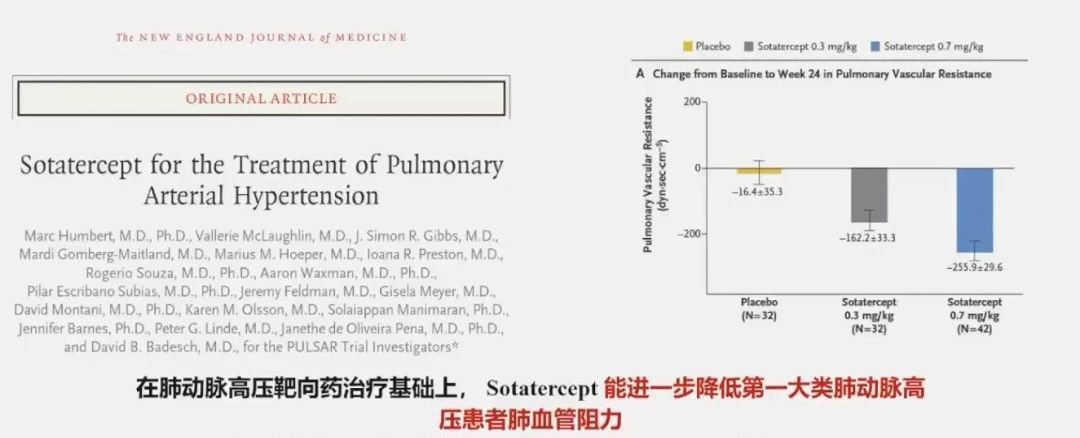
新药研发和PAH遗传学关系紧密,Sotatercept(一种新型的融合蛋白,可捕获参与PAH的激活素和生长分化因子)的成功研发引发了生物制剂热潮。
2021年,一项评估Sotatercept的多中心、随机、双盲2期临床试验(PULSAR)达到了降低肺血管阻力的主要终点,研究结果已发表于《新英格兰医学杂志》。试验的主要终点是肺血管阻力从基线到第24周的变化,次要终点是6分钟步行距离。入组患者的基线特征相似,经过24周的试验,结果显示:与安慰剂组相比,Sotatercept治疗组的肺血管阻力有明显的下降;在Sotatercept治疗组中,0.7mg/kg组比0.3mg/kg组肺血管阻力下降得更多。在PAH靶向药治疗基础上,Sotatercept能进一步降低第一大类PAH患者肺血管阻力。
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动