杨成明教授:左室辅助装置在右心衰中的应用

心源性休克(CS)是一种危及生命的循环衰竭,尽管近年来治疗方面取得了显著进展,但其死亡率仍然居高不下,发病率不断上升,CS依然是亟需深入研究的重要临床挑战。近期在第九届西北心血管病大会暨第五届心血管创新与转化研讨会(NWCC 2024)上,陆军军医大学陆军特色医学中心(大坪医院)杨成明教授带来题为《左室辅助装置在右心衰中的应用》精彩讲座,医谱学术特此整理,以供临床参考。
CS流行病学
引发CS的原因多种多样,既包括急性心肌梗死(AMI)所致的机械功能和结构异常,也包括其他导致急性和慢性心力衰竭(HF)的病因。虽然大量科学文献评估了AMI与CS之间的关系,探讨了其发病机制、治疗方法及预后,但对其他病因的研究相对较少。尤其是右心衰竭(RHF)导致CS的机制,迄今为止未受到足够的重视,深入评估更为有限。
CS合并RHF仅占CS患者的5%,根据最新数据显示,RHF的发病率呈上升趋势。此外,许多RHF病例源于左心室(LV)功能障碍,进一步增加了其整体患病率。
准确估计RHF的发病率较为困难,因为以右心室(RV)为主的HF在多种疾病状态中是常见的最终结果,右心功能不全(RVD)的实际发病率可能被低估。据分析,在某些心力衰竭亚型中,RVD出现在高达50%的患者中,而通过心脏磁共振(CMR)成像评估得出的发病率约为19%。
CS通常以LV功能障碍为主,占大多数病例,但RV损伤导致的CS恶化速度更快,较LV功能障碍更早达到血流动力学衰竭,且短期死亡率更高。然而,RV具备更强的短期恢复潜力,因此及时、适当的治疗对于患者的康复至关重要。
RV血流动力学和解剖学特征
RV对压力变化的高度敏感性源于其独特的结构特性。RV具有高顺应性和低阻力的肺循环,这使其能够更好地适应容量变化而非压力变化。
事实上,虽然RV输出量接近于左侧,但实际上的心肌能量需求大约是左侧的五分之一。据研究,肺血管阻力不到全身血管阻力的十分之一,这解释了RV的功能较温和,也解释了当压力突然变化时RV的易损性。
此外,RV的血流动力学循环与左侧不同,缺少等容期。并且从压力上升到RV开始射出的等容收缩阶段很难定义。这意味着,就压力与体积的关系而言,RV实际上缺乏明确的等容舒张时间。
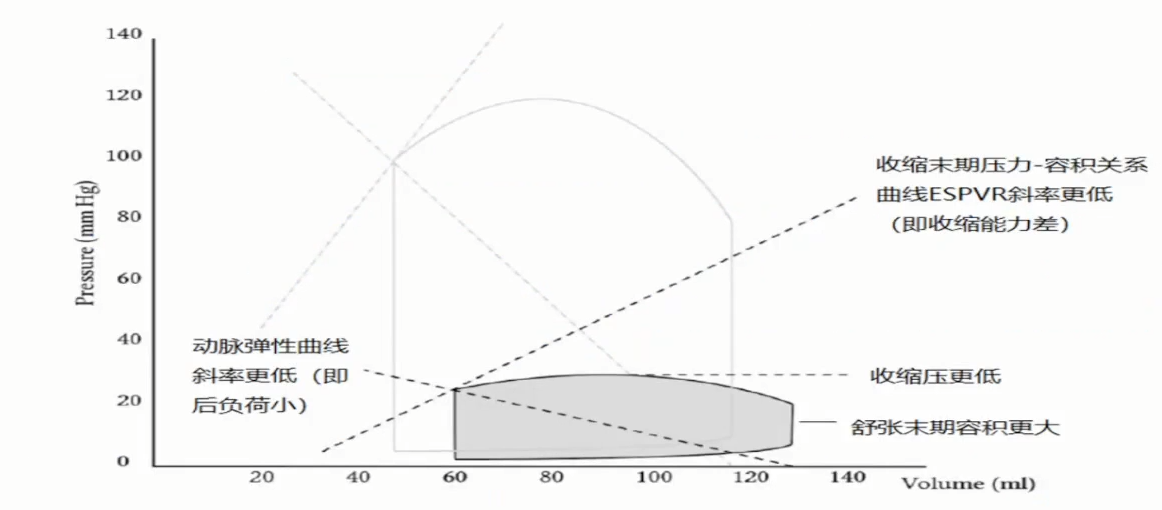
比较LV(透明)和RV(灰色)的压力-容量曲线
与LV曲线呈正方形相比,RV的PV曲线更像三角形。尽管如此,瞬时压力与容量的关系与在不同生理范围的LV一样是线性的。
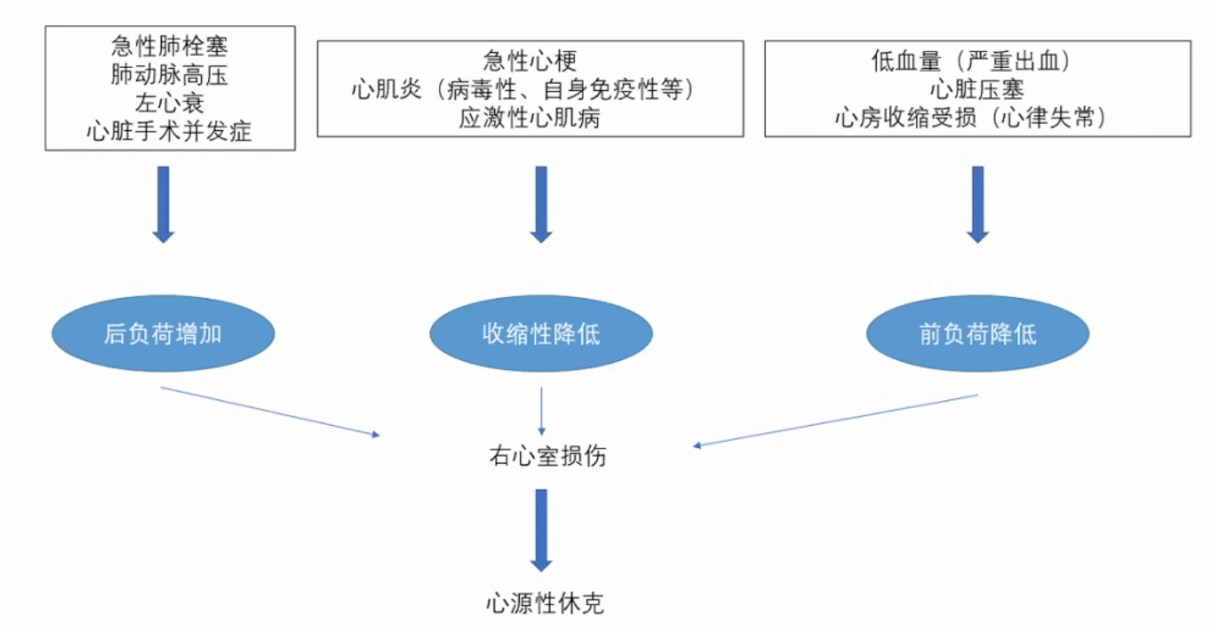
导致RV损伤和随后的CS的病因及其生理变化示意图
RHF的诊断和治疗
RHF的诊断基于心脏受损的程度,主要通过以下指标进行评估:中心静脉压(CVP)、肺毛细血管楔压(PCWP)、肺动脉搏动压力指数(PAPi),即肺动脉收缩压与舒张压之差除以右心房压;此外,右室每搏做功指数(RVSWI),计算公式为0.0136×每搏量指数(SVI)×(平均肺动脉压-平均右心房压)。这些指标为评估RV功能提供了重要依据。

RHF的诊断标准
另一个标准是机械辅助循环支持的跨机构登记系统(INTERMACS)标准。INTERMACS定义的RHF基于两个参数:CVP升高和有CVP升高的持续的RVF症状表现。
直接测量CVP或右房压>16mmHg、下腔静脉显著扩张且超声心动图未见吸气变异可证实为CVP升高。CVP升高可表现为在直立患者中,颈静脉扩张至颈部中段以上、周围性水肿(>2+,新发或未消退)、腹水或体检或诊断性成像发现肝肿大,也可表现为肝功能恶化(总胆红素水平升高)或肾功能不全。
总体而言,CS的诊断是一个多方面依赖的过程,需要结合临床症状、体格检查、血流动力学和超声心动图多因素进行评估。
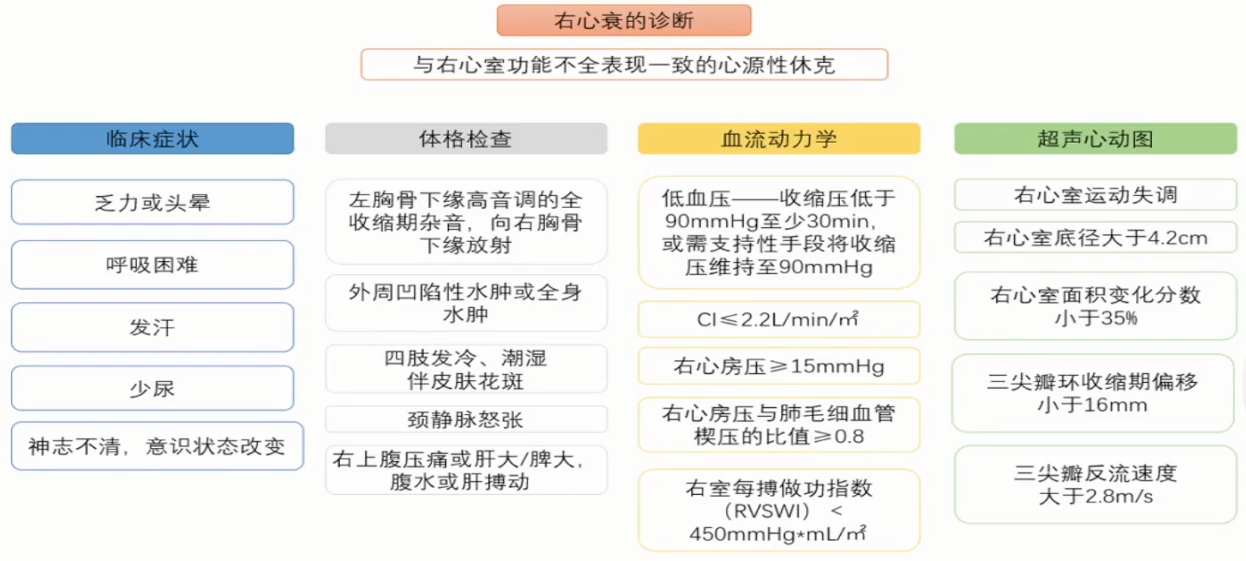
右心衰致CS的诊断特点
CS的治疗方法需根据休克的病因进行调整。如有可能,应优先直接治疗可逆的病因。治疗方案应以血流动力学评估为指导,确保与假定的病理生理学一致。在难治性休克的情况下,可能需要采用机械支持装置进行侵入性干预。
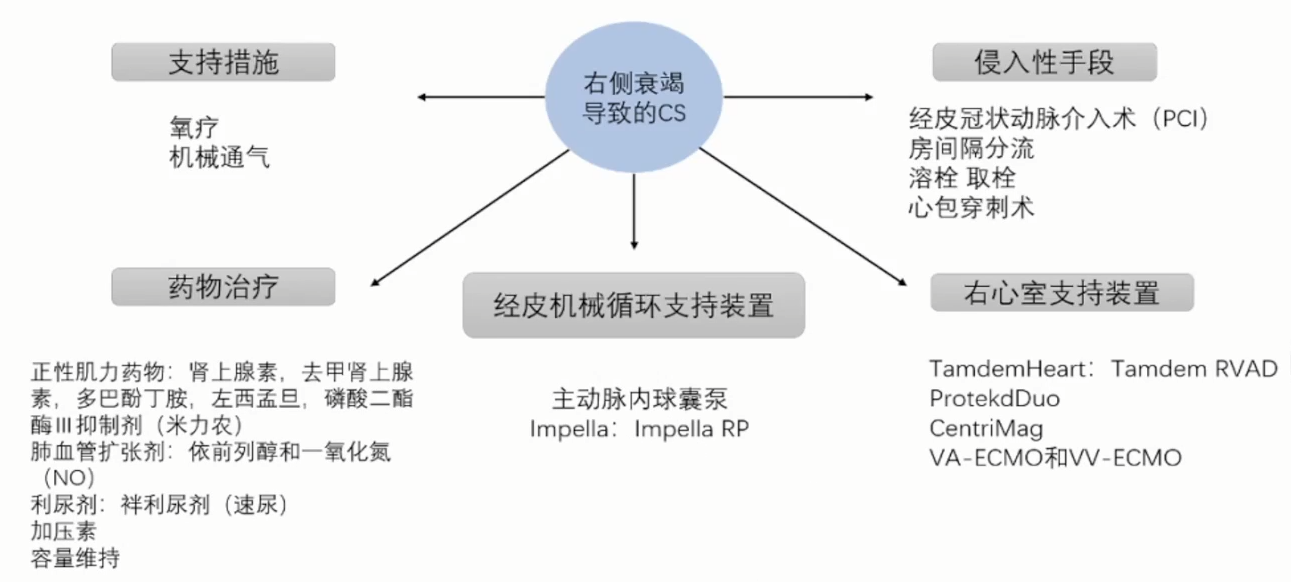
机械循环支持装置(MCS)
在非侵入性治疗不足以满足需求的情况下,早期MCS应被视为预防多脏器或双心室衰竭的重要措施。在急性情况下使用临时MCS,可以实现稳定过渡,并为最终的程序或干预提供时间,特别是在当前似乎不适合手术的情况下。根据不同的干预,这一时期可称为“支持的桥梁”、“移植的桥梁”或理想状态下的“康复的桥梁”,意指心脏的恢复和后续成功脱机的可能性。
MCS可以根据不同维度进行分类:
1.使用时长:分为短期和长期装置。短期MCS主要用于高危经皮冠状动脉介入治疗、AMI后并发症、各种CS、心脏骤停后的复苏、以及外科术后无法脱离体外循环支持或早期心室功能衰竭的情况。长期MCS则日益作为移植的桥梁、决策的桥梁或终末疗法使用。
2.临床应用场景:分为双心室辅助装置(BiVAD)、左心室辅助装置(LVAD)、右心室辅助装置(RVAD)和全人工心脏(TAH)。
3.使用方式:分为植入式、体外式和经皮介入式。
4.运作原理:分为搏动式和旋转式(离心或轴流)装置。
主动脉内球囊反搏(IABP)
IABP是一种广泛应用于左心衰竭患者的机械装置。由于RV的形状和结构,其收缩和舒张功能依赖于左心的功能,RV的收缩压和心输出量约有20%至40%取决于左心的收缩作用。
在严重的RHF时,室间隔向LV偏移,导致左心充盈压下降,从而加剧RHF的进展。通过使用IABP改善左心功能,可以同时促进左心和右心的改善,其机制在于减少容量和压力过载对左心的影响,从而降低右心的后负荷。
因此,在LV搏动性差且伴随RHF的情况下,IABP可能成为有效的左心减压治疗手段。
Impella
Impella RP是一种RVAD,其工作原理与其他Impella设备相同。该装置通过一个23F鞘管经股静脉置入肺动脉,入口位于下腔静脉或右心房,出口则位于肺动脉,能够将血液直接从下腔静脉或右心房输送至肺动脉循环。Impella RP已获得紧急使用授权,专门用于治疗与新型冠状病毒感染相关的RHF,包括肺栓塞患者。
2015年,RECOVER RIGHT试验前瞻性研究了12例AMI和18例心脏手术后患者使用Impella RP装置治疗难治性RHF的效果。结果显示,Impella RP启动后CVP和心脏指数即刻改善,能够撤离强心药及升压药。尽管该试验未观察到对临床结果的直接影响,但Impella RP患者的30天(或出院)生存率约为73.3%,出院患者的生存时间超过180天,最常见的不良事件为出血和溶血。
通过排空LV和降低上游肺动脉压力,Impella RP也可用于右心支持。在联合VA-ECMO时,能够降低右心房压、减少左室容积并缓解肺水肿。一项小型研究表明,与仅接受VA-ECMO的患者相比,联合使用Impella的患者住院死亡率显著降低(47% vs. 80%,p<0.001)。因此,为了使左心和右心均受益,建议在VA-ECMO过程中联用SmartAssist Impella RP装置。
ECMO
ECMO对右心的直接支持作用较小,但通过减轻右心压力和向冠状动脉输送充分氧合的血液,可以提供有效的间接支持。此外,ECMO对全身的氧合和循环均有积极作用,为患者从急性右心损伤中恢复争取了时间。例如,在严重肺栓塞引起的急性RHF情况下,VA-ECMO可以为患者提供支持,直至能够进行切开取栓术。
VV-ECMO通过下腔静脉引流血液,并将氧合后的血液经右颈内静脉回输至右心。此方法适合使用双腔导管进行右颈内静脉插管。
VA-ECMO同样从下腔静脉引流血液,但将氧合的血液通过股动脉逆行回输到主动脉。需要注意的是,实际插管位置可能会有所不同。
VAV-ECMO则通过增加一个第三个插管位置,以解决VV-ECMO或VA-ECMO未能充分解决的问题。它从下腔静脉引流血液,分别回输至动脉系统提供心脏支持,并向静脉系统提供更大的呼吸支持。
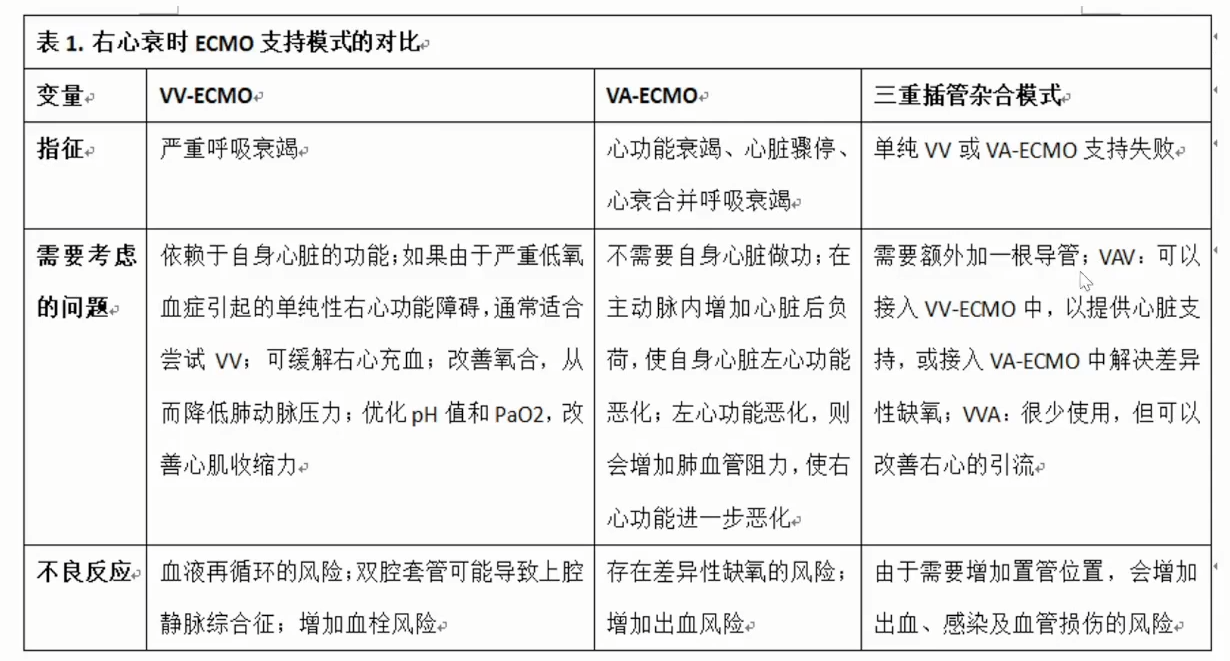
右心衰时ECMO支持模式的对比
TandemHeart RVAD
使用体外离心泵及两个静脉管道,将血液从右心房输送至主肺动脉。第一个21F流入管放置在右心房,第二个21F流出管插入主肺动脉。大多数TH-RVAD置管通过两侧股静脉通路进行,流出端经右股静脉植入主肺动脉,流入端则经左股静脉植入右心房。
对于躯干较长的患者(股静脉到第五肋间的距离超过58 cm),流出端可通过右侧颈内静脉插入主肺动脉。这一方法适用于股静脉通路受限的情况,如感染、血栓形成或下腔静脉滤过器。使用右颈内入路时,流出端通过右颈内静脉放置于主肺动脉,而流入端则通过股静脉插入右心房。
此外,可以将Protek Duo双腔管与TandemHeart泵联合使用,一个管腔作为流入端放置在右心房,另一个管腔作为流出端放置在主肺动脉,并可接入氧合器进行体外氧合。
ProtekDuo RVAD
ProtekDuo RVAD的设计与Impella RP不同,是一种双腔经皮RV辅助装置,能够将血液从右心房引流至肺动脉,并连接到外部离心泵。该系统支持高达5 L/min的血流量,且可与氧合器结合用于ECMO。
ProtekDuo提供两种尺寸(29F和31F),通常通过右颈内静脉插入,从右心房引流并将血液回输至肺动脉。该装置需与体外离心泵结合使用,目前可连接的体外离心泵包括TandemHeart(LivaNova)和CentriMag(Abbott)等。但当前该装置尚缺乏大型临床试验证据,仍需进一步评估。
小结
RVD引起的CS是心血管并发症和死亡率的主要原因之一。与因左心功能不全引起的CS相比,目前针对右心功能不全的研究相对较少。多种病因可导致RVD,并可能进一步恶化为CS,其治疗在很大程度上依赖于MCS。
随着RHF发生率的增加,预计未来几年这一领域需要进一步的研究。研究应评估现有的治疗方案和管理模式,探讨相关机制,并开发更具表型特异性的降低RHF发病率和死亡率的新方法与新设备。
文中图片均来自授课幻灯
本文为医谱学术原创文章,转载请标注来源
撰写/袁一田;审校/刘丽娜
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动