赵冬冬教授:不同治疗方法对LAAC术后残余分流的优势
随着研究证据的不断积累,左心耳封堵术(LAAC)已成为非瓣膜性房颤患者预防卒中的有效策略。但对这项正值“青春”的技术而言,不免有些“懵懂”之处需要进一步探索研究,封堵器植入术后残余分流(PDL)就是其中之一。在近日举行的“第七届中国结构周2023”上,上海市第十人民医院赵冬冬教授对“不同治疗方法对LAAC术后残余分流的优势”作出讲解,医谱学术特将精彩内容整理成文,供临床医生参考。
PDL的基本概念和观点
LAAC后PDL普遍存在,目前业界对于显著PDL的定义并不统一,这加大了PDL判定和治疗的困难,也从侧面体现出学界对于PDL认识的不足。
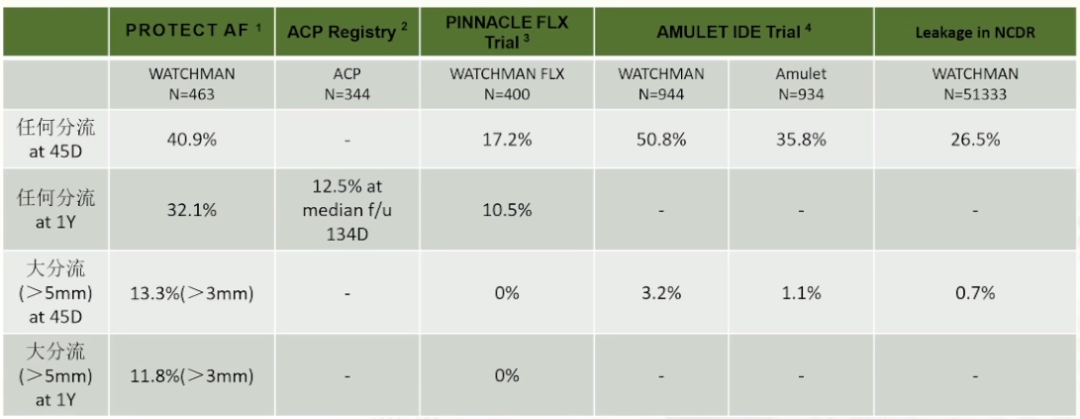 不同研究中PDL的发生比例
不同研究中PDL的发生比例
PDL产生的原因与左心耳的解剖结构与封堵器有关。首先,左心耳的形状千奇百怪,心房的解剖结构也可能发生变异;其次,尽管封堵器械在不断改良,但PDL仍然是LAAC手术中经常遇到的问题。
在评估方面,食道心脏超声(TEE)仍然是LAAC术后最经典的随访工具,目前欧美指南均推荐TEE成像至少需要3个切面(0-30°、60-90°及120°-180°)。6-9点位 (TEE135°)的PDL检出率较高。此外,Korsholm教授前后发表的两篇文章都发现,CT对PDL的检出更为敏感。透视造影评估下的封堵不可信,可能是假象。
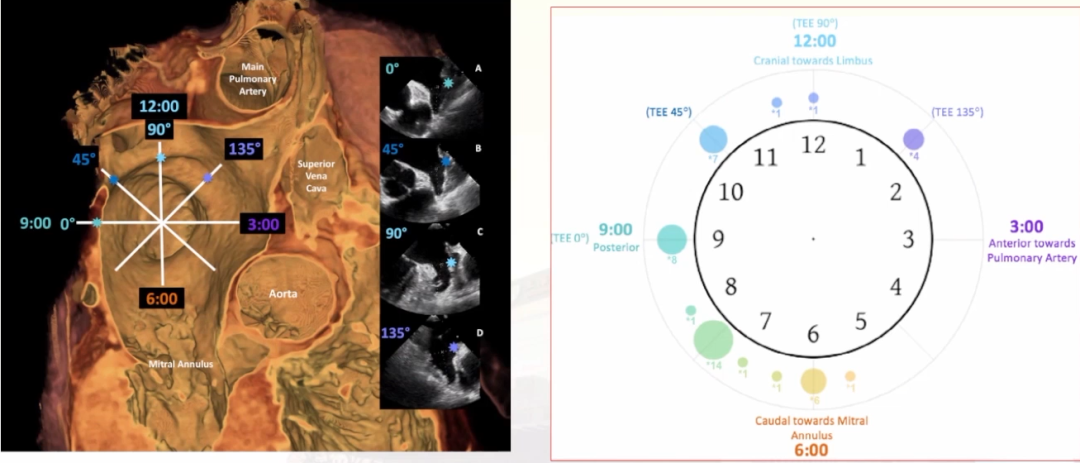
6-9点位(TEE135°)的PDL检出率较高
形成PDL的影响因素
左心耳形态
左心耳口部形态,无论是长轴还是短轴,都具有不规则性,从而导致既往研究中,无论是外科结扎,还是经皮介入封堵器械WATCHMAN、Amulet/ACP、LARIAT,均有不同程度的PDL。有研究显示,椭圆口心耳占比68.9%,而常见封堵器以圆形为主,几何上的不匹配可能导致PDL[1]。
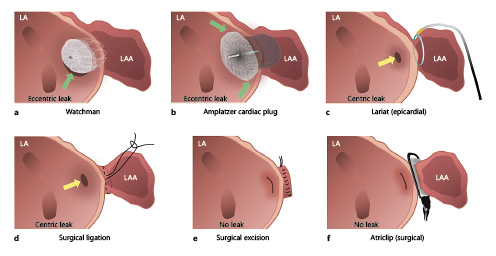
LAA封闭后PDL示意图
不同器械
赵冬冬教授表示,不同时间嵴的变化也和PDL有关。在行一站式术时,将植入的器械远离水肿区可减少PDL的发生,但器械植入过深是否会进一步引发其他不良事件的发生还有待探索。
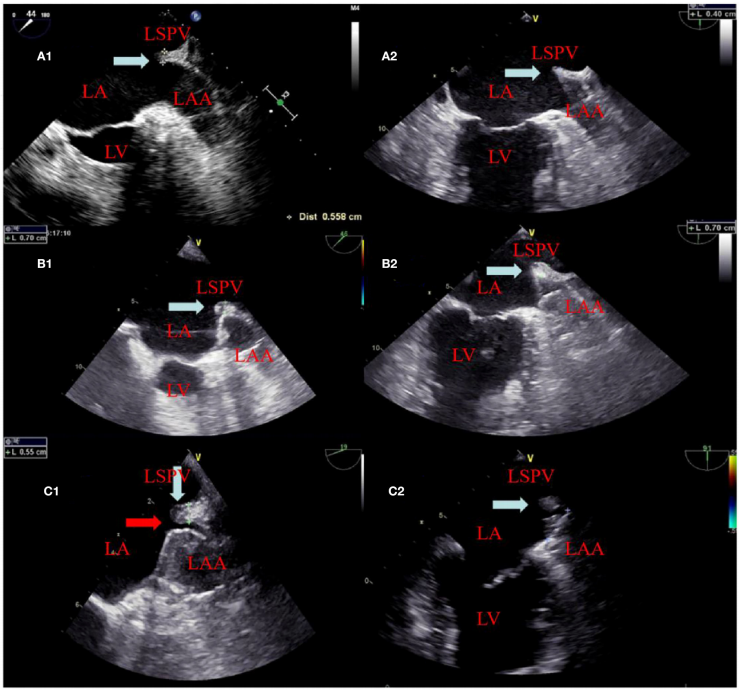
不同时间嵴的变化和残留泄漏[2]
(A1、A2):消融前左心耳和左上肺静脉之间的嵴;
(B1、B2):封堵后设备的位置分别靠近和远离嵴水肿区;
(C1):TEE显示嵴水肿消失,并有2mm的残留泄漏;
(C2):TEE显示嵴水肿消失,对封堵无影响。
赵冬冬教授团队在对冷冻消融联合LAAC一站式的临床研究[3]中发现:塞式封堵器WATCHMAN的PDL(4例,3.7%,1.7mm,2.1mm,1.6mm,0.9mm)均发生在心耳下缘;盘式封堵器(2例,2.2%,4.2mm,2.5mm)发现上缘肺静脉处水肿消失,外盘移位导致上缘PDL。消融后发现,水肿的存在和消退会影响盘式封堵器对左心耳口部的测量,对塞式封堵器影响较小。嵴部水肿下,盘式封堵器的选取与操作主要有三要素:1)适当选择大一号的尺寸;2)固定盘尽量放于深处;3)封堵盘有一定拉力,形成倒酒杯状。
另有研究[4]纳入82例单中心一站式病例(WATCHMAN封堵器),其中52例先封堵后射频,30例先射频后封堵,随访11.2±7.3月,结果发现,先封堵后消融组,术后新发PDL的比例更低(7.7% vs 26.7%,P=0.019),故对于采用塞式封堵器(如WATCHMAN)的联合策略,建议先封堵后消融。
还有研究[5]纳入117名患者,植入ACP/Amulet (83例)或WATCHMAN(34例),PDL的患者基线数据显示,其LVEF值降低、有较大的左房容积、非鸡翅型左心耳、着陆区直径较大。从器械选择上看:ACP/Amulet的PDL主要发生于分叶与封堵盘之间存在较大角度的患者中,但ACP/Amulet PDL的发生率(43%)相比WATCHMAN(47%)更低。
一项纳入1878名患者的研究[6]显示,PDL的机制包括器械偏离轴向、未完全封堵的分叶、器械偏离原位置。从器械上看:偏离轴向或漏叶是每个封堵器的主要PDL因素。左心耳尺寸过大(包括开口直径、着陆区直径和深度),使用WATCHMAN封堵器往往预示严重的PDL,而Amulet封堵器没有明显的解剖限制。
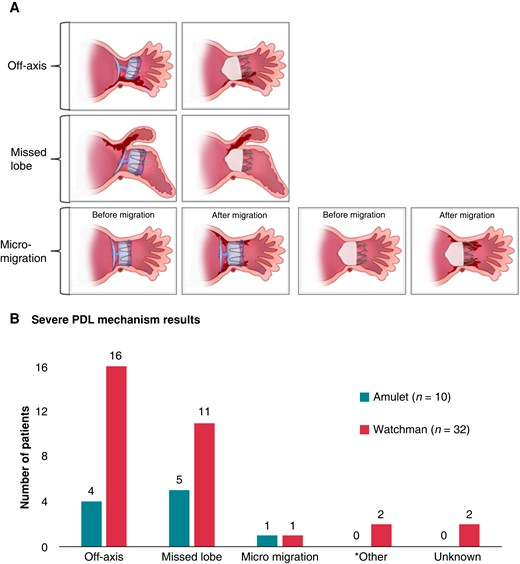
(A)LAAC后严重PDL最常见的机制
(B)试验期间,Amulet封堵器和WATCHMAN装置在PDL不同分类中的患者人数
一项单中心回顾性研究[7]纳入48例长程持续性房颤(LSPAF)患者和53例非LSPAF患者,结果发现,两组患者的PDL发生率从植入到6周随访期间均有所增加。其中,LSPAF组术后PDL发生率更高,尤其是<5mm的PDL,发生率显著增高。可能导致PDL的因素包括植入后左房左心耳重构、器械尺寸过小、左心耳自身解剖原因。
从临床实践看PDL的处理与预后
PDL重在预防,WATCHMAN压缩比设为8%-30%,而非最初推荐的8%-20%,可能有助于降低PDL的发生。不过,较大的压缩比可能导致延迟心包积液,所以临床应在权衡利弊后作出合理选择。
如出现大PDL,可采取特殊的处理方法,比如有研究显示,弹簧圈封堵后PDL可减小。不过,赵冬冬教授也指出,PDL其实是三维概念,目前补救方式不易,第一次术中力争完美最为重要。
有研究[8]指出,PDL会随着时间延长而逐渐减小,但将分流界限定在3mm后,仍能发现显著区别:在45~90天的TEE随访中,<3 mm组的平均PDL为2.2+0.8 mm,该组的PDL在275±125天后显著降低到1.6±1.4mm(P=0.002);而在>3 mm组中,208±137天后PDL无显著变化(4.9±1.4 mm vs 4.0±3.0 mm,P=0.12)。另一研究[9]指出,植入盘式封堵器的患者,1年随访时PDL的发生率从12%下降到9%,而塞式封堵器患者的这一比例从28%下降到22%,双盘式封堵器在术后45天和1年均比塞式具有更优越的闭合性。
PDL与装置表面血栓(DRT)
PDL形成的血液流入心耳的入口,导致血液在此残腔停滞或形成湍流,可能致使血小板在心耳内或者器械边缘聚集,从而形成DRT[10]。研究[11]发现,封堵器距离肺静脉缘<5mm的DRT事件显著低于>5mm(2.3% vs 12.2%,p <0.001)。
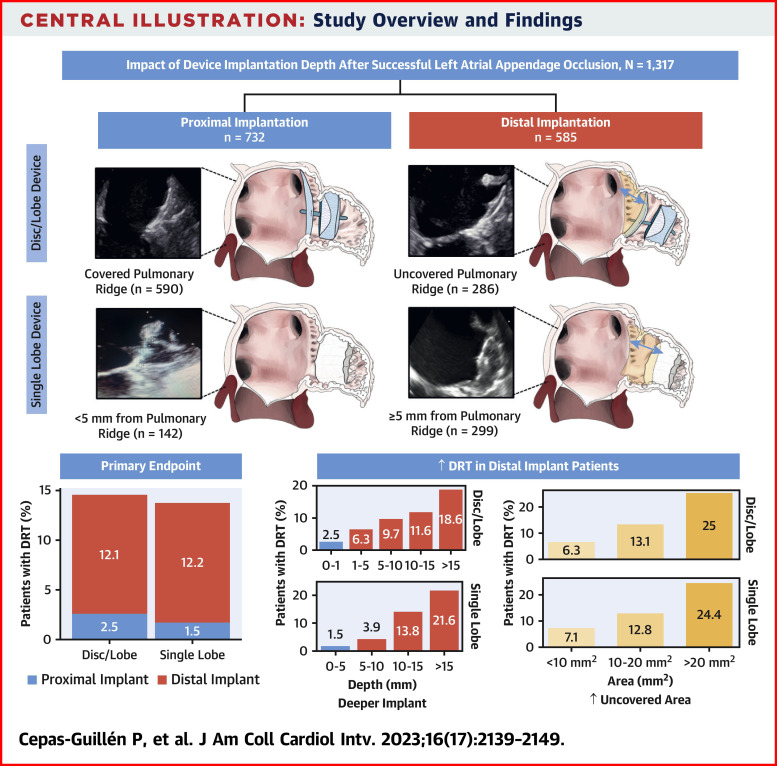
PDL与内皮化
一项纳入46名患者的研究[12]中,TEE检测到58.6%(27名)的患者存在PDL,导致内皮化不全;使用CT检测结果显示,28名患者内皮化不全,其中64%(18名)存在PDL,致使内皮化延迟。另有研究[13]发现,术后9个月,左心耳近70%的病例仍然具有渗透性。残留渗透性的原因有两方面:1)以血管周围渗漏为代表的附着缺陷;2)不完全内皮化,可由PDL导致。
PDL与栓塞事件
研究[14]发现,有PDL的患者与无PDL的患者,其初级有效终点无显著差异,PDL的存在与否或其严重程度与卒中和全身栓塞的复合栓塞终点之间也没有显著的统计学关系,不过由于事件发生率过低,可能影响检验水准。
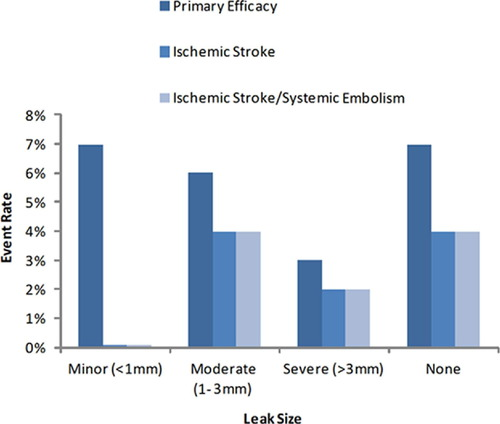
按PDL严重程度划分的主要疗效终点比率
一项发表于2015年的研究[15]分析了外科手术干预左心耳不同程度全身性栓塞(SSE)事件的发生率。研究共纳入72名患者,结果显示完全切除与左心耳结扎不完全患者SSE事件发生率分别为2%和24%,说明左心耳处理不全形成残余漏是SSE事件的危险因素。
赵冬冬教授表示,PDL越大,通常预示着栓塞风险越大,而<5mm的PDL与无PDL的患者,栓塞风险无显著差异。
PDL与临床结局
2022年发表的一项研究[16]证实:
PDL总体事件发生率低:无论是缺血性卒中还是复合终点上,无分流、小分流、大分流患者的累计发生率都非常低,其中小分流的患者发生率高于无分流与大分流患者;
PDL与临床结局相关:在主要终点方面,小分流患者发生率高于无分流患者,存在统计学差异。大分流患者发生率虽然高于无分流的患者,但是无统计学差异。
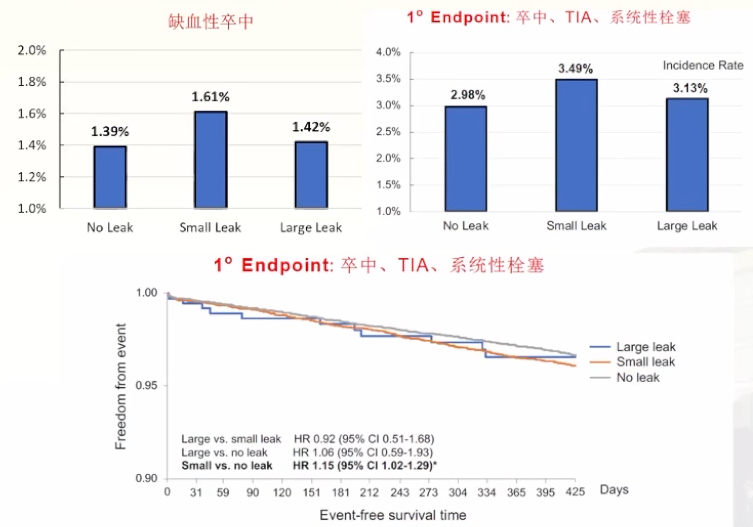
虽然该观察性研究无法推导PDL与事件之间的因果关系,但临床仍应警惕PDL的发生,关注患者随访,使患者获益最大化。
总 结
1 不同的治疗手段都可能产生PDL,通过内科手术进行心耳封堵后,CT可能是更好的检测手段。
2分析产生PDL的因素可发现,避免PDL的最佳方法是:
▪ 在术前仔细、系统地分析左心耳形态学,选择最合适的器械类型和尺寸;
▪ 在植入过程中,应注意确保器械的同轴性,以便能够更好地适应左心耳的解剖结构;
▪ 采用更精细的评估手段,比如ICE等,在术中做好避免产生PDL的工作。
3 较小的PDL会随时间的推移减小,而较大的PDL随着时间的推移不会发生变化。
4 大样本量研究发现,PDL与临床结局呈正相关,但总体事件发生率较低,应该加强患者随访。
5 对于PDL的处理,可继续OAC。弹簧圈封堵,或者其他器械封堵,目前尚无统一观点,应考虑在个体化的基础上进行。
本文图片引自幻灯


- End -
关注我们
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。

发表留言
暂无留言
输入您的留言参与专家互动