宋杰教授:冠状动脉钙化病变的器械和策略选择

冠状动脉钙化通常伴有血管扭曲变形,导致介入治疗过程中器械难以顺利通过,因其处理策略与钙化的严重程度密切相关,故正确识别和评估钙化病变并选择合适的介入治疗,对提高手术成功率、减少并发症和改善预后至关重要。在2024年第九届西北心血管病大会暨第五届心血管创新与转化研讨会上(NWCC 2024),南京大学医学院附属鼓楼医院的宋杰教授重点介绍了冠状动脉钙化病变的器械和策略选择。医谱学术特此整理,以供临床参考。
钙化病变的流行病学
流行病学数据显示,冠状动脉钙化的发生率随年龄增加显著上升,在40~49岁人群中的发生率为50%,而在60~69岁人群中则上升至80%。随着冠状动脉狭窄程度的加重,钙化发生的概率也随之增加。高龄、脂质代谢异常、糖尿病、甲状旁腺功能亢进、慢性肾脏病、连续性肾脏替代治疗、高钙血症及既往行冠状动脉旁路移植术(CABG)的患者,是冠状动脉钙化病变的高危人群。
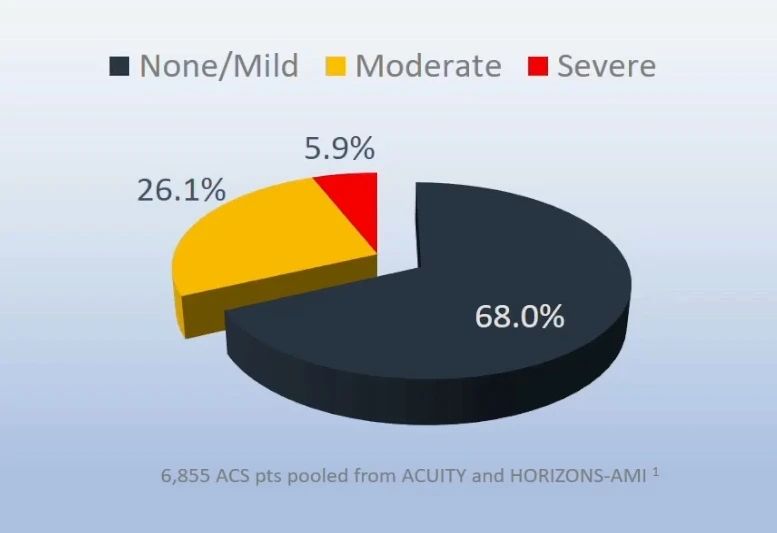
在包括ACUITY和HORIZONS-AMI研究的6855例患者中,中重度冠状动脉钙化的发生率为32%,其中5.9%为重度钙化病变。此外,钙化结节是一种特殊类型的钙化,是易损斑块的特定表现形式,占所有易损斑块的4.2%~7.9%。
钙化病变治疗难点
钙化病变通常伴有血管成角和扭曲,并且对血管扩张反应较差,这大大增加了介入治疗中相关器械通过的难度,同时提高了经皮冠状动脉介入治疗(PCI)相关并发症的风险,如器械无法到位、支架脱落、导丝断裂和支架纵向压缩等。由于钙化病变属于高阻力病变,球囊难以充分扩张,甚至可能发生球囊破裂等情况。通常需要更高的压力来扩张钙化病变,这增加了血管夹层、穿孔、破裂和无复流现象的发生概率。在未充分扩张的钙化病变段植入支架时,支架膨胀不全、贴壁不良或支架不规则变形的风险较高,进而导致支架内血栓形成和支架内再狭窄的发生率增加。
冠状动脉钙化病变的影像学诊断方法
临床上常使用冠脉钙化积分(如Agatston积分)来评估钙化的严重程度。该方法的优点是无创,但其特异性相对不足。当Agatston积分>100时,诊断性冠状动脉造影证实冠心病(冠状动脉狭窄>50%)的敏感性为95%,而特异性为79%。
冠状动脉造影对钙化病变的诊断具有较低的敏感性(48%)和较高的特异性(89%),对于严重钙化病变,特异性可达98%。在X线影像上,冠状动脉钙化病变通常表现为沿血管走行的密度不均的高密度影像。然而,该方法的缺点在于无法判断钙化与血管管腔的关系。
根据冠状动脉造影结果,钙化病变的严重程度可分为:
(1)无钙化;
(2)轻度钙化,表现为仅在心脏搏动时可见淡而模糊的高密度阴影,静止时不可见;
(3)中度钙化,在心脏搏动时可见较清晰、易辨认的高密度阴影;
(4)重度钙化,无论心脏是否搏动,均可见到清晰的高密度阴影。
血管内超声(IVUS)指导下的治疗策略
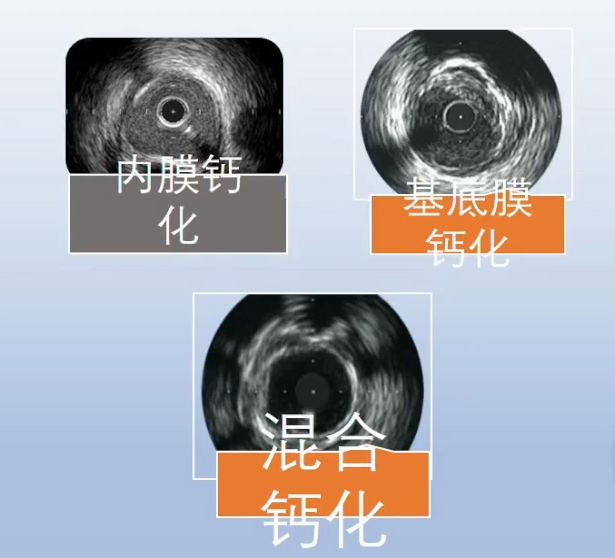
在IVUS中,钙化病变的典型表现为病变表面的明亮白色影像,伴随后方黑色声影,常见多重反射。IVUS对钙化病变的诊断敏感性为90%,特异性为100%。它能够较好地判断钙化病变的位置和范围,帮助制定介入治疗策略。然而,IVUS的局限性在于其无法穿透钙化病变,导致无法定量评估钙化的厚度,从而可能低估钙化病变的深度和斑块负荷。此外,对于严重狭窄或成角的钙化病变,IVUS导管可能无法通过病变进行评估。根据钙化在IVUS图像上血管内壁的分布,钙化病变可分为内膜钙化、基底膜钙化和混合钙化,一般认为基底膜钙化对介入治疗的影响较小。
IVUS根据钙化病变涉及血管腔的范围,将钙化病变分为四个等级:Ⅰ级钙化范围小于90°;Ⅱ级钙化范围在91°~180°之间;Ⅲ级钙化范围在181°~270°之间;IV级钙化范围≥271°。除了评估钙化范围,IVUS检查还能够准确测量钙化病变的长度,为评估冠状动脉病变提供了重要的定量信息。
光学相干断层成像(OCT)
OCT采用近红外光进行成像,通过测量红外光线的回波延迟时间和强度,能够准确描述冠状动脉病变的特征,具有成像速度快、分辨率高的优势,空间分辨率可达10-20mm。OCT在评估冠状动脉斑块方面具有重要价值,其对钙化病变的诊断敏感性为96%,特异性为97%。在OCT图像上,钙化斑块通常表现为低背反射和低衰减,边缘锐利的低信号或不均匀区域。根据钙化斑块的范围和深度等特征,钙化斑块可分为四种类型:
(1)环形钙化,钙化斑块角度超过270°;
(2)点状钙化,钙化角度≤90°且长度<10mm;
(3)深层钙化,钙化斑块距离管腔超过100nm;
(4)浅表钙化,钙化斑块距离管腔65-100nm。
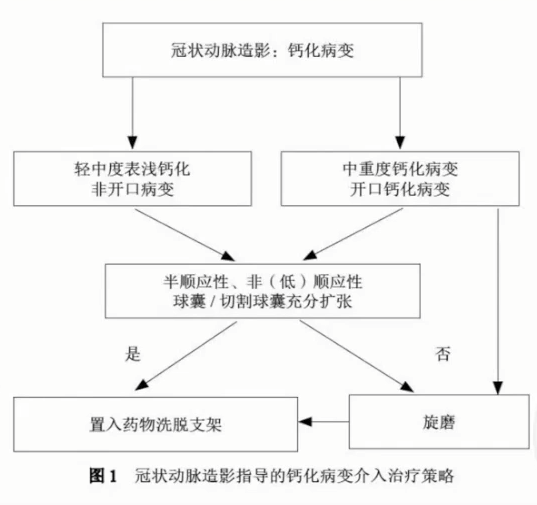
钙化病变处理策略
对于重度钙化病变,具有经验和条件的医师可选择旋磨术进行治疗。旋磨术后,应进行冠状动脉球囊扩张,以充分预扩张血管,这有助于支架的顺利置入,并可改善长期疗效。
旋磨术使用带有橄榄形钻石颗粒的旋磨头,根据“差异切割”理论选择性地去除钙化或纤维化的动脉硬化斑块。该技术的特点是,当旋磨头以高速旋转通过血管时,具有弹性的血管组织会自动弹开,从而避免切割弹性组织和正常冠状动脉,同时对血管中膜无损伤。
在进行旋磨术时,应选择具有良好同轴性的指引导管,并逐步递增磨头的大小。采用慢进快退的操作方法,缩短每次磨头与病变接触的时间,并进行多次旋磨以确保彻底清除钙化斑块。同时,保持稳步的接触性旋磨,以提高效果。此外,使用鸡尾酒配方(药物组合)可进一步优化治疗过程。
病例1
患者为64岁男性,诊断为劳力型心绞痛,伴有高血压病、脂代谢紊乱病史,且有吸烟习惯。心电图显示窦性心律,V2、V3导联呈QS型,T波倒置。血管彩超提示右侧颈内动脉及双侧颈外动脉重度狭窄,左锁骨下动脉起始段重度狭窄,并伴有部分锁骨下动脉盗血。实验室检查结果显示心肌标志物cTnT阴性,低密度脂蛋白胆固醇(LDL-c)为3.89 mmol/L。
LAD闭塞段钙化伴弯曲,入口显示不清晰。
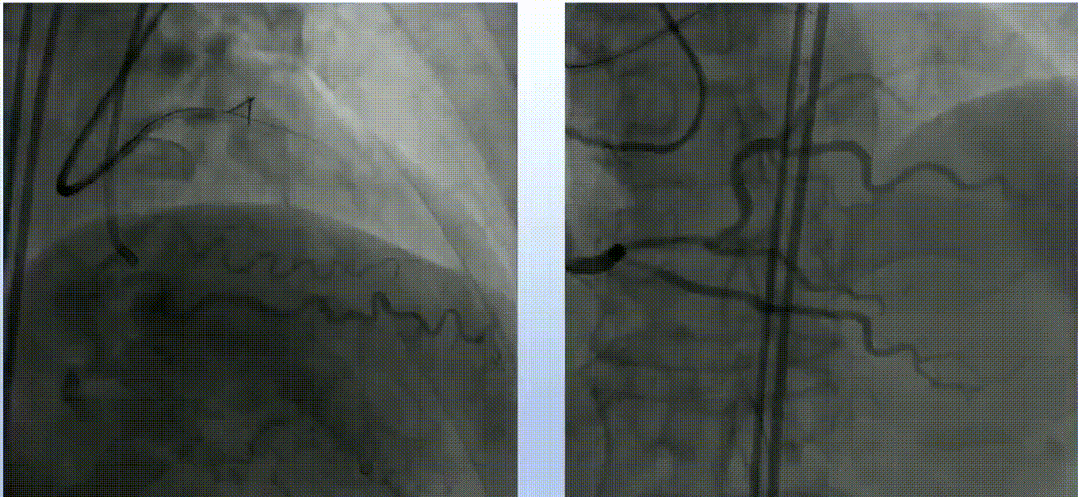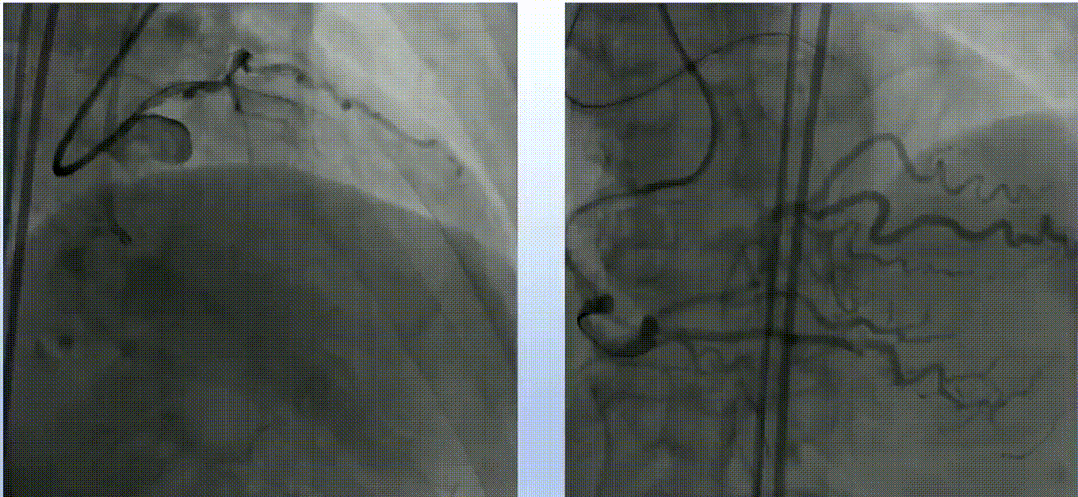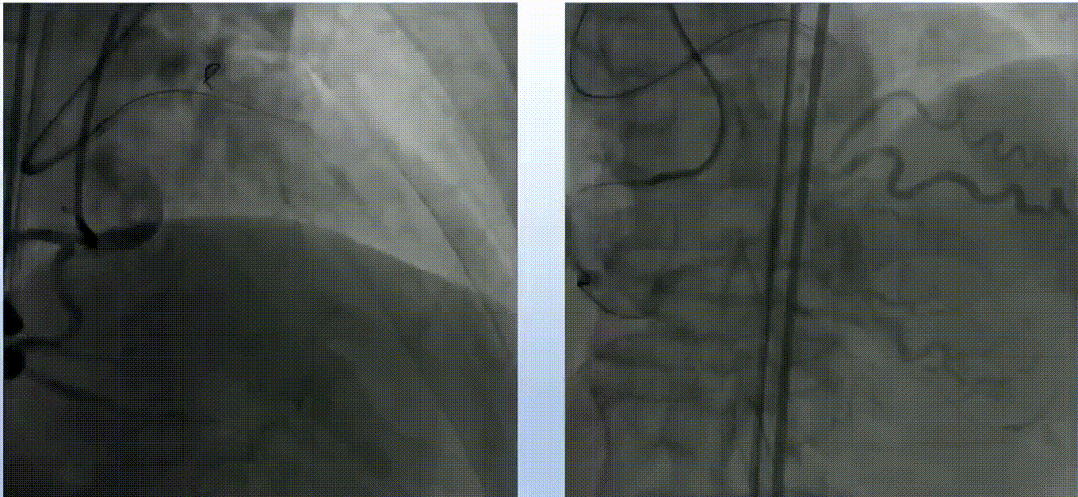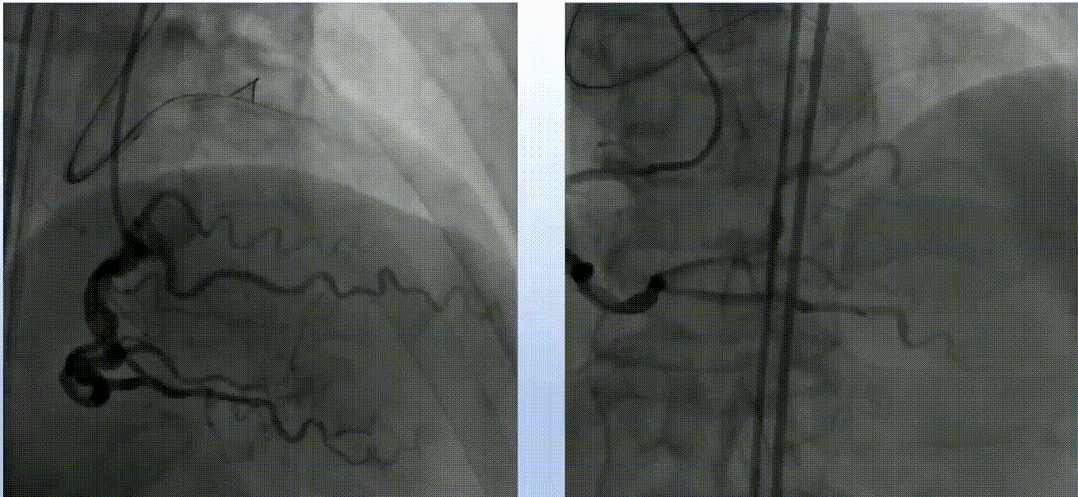
在逆向途径中,使用Corsair和Sion导丝多次尝试,但导丝未能通过间隔支。正向途径采用Finecross搭配Fielder XT、Gaia Second、Conquest Pro导丝反复尝试,导丝均进入假腔。随后更换新的Fielder XT导丝,成功调整导丝进入真腔,并通过远端分支。微导管随之跟进,Tip injection确认导丝位于真腔内。使用1.5mm磨头对LAD钙化病变进行三次高速旋磨,IVUS检查显示弥漫性钙化范围超过180°。旋磨后使用普通球囊进行预扩张,最终串联植入三枚药物洗脱支架,手术结果令人满意。
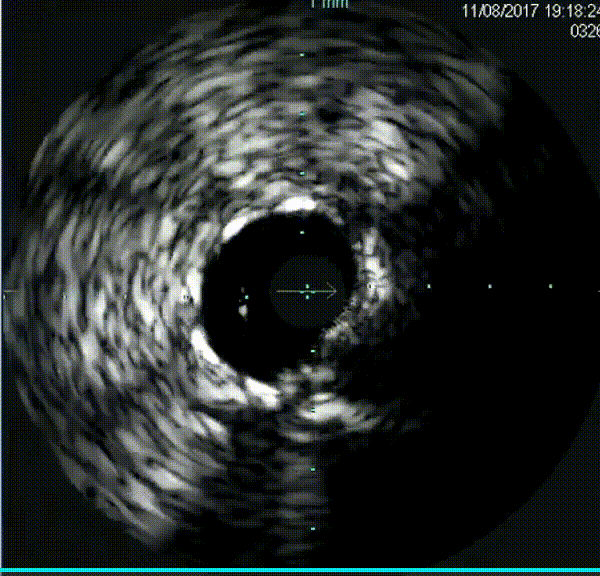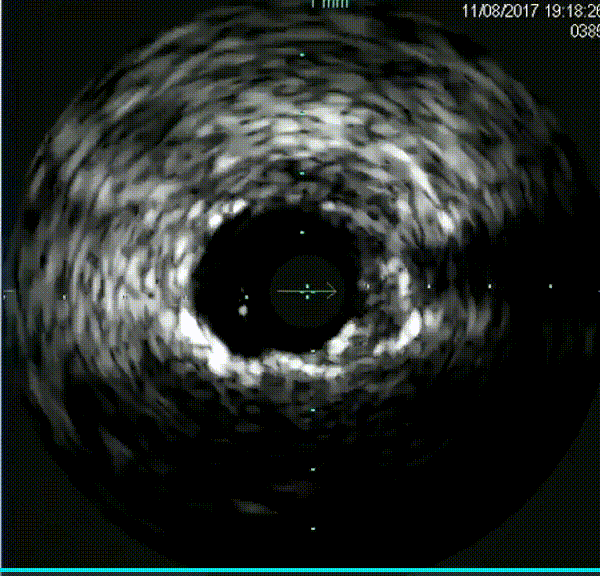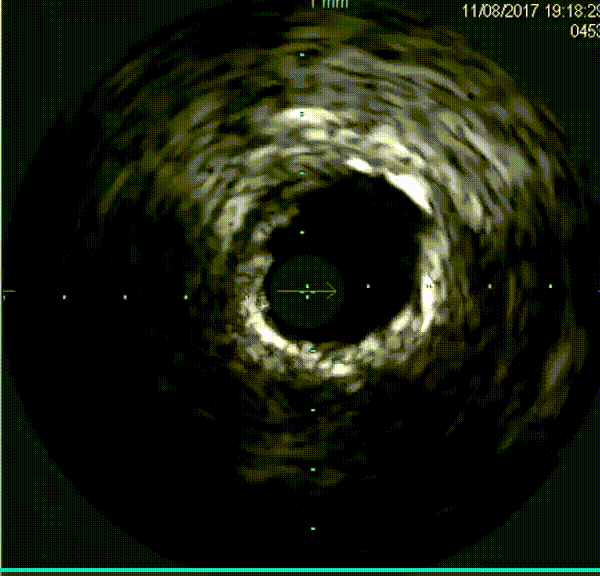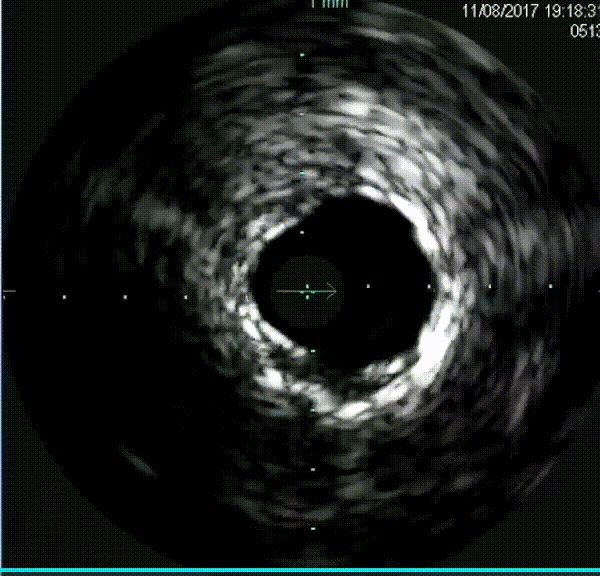
钙化病变预处理器械
准分子激光冠状动脉斑块消蚀术(ELCA)使用氯化氙作为活性介质,释放308 nm波长的紫外线光脉冲(冷激光),主要作用于蛋白质和脂质,而水和血液对激光能量的吸收较少。ELCA通过光化学效应、光热效应和光机械效应对冠状动脉斑块或血栓组织进行消蚀,其穿透深度为0至30微米。该技术最早在1992年获得美国食品和药品监督管理局批准用于冠状动脉病变的介入治疗。ELCA的主要适应证包括支架内再狭窄、静脉桥血管病变、慢性完全闭塞病变、钙化病变、支架膨胀不全、分叉病变以及血栓性病变等。
然而,尽管ELCA对钙化病变有效,但对严重钙化病变的治疗效果较低,更适用于轻度至中度钙化病变。对于严重钙化病变,首选仍然是冠状动脉斑块旋磨术。在旋磨治疗中,如果由于严重钙化病变导致无法实现导丝交换,可先行ELCA以为后续旋磨治疗创造条件(即RASER技术)。
ELCA在冠状动脉钙化病变的治疗中是机械旋磨术(包括常规旋磨和轨道旋磨术)的重要补充,为旋磨不成功的病变提供了新的选择。在机械旋磨术失败后,尤其是在非顺应性球囊或切割/棘突球囊无法充分扩张病变,或者OCT提示钙化角度超过180°、钙化长度超过5毫米或钙化厚度超过0.5毫米的情况下,可以选择ELCA。
病例2
患者为68岁男性,活动后胸痛11年,加重1月,外院造影提示LM严重钙化,重度狭窄。诊断结果为冠心病、恶化性劳力型心绞痛、冠脉支架植入术后、高血压、高脂血症及高尿酸血症。
患者LM中段存在钙化病变,最严重狭窄达80-90%,LAD近段狭窄80%。通过桡动脉入路,使用7F EBU 3.5导管,并采用Runthrough和Sion导丝进行操作。
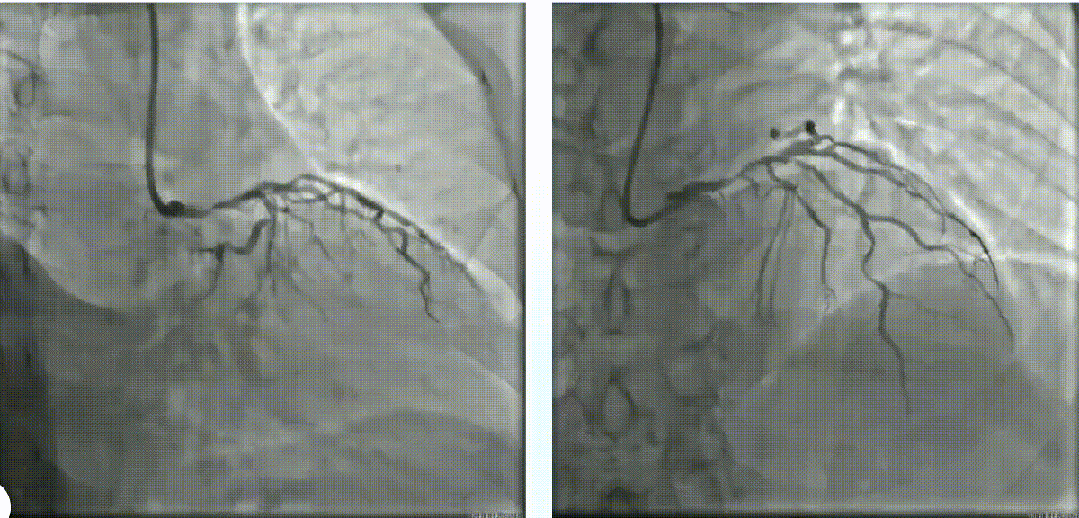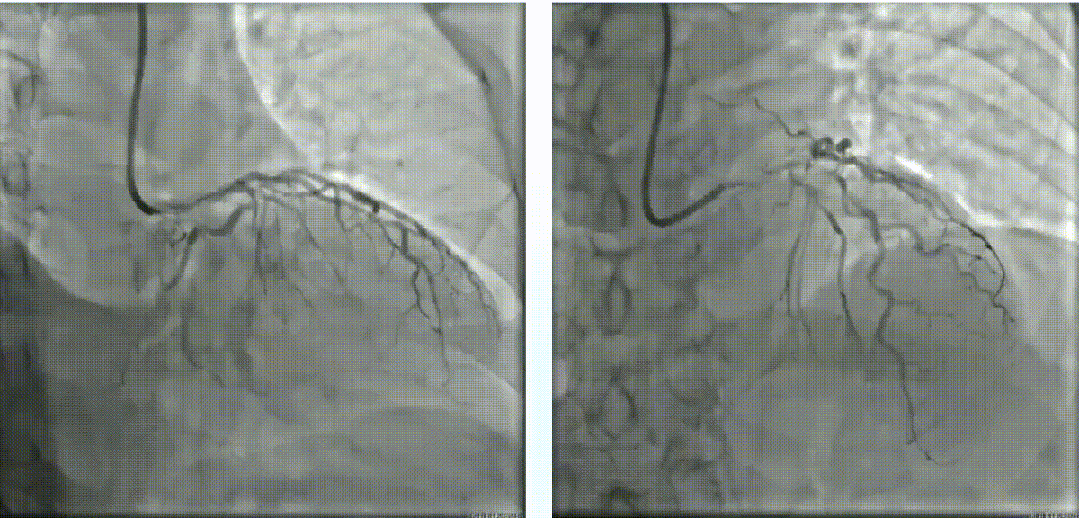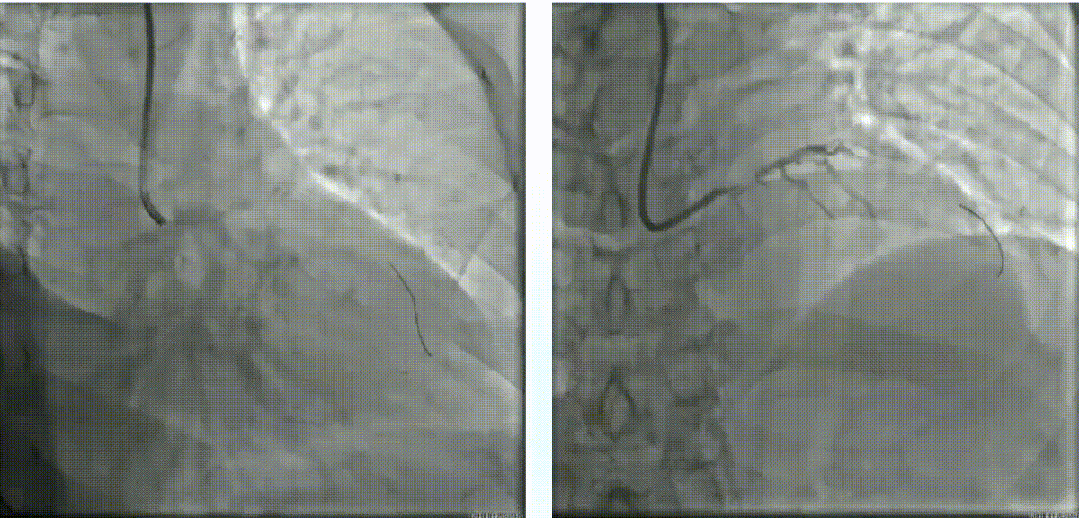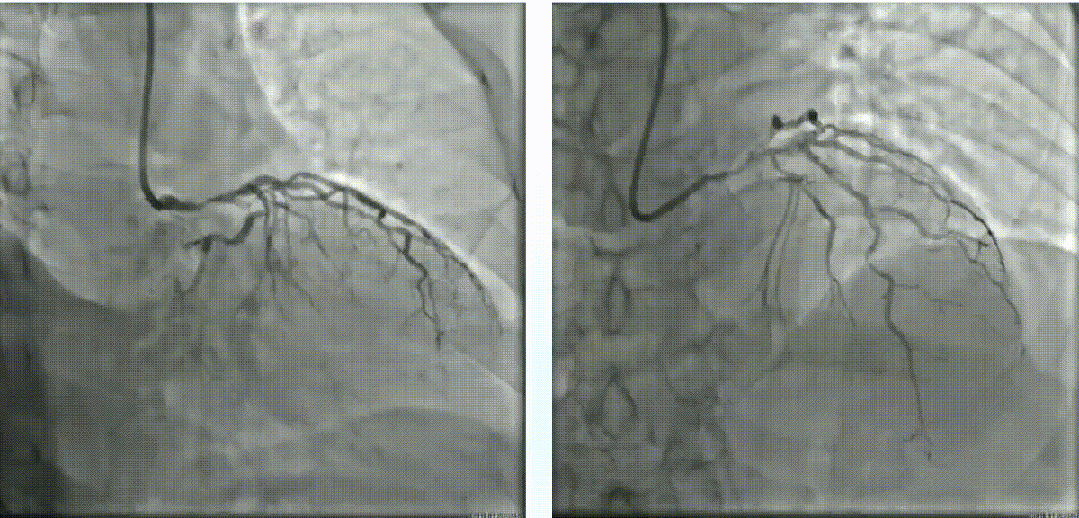
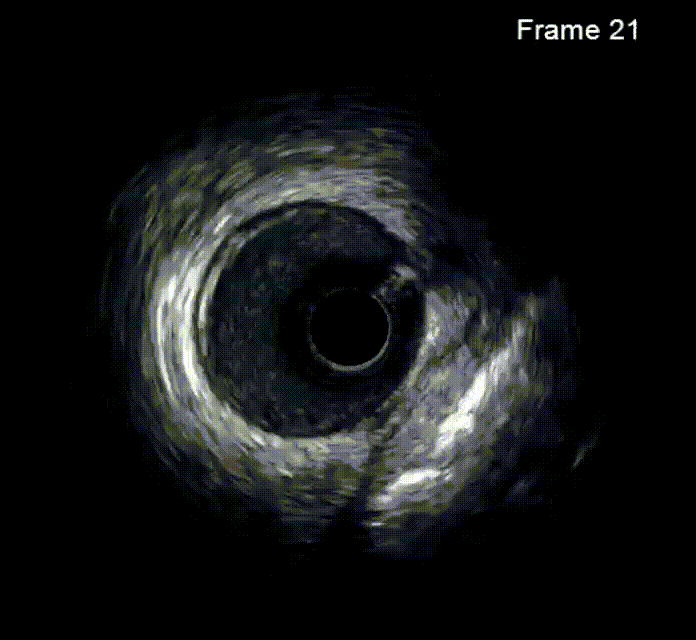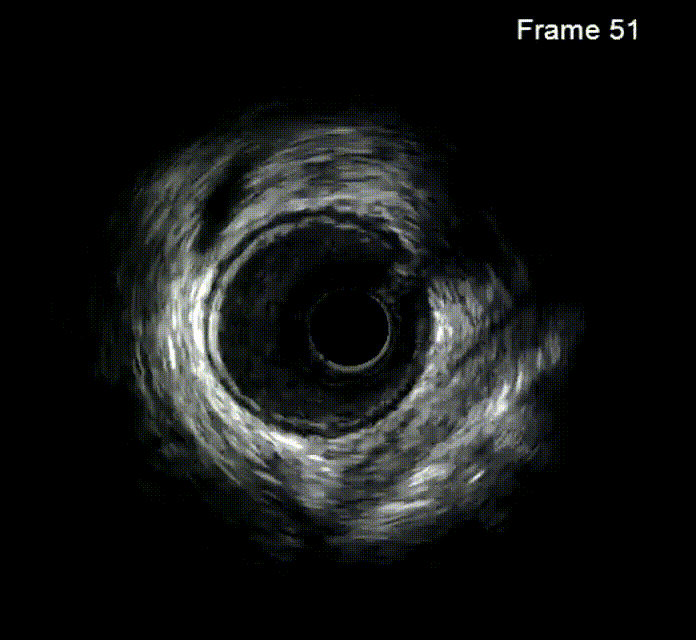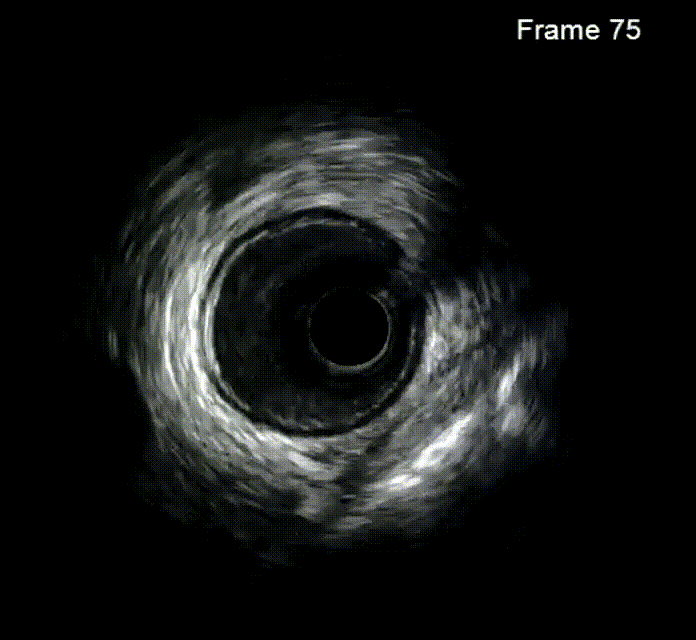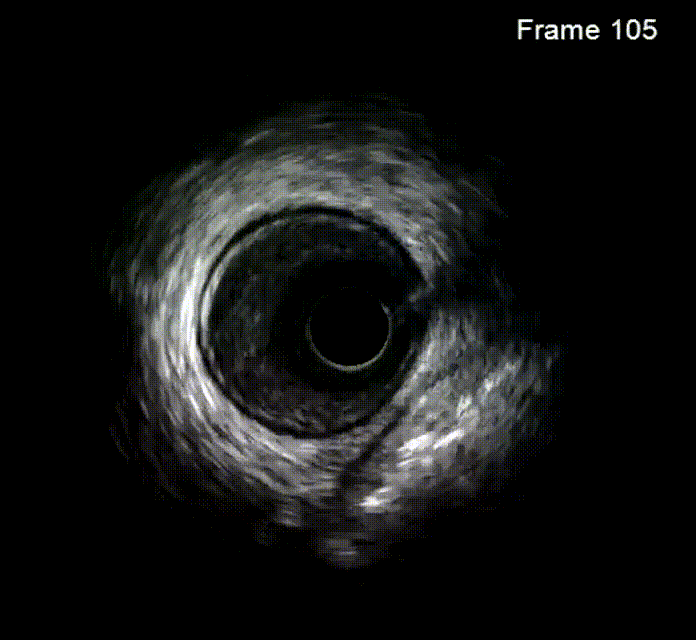
使用2.0*15mm Maverick球囊以14 atm压力扩张LM体部后,进行IVUS检查。随后尝试3.0*10mm BS切割球囊切割,但无法完全膨胀。经皮冠脉斑块准分子激光消融术(1.7mm),40mj/mm2*35Hz、50mj/mm2*40Hz。经皮冠脉斑块准分子激光消融,再次换用3.0*10mm BS切割球囊切割数次。经过ELCA及切割处理后再次复查IVUS。LAD-LM串联内置3.0*16mm、3.5*16mm及4.0*23mm药物支架。最后复查IVUS,支架贴壁良好。
钙化病变预处理器械
冠状动脉轨道旋磨术(OAS)是为提高严重冠状动脉钙化病变介入治疗成功率而研发的一种新技术,源自外周血管疾病的OAS。该技术通过改进后应用于冠状动脉,利用偏心安装的旋磨头,在斑块上产生不同轨道的旋磨作用,弹性较好的血管壁可弹开旋磨头,从而减少血管损伤,达到差异性旋磨的效果。旋磨头以一定速度旋转,产生离心力,速度越快,离心力越大,形成的轨道越大,修饰斑块和扩大管腔的能力越强。
OAS主要适用于需行支架置入术或经皮冠状动脉球囊扩张术的de novo严重钙化病变,其小旋磨头设计和可通过调整转速改变修饰血管的直径,使其操作简便易行。禁忌证与传统冠状动脉斑块旋磨术类似,主要包括旋磨导丝无法通过病变、桥血管或支架内病变、血栓性病变、单一冠状动脉供血以及病变部位存在夹层的情况。
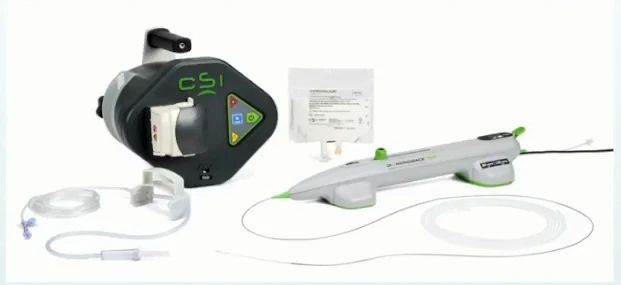
冠状动脉血管内碎石术(IVL)基于泌尿系结石的碎石理念。IVL系统通过在球囊低压扩张时向病变区域提供未聚焦、圆周和脉冲式的机械能,能够高效、安全地破坏浅表及深层钙化,从而显著改善血管顺应性。
IVL系统主要用于介入治疗前的冠状动脉钙化病变预处理。其禁忌证与其他钙化病变处理技术类似,主要包括:导丝或IVL球囊无法通过病变;桥血管病变;血栓性病变;单一冠状动脉供血;造影提示病变部位存在夹层。

病例3
患者为68岁男性,反复胸痛16年,加重13月。2008年在外院LAD、LCX各植入一枚支架。诊断为冠心病、不稳定心绞痛、冠脉支架植入术后、高血压、糖尿病、颈动脉狭窄。
冠状动脉造影显示,患者LAD开口处存在钙化斑块,伴随90%的狭窄,且近段支架内再狭窄达到90%。由于患者拒绝接受CABG治疗,经讨论,建议在IVUS指导下对LAD进行IVL联合DCB。
使用6F EBU 3.5指引导管,Sion工作导丝,经2.015mm Gustall球囊至LAD,以12 atm进行三次预扩张。随后对LAD实施IVL(2.512mm,8个周期),经IVUS复查后,使用3.015mm Quantum球囊以14-16 atm进行预处理。应用3.030mm SeQuen药物涂层球囊,以10 atm释放60秒。最后复查造影,即刻效果满意。

CABG
对于常规PCI治疗难以有效处理的严重钙化病变,且伴有以下情况时,可考虑采用CABG作为治疗选择:
(1) 存在血栓性或溃疡性病变;
(2) 严重的成角病变,角度大于60°,尤其是大于90°的成角病变;
(3) 伴有明显内膜撕裂的病变;
(4) 弥漫性病变,病变长度超过25 mm;
(5) 左心功能显著降低的患者;
(6) 导丝无法通过的慢性完全闭塞且伴严重钙化的病变。
病例4
该患者为80岁女性,造影见LM正常;LAD开口处狭窄90%;LCX全程弥漫性钙化伴有50%-80%的狭窄;RCA全程弥漫性钙化,最重狭窄达95%。
由于患者拒绝搭桥,先进行了旋磨,旋磨导丝引入波科1.25mm旋磨头,先后以13W*14s、13W*17s、13W*17s、14W*13s、17W*15s、17W*18s、17W*15s、17W*10s共进行八次旋磨处理病变。复查造影,狭窄较前明显减轻,TIMI血流3级。
导丝送入血管内超声导管,显示RCA开口处存在严重狭窄,最小面积为2.94mm²,近段见严重钙化,最小面积为3.28mm²。
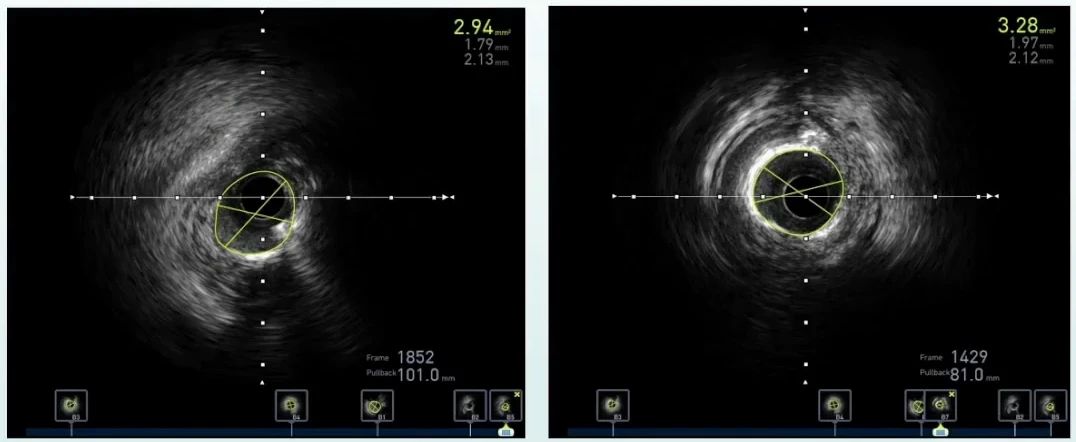
沿导丝置入2.0×15mm、2.5×20mm Maverick球囊至RCA病变扩张。沿导丝串联置入2.5X22mm药物支架、3.0X23mm药物支架、3.0×33mm药物支架、3.0×18mm药物支架,8-10atm扩张。3.0×15mm、3.25×15mm球囊以12-16atm扩张后造影。开口处支架贴壁良好,有效面积7.08mm²。最终效果良好。

小结
冠状动脉钙化在冠心病患者中普遍存在,严重钙化会显著增加冠状动脉介入治疗的手术难度和相关风险。对于严重钙化病变,冠状动脉斑块旋磨联合支架置入可以获得较好的即刻和远期效果。应注意准确识别并评估钙化病变,在有条件的医院尽量使用IVUS或OCT进行评估,并掌握不同程度诱发性病变的治疗策略,熟悉冠状动脉斑块旋磨术的适应证、禁忌证及相关器械的操作流程,做好并发症的预防。
撰稿/袁一田;审校/刘丽娜
文中图片均来自授课幻灯
本文为医谱学术原创文章,转载请标注来源

长按识别二维码 看本文精彩视频
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动