瓣中瓣治疗小瓣环外科瓣衰败患者:一项来自日本的全国登记研究
摘要:
经导管瓣中瓣主动脉瓣置换术(ViVTAVR)为主动脉瓣外科置换术后衰败患者提供了一种有效的替代治疗方法。然而,小主动脉瓣环患者的ViVTAVR临床结局的数据仍然很少。
方法:我们分析了JTVT(日本经导管瓣膜治疗)注册中心的数据,其中包括日本所有TAVR中心,数据收集时间为2018年7月(ViVTAVR获批)至2022年12月。小主动脉瓣环定义为术前CT分析测量的主动脉瓣环面积≤314 mm²。假体患者不匹配(PPM)定义为术后30天内超声心动图评估有效瓣口面积指数<0.85 cm²/m²。
结果:
在47 800例患者中,1029例接受了ViVTAVR,最终样本为405例患者。小瓣环组(n=225)和非小瓣环组(n=180)的平均有效瓣口面积指数分别为0.83 cm²/m²和0.94 cm²/m²,PPM率分别为59.2%和44.4%(小瓣环与PPM独立相关(危险比,1.9 [95% CI,1.26–2.87];P=0.002)。两组之间未观察到30天和1年临床结局的差异。在225例小瓣环患者中,球扩瓣组(n=61)的平均有效瓣口面积指数为0.76 cm2/m2,自膨式瓣膜组(n=164)的平均有效瓣口面积指数为0.86 cm2/m2;PPM发生率分别为67.2%和56.1%,不同瓣膜类型组间未观察到临床结局的差异。
结论:
在日本患者中,小瓣环的ViV-TAVR与PPM风险增加相关;然而,不同瓣环大小或TAVR瓣膜类型,临床结局未观察到差异。
主动脉瓣置换术(TAVR)是主动脉瓣狭窄外科瓣膜置换术的替代疗法。特别是对于外科手术后生物瓣衰败的患者,瓣中瓣TAVR(ViV-TAVR)已成为手术风险高或禁忌患者的优选替代术式。
假体患者不匹配(PPM)发生在植入的假体瓣膜开口面积小于患者所需面积时,严重影响瓣膜的血流动力学。尽管PPM在ViV-TAVR后的患者中并不少见,但关于ViVTAVR治疗小瓣环的数据很少。许多主动脉瓣狭窄患者,特别是女性和亚裔患者,主动脉瓣环较小,可以从 TAVR手术获益。然而,由于身材偏小,该人群的主动脉根部和血管入路较小,这与主要并发症和死亡率增加有关。
本研究利用JTVT(日本经导管瓣膜治疗)注册中心的数据填补这一知识空白,JTVT是一个全国性的TAVR注册中心,包括日本接受TAVR的所有患者的数据。本研究旨在研究接受ViVTAVR的患者的临床特征,以比较小瓣环患者和非小瓣环患者的临床结局,并根据器械类型进一步研究这些患者的临床结局差异。
数据来源
JTVT注册由日本4个学会建立(日本循环学会、日本心血管外科学会、日本胸外科学会、日本心血管介入治疗学会),并与药品和医疗器械管理局合作,包含所有进行 TAVR的机构的临床数据集。本的所有TAVR执行机构都必须参与国家TAVR登记。机构没有选择退出此注册的选项。患者知情同意的方法由各机构的机构审查委员会根据国家伦理指南和法规确定。
ViV-TAVR自2018年7月起由日本健康保险承保,因此,我们使用了JTVT注册从2018年7月至2022年12月的数据。我们从47800名TAVR患者中筛选出1058名接受过外科手术生物瓣膜植入的患者,排除了27名接受血液透析、2名未使用TAVR器械、90名术前CT数据缺失,534名术后(术后第0天至第30天)AV面积数据缺失,最终纳入405名患者(图1)。术前CTA测量的瓣环面积≤314 mm²,定义为小瓣环。在405名患者中,225名患者为小瓣环患者,其中使用球扩瓣和自膨瓣的患者数分别为61和164(图1)。

图1.纳入研究的患者流程图。CT表示计算机断层扫描;JTVT,日本经导管瓣膜治疗。
临床结局
临床结局为ViV-TAVR术后30天和1年的复合终点(死亡、卒中或心力衰竭住院)。PPM定义:术后30天内超声心动图有效瓣口面积指数<0.65 cm²/m²为重度PPM,有效瓣口面积指数0.65–0.85 cm²/m²为中度PPM。
统计方法
所有连续变量均表示为平均值±标准差或中位数+四分位距(视情况而定)。PPM被认为是序数变量(无显著性、中度和重度)。进行了多变量顺序逻辑回归分析,以评估30天内PPM的风险,包括根据既往研究选择的导致PPM风险的风险因素(即性别、身高、体重、高脂血症、既往冠状动脉旁路移植术、既往卒中、左心室射血分数、平均跨瓣压差、主动脉反流分级和经股动脉入路)。使用评分检验评估比例比值假设。使用KaplanMeier方法和对数秩检验评估术后1年期间结局的发生率。该评估用于比较具有小瓣环患者和非小瓣环的患者的ViV-TAVR,以及小瓣环患者接受球扩瓣和自膨瓣的患者组间比较。所有分析均使用SAS软件进行。使用Wilcoxon秩和检验比较组间连续变量,使用χ2 检验和Fisher 精确性检验比较分类变量。P<0.05被认为具有统计学差异。
结果
ViV-TAVR病例数量每年都在增加(2018年58个,2019年170个,2020年217个,2021年287个,2022年297个;图2)。在纳入的ViV-TAVR病例中使用的瓣膜包括球扩式瓣膜SAPIEN 3(Edwards)和自膨式瓣膜Evolut R/PRO/PRO+(Medtronic),最常用的是23mm自膨式瓣膜(图3)。

图2.瓣中瓣经导管主动脉瓣置换术数量的变化趋势(用于外科手术后生物瓣衰败),总数为1029例。

图3.ViV-TAVR(用于外科手术后生物瓣衰败)中植入的瓣膜种类及型号,总数为405例。
ViV TAVR治疗小瓣环的临床特点和预后
总体而言,分别在225名小瓣环和180名非小瓣环患者中进行了ViV-TAVR。表1显示小瓣环或非小瓣环患者的基线和手术特征。
表2显示了根据主动脉瓣环大小(小瓣环与非小瓣环)分组的手术后30天内的临床和超声心动图结果。ViVTAVR术后30天内,超声心动图评估的小瓣环和非小主动脉瓣环组的平均有效瓣口面积指数分别为0.83和0.94 cm2/m2。小瓣环患者发生中度以上PPM的比例为59.2%,而非小瓣组环发生中度以上PPM的比例为44.4%。在手术后30天,小瓣环组的平均压差为17.4±8.9mmHg,非小瓣环组为14.4±7.4 mmHg。在手术后30天,小瓣环组未观察到死亡和心力衰竭,在非小瓣环组,死亡和心力衰竭的发生率分别为2(1.1%)和1(0.6%)。
多变量Logistic回归分析显示,在校正性别、身高、体重、高脂血症、既往冠状动脉旁路移植术、既往中风、左心室射血分数、平均压差、主动脉瓣反流分级、股动脉入路后,小瓣环个体发生PPM的风险约为2倍(比值比,1.90 [95% CI,1.26–2.87];P=0.002;表3)。比例风险假设未违反 (P=0.30)。然而,我们观察到小和非小瓣环组术后1年的复合终点无显著差异(图4)。
表1. 研究人群的基线和手术特征
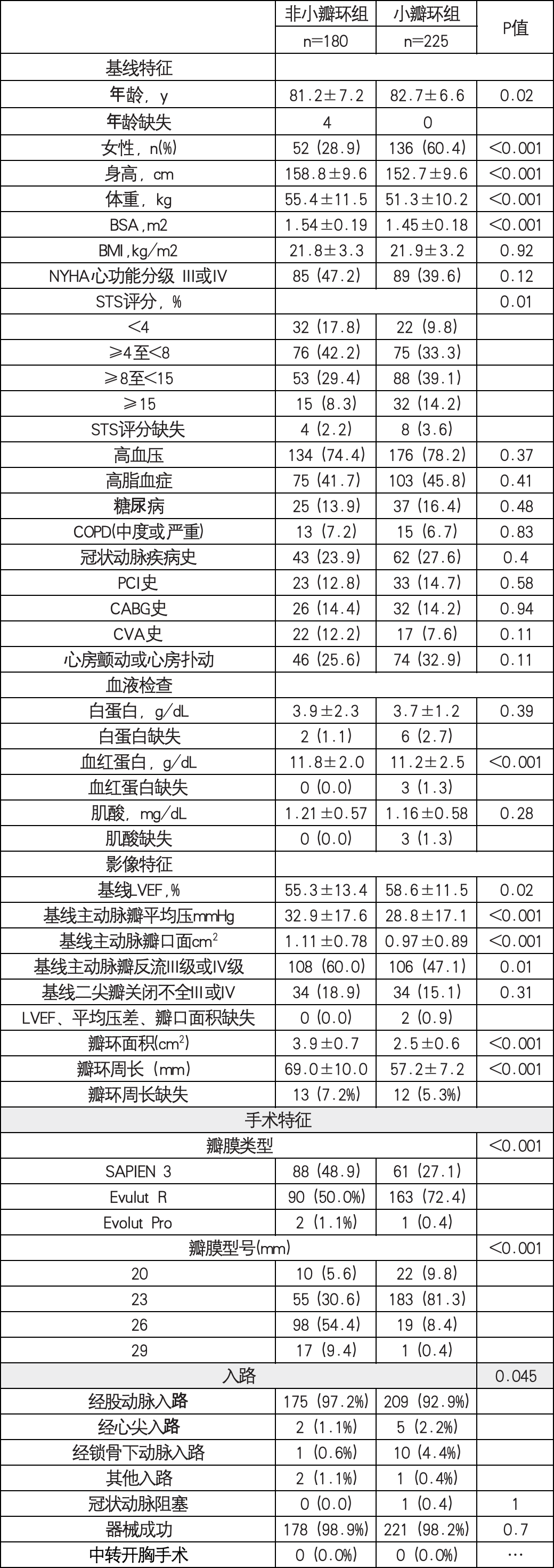
表2. 术后30天临床和超声心动图结果

表3.30天内患者-假体不匹配严重程度的多变量顺序逻辑回归分析

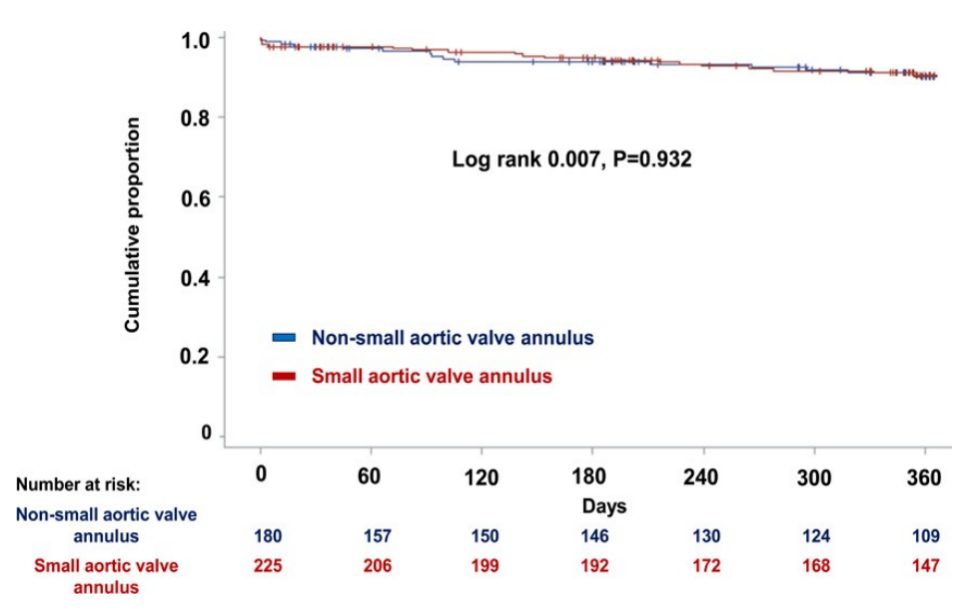
图4.根据存在小主动脉瓣环的情况,在4 05名接受瓣膜瓣内经导管主动脉瓣置换术
(对于手术失败的生物瓣膜)的患者中,获得复合终点的KaplanMeier曲线
小瓣环患者ViV-TAVR的临床特征和结局:球扩瓣与自膨瓣
表4显示了小瓣环患者行ViV-TAVR根据瓣膜类型分类的基线和手术特征。在225名接受ViV-TAVR治疗的小瓣环患者中,61名患者使用球扩式瓣膜,164名患者使用自膨式瓣膜。最常使用的瓣膜尺寸为23mm,89.6%的自膨瓣和59.0%的球扩式瓣膜为23mm。两组均主要使用股动脉入路,93.9%自膨胀瓣膜组病例中,90.2%球扩组病例为股动脉入路。替代入路在球扩式瓣膜组使用频率较高,8.2%病例使用经心尖入路。相比之下,自膨式瓣膜组在6.1%病例中使用了经锁骨下途径。围手术期并发症包括球囊扩张瓣膜组发生了1.6%的冠脉闭塞,而自膨式瓣膜组0.0%。两组器械成功率均较高,自膨式瓣膜组98.2%,球扩式瓣膜组98.4%。两组均无患者中转开胸手术。
表5 显示了不同瓣膜类型30天的临床和超声心动图结果。ViV-TAVR后30天内使用超声心动图评估的平均有效瓣口面积指数,球扩瓣组为0.76 cm2/m2,自膨瓣组为0.86 cm2/m2。值得注意的是,在67.2%的球扩瓣和56.1%的自膨瓣患者中发生了PPM。两组在30天内均未发生死亡或心力衰竭事件,两组之间复合终点的1年预后无显著差异(Log-rank,0.74;P=0.391;图5)。
表4.在小瓣环组中使用自膨瓣和球扩瓣患者的基线和手术特征

表5. 术后30天临床和超声心动图结果

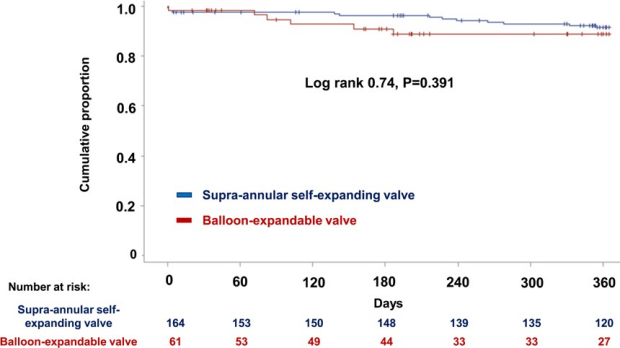
图5.根据经导管主动脉瓣置换瓣膜的类型,对225例接受瓣膜瓣内经导管主动脉瓣置换术(对于手术失败的生物瓣膜)的小主动脉瓣环患者的复合终点KaplanMeie曲线。
这项研究表明,日本人群中ViV-TAVR后的30天死亡和其他并发症发生率较低。术后1年小瓣环与非小瓣环病例之间未观察到预后差异。然而,小瓣环是ViV-TAVR术后PPM的显著风险因素。此外,自膨瓣和球扩瓣用于治疗小瓣环患者的ViVTAVR预后没有差异。
在本研究中,314 mm²被定义为小瓣环的cutoff值。其原因包括:对于小瓣环没有公认的标准,最近的TAVR小瓣环的荟萃分析使用了不同的定义。一些针对亚洲人群的研究基于TAVR前CT测量使用了<314 mm²的cutoff值。为了确保与这些研究的一致性以及与现有文献的可比性,我们在研究中采用了该cutoff值。
本研究中,尽管STS评分较高(小瓣环组≥50%患者的STS评分高于8.0%),无论瓣环大小,在围手术期并发症方面均表现出优异的结果,术后30天和1年的结局一致。在2011年至2016年的一项西方人群的队列研究中,1150名患者接受ViV-TAVR治疗,平均STS评分为6.9%,30天死亡率为2.9%。另一项前瞻性VIVA研究中纳入18202例患者,平均STS评分为6.6%,VIV-TAVR后1年的总死亡率为8.8%。尽管41.8%的患者主动脉瓣环较小(定义为生物瓣标签型号≤21 mm),在小瓣环和非小瓣环的患者之间,总体死亡率没有显著差异。本研究中观察到的30天和1年死亡率较低可能归因于更优化的患者选择和先进的器械技术等因素。即使在相对较小的日本患者中,ViV-TAVR也被证明是一种安全有效的手术。
在本研究中,小瓣环患者使用的瓣膜类型,对于ViVTAVR的临床结局无差异。在VIVID登记研究中,与其它瓣膜相比,Sapien瓣膜与PPM发生风险相关,有可能会影响预后。这与本研究的结合不符。其原因可能包括:第一,VIVID研究入选的人群体表面积更大(均值1.8m2),而本研究中日本人群体表面较小(均值1.45m2)。此差异可能缓解PPM对于本研究人群的影响,因为本人群体形小导致心输出量较小,从而减少了PPM一定来的血流动力学负担。第二,本研究使用的瓣膜较VIVID研究中使用的瓣膜更新,与早期使用的瓣膜设计相比,可能具有有更好的血流动力学性能。第三,研究之间的观察期不同:VIVID研究分析了长期预后(中位随访时间:3.9年),而本研究则侧重于1年预后。PPM对预后的影响可能在长期内表现得更加突出,这可能部分解释了结果的差异。此外,本研究数据强调了在小瓣环患者(72.8%)中对自膨式瓣的偏好。这反映了术者希望最大化EOA和降低潜在PPM风险的意图。尽管有这些发现,但球扩瓣和自膨瓣在1年结局方面没有显著差异,这表明即使在主动脉瓣环较小的患者中,短期预后也不会受到瓣膜类型的严重影响。然而,残余PPM和血流动力学性能对长期结果的影响仍然是进一步研究的重要领域,特别是在日本人口中,较小的体型和独特的解剖因素可能会影响这些关系。
近期的 Small Annuli Randomized to Evolut or SAPIEN 研究(一项旨在比较接受TAVR手术的小瓣环患者中,自膨式瓣膜与球扩式瓣膜的临床结局及性能的随机对照研究)表明,与球囊扩张式瓣膜相比,自膨式瓣膜可显著降低瓣膜功能障碍的风险,而1年的临床结局无差异。尽管两项研究的人群不同(本研究聚焦于ViV-TAVR,而 Small Annuli Randomized to Evolut or SAPIEN 研究聚焦于自体瓣膜),但其结果具有一致性。然而,本研究中生物瓣膜功能障碍与预后之间缺乏直接关联的机制尚不明确。尽管基线时重度PPM与1年死亡风险独立相关,但 ViV-TAVR 术后的 PPM 似乎并不影响结局。
本研究的一个局限性是缺乏外科瓣膜的PPM数据,包括标签尺寸,这与ViVTAVR后的预后相关。然而由于本研究是基于术前CT扫描测量的瓣环尺寸,我们认为这种局限性并不显著影响研究结论。其次,超声心动图在各机构检查,而非中心实验室。第三,由于注册研究的局限性,可能存在一些漏报。最后,生物瓣架断裂技术已被认为是小瓣环患者ViVTAVR的有效策略。然而,由于这种治疗方式不在日本健康保险报销范围内,本队列中未常规使用瓣架断裂技术。瓣架断裂技术可能改善血流动力学表现并减少跨瓣压差,尤其是在瓣环较小的患者中。本研究对于该技术的应用不足可能影响结果,特别是对于外科瓣尺寸较小的患者。
在日本人群中, ViV-TAVR的应用随时间呈上升趋势。尽管针对小瓣环的 ViV-TAVR 存在PPM风险,小瓣环与非小瓣环组 ViV-TAVR 的临床结局无显著差异。此外,小瓣环患者行 ViV-TAVR 的临床预后与所使用的器械种类无关。本研究结果可能受到临床医生针对小瓣环患者对于手术技术及瓣膜选择偏好的影响。尽管需要随机试验来进一步确定小瓣环衰败外科瓣的最佳治疗策略,但本研究表明,ViV-TAVR 在日本人群中对小瓣环患者是安全有效的手术方式。不同TAVR瓣膜类型之间血流动力学存在差异,但由于样本量有限,需进一步研究明确其临床意义。
-End-
关注我们
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。

发表留言
暂无留言
输入您的留言参与专家互动