JACC丨紫杉醇药物涂层球囊(PCB)治疗后,易形成冠状动脉瘤?
药物涂层球囊已成为治疗支架内再狭窄和新发病变的有效疗法。动物研究显示,紫杉醇涂层球囊在冠状动脉中的作用机制可导致血管中膜坏死,这或许能解释为何与西罗莫司涂层球囊相比,紫杉醇涂层球囊可观察到更优的血管造影重塑效果。然而,在某些情况下,紫杉醇可能引发不良重塑,导致冠状动脉瘤形成。本文报告4例紫杉醇涂层球囊血管成形术后发生冠状动脉瘤的病例,并探讨其可能机制、处理方法及对未来临床实践的潜在影响。
鉴于持续涌现的阳性数据,药物涂层球囊(DCB)在经皮冠状动脉介入治疗中愈发广泛地应用于支架内再狭窄和新发病变的治疗。其优势在于可实现局部药物释放而不遗留永久性植入物,因此与药物洗脱支架(DES)相比,DCB在维持冠状动脉解剖结构、消除支架血栓风险及缩短双联抗血小板治疗(DAPT)疗程方面更具优势。尽管如此,相关并发症仍有报道,包括冠状动脉瘤(CAA)的形成。冠状动脉瘤定义为冠状动脉局部扩张,其直径超过相邻正常节段的1.5倍。尽管传统上认为冠状动脉瘤与动脉粥样硬化及川崎病相关,但DCB(尤其是紫杉醇涂层球囊)的应用已引发了医源性冠状动脉瘤的担忧。由于缺乏临床试验数据或指南推荐,此类情况的临床处理对医师而言构成了棘手的难题。本文报告4例DCB血管成形术后发生冠状动脉瘤的临床病例,并探讨该并发症的可能机制及处理策略。
核心要点总结
➤药物涂层球囊治疗后发生动脉瘤虽属罕见,但紫杉醇涂层球囊相关报道更为常见,这可能与其作用机制有关。紫杉醇的细胞毒性可能使血管易于发生过度或异常重塑,进而导致血管扩张或动脉瘤形成。
➤尽管如此,紫杉醇在球囊平台中的应用相较于支架平台已显示出安全性和有效性。
➤西罗莫司涂层球囊的出现为术者提供了替代选择,尤其鉴于雷帕霉素类药物(Limus)对动脉的作用更为温和,其细胞抑制作用与紫杉醇的细胞毒性不同。
病例1
一名57岁男性,既往有高血压病史,诊断为急性冠状动脉综合征(ACS),冠状动脉造影显示左前降支(LAD)中段严重狭窄(图 1A)。经皮冠状动脉介入治疗过程如下:首先使用3.0×15mm半顺应性球囊及3.5×15mm刻痕球囊对病变进行预扩张。预扩张后造影显示效果理想,无明显弹性回缩或夹层(图1B)。鉴于患者年龄相对较轻,为获得满意的最终疗效,选用3.5×30mm紫杉醇涂层球囊(PCB)进行治疗,术后72小时患者无并发症出院。术后6个月随访造影显示,原治疗节段出现动脉瘤样扩张(图1C),心肌梗死溶栓治疗(TIMI)血流3级。由于患者无临床症状,制定保守治疗方案:继续双联抗血小板治(DAPT),并于6个月后行冠状动脉计算机断层扫描血管造影(CTA)监测。
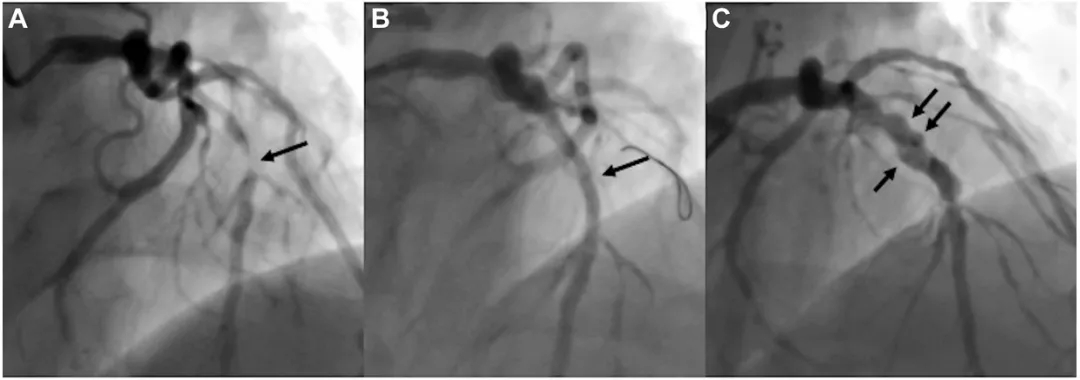
图1 患者1(病例1)PCI术前、术后及随访期间的冠状动脉造影
(A) 左前降主动脉中段闭塞(箭头)。 (B) 用紫杉醇涂层球囊成功治疗后的血管造影(箭头)。 (C) 在6个月随访时,显示冠状动脉瘤(箭头)。
病例2
一名65岁女性,既往有高血压病史,因急性前侧壁心肌梗死就诊。冠状动脉造影显示左前降支(LAD)中段完全闭塞,心肌梗死溶栓治疗(TIMI)血流0级(图2A)。使用2.5×15mm半顺应性球囊对闭塞病变进行治疗后,TIMI血流恢复至3级,残余狭窄程度轻微且无明显夹层。鉴于血管直径较小,选用2.5×25mm紫杉醇涂层球囊(PCB)治疗以获得理想的最终造影效果(图2B)。术后6个月随访造影显示,LAD远端出现动脉瘤样扩张(图2C、2D),TIMI 血流3级。由于患者无临床症状,制定保守治疗方案:继续双联抗血小板治疗(DAPT),并计划6个月后行冠状动脉计算机断层扫描血管造影(CTA)随访。
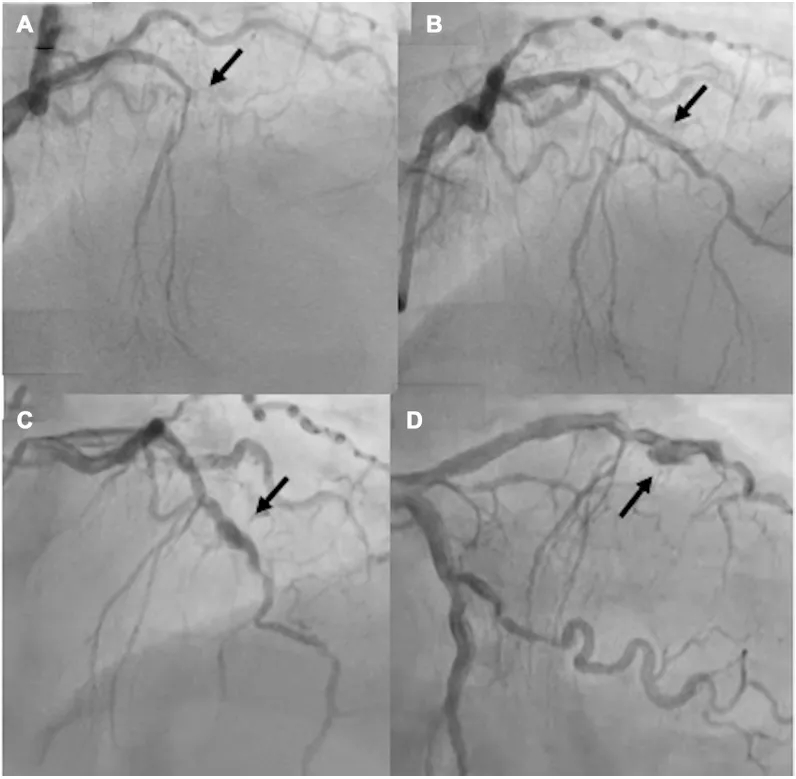
图2 患者 2(病例 2)经皮冠状动脉介入治疗(PCI)前、术后及随访期间的冠状动脉造影
(A)左前降支中段闭塞(箭头所示)。(B)紫杉醇涂层球囊成功治疗后(箭头所示)。(C、D)6 个月随访时的冠状动脉造影头位和足位投照(箭头所示)。
病例3
一名44岁男性,诊断为前壁心肌梗死,冠状动脉造影显示左前降支(LAD)中段闭塞,心肌梗死溶栓治疗(TIMI)血流0级(图3A)。在导丝通过LAD后,使用3.5×15mm半顺应性球囊进行预扩张,恢复TIMI 3级血流。鉴于患者年轻,为避免使用药物洗脱支架(DES),选用3.5×15 mm 紫杉醇涂层球囊(PCB)治疗(图3B)。术后6个月随访造影显示,LAD原PCB治疗节段出现动脉瘤样扩张(图3C)。由于患者无临床症状,对动脉瘤采取保守治疗,继续双联抗血小板治疗(DAPT)并计划随访造影。
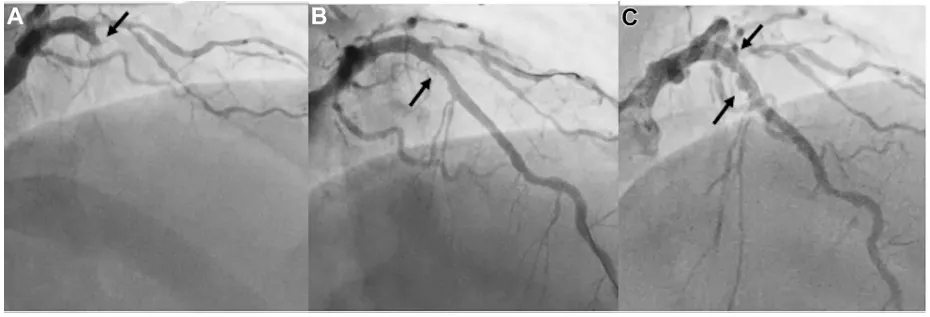
患者3(病例3)PCI术前、术后及随访期间的冠状动脉造影
(A) 左前降支近段闭塞(箭头)。 (B) 经成功使用紫杉醇涂层球囊治疗后(箭头)。 (C) 6个月随访显示冠状动脉瘤样扩张(箭头)。
病例4
一名65岁男性,2010年曾于左前降支(LAD)近段及中段分别植入2枚药物洗脱支架(DES),2022年因急性前壁心肌梗死再次就诊。冠状动脉造影显示LAD近段闭塞(图4A、4B)。通过血栓抽吸及球囊扩张恢复心肌梗死溶栓治疗(TIMI)3 级血流后,行血管内成像检查,结果显示LAD近段存在血栓性病变,但既往植入的支架贴壁良好。为避免增加新的金属层,主要在近段病变处使用紫杉醇涂层球囊(PCB)治疗(图4C、4D)。术后6个月,患者因胸痛复发接受随访造影,显示DCB治疗的LAD 近段出现新发动脉瘤,光学相干断层成像(OCT)证实了这一发现(图5A、5B、视频)。在讨论制定合适的治疗方案期间,患者突发心源性猝死。我们认为其猝死原因可能是动脉瘤内血栓形成导致急性闭塞,或潜在左心室功能不全引发的致命性心律失常。
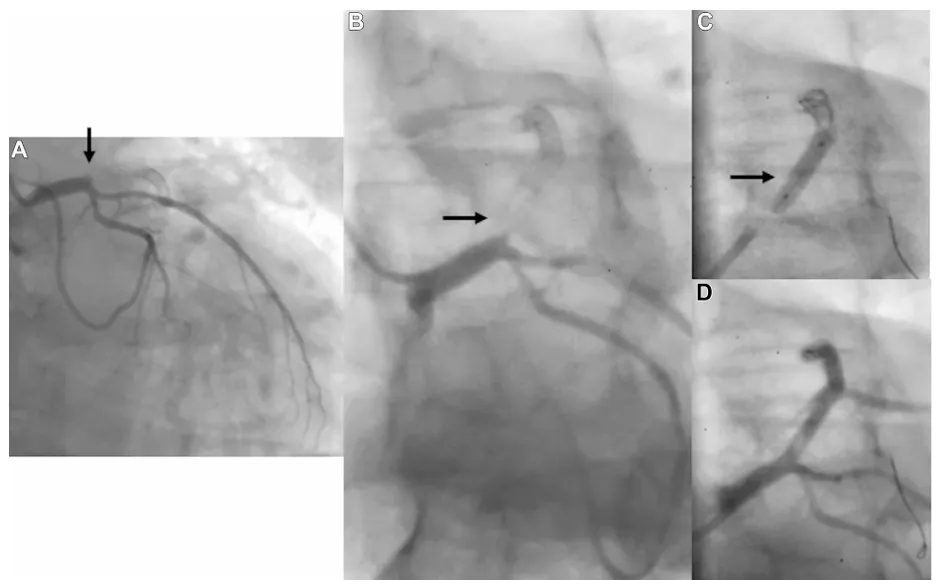
图4 患者4(病例4)PCI术前、术后及随访期间的冠状动脉造影
(A, B) 显示在之前放置的支架内近端段的闭塞情况(箭头)。(C, D) 用紫杉醇涂层球囊成功治疗后(箭头)。
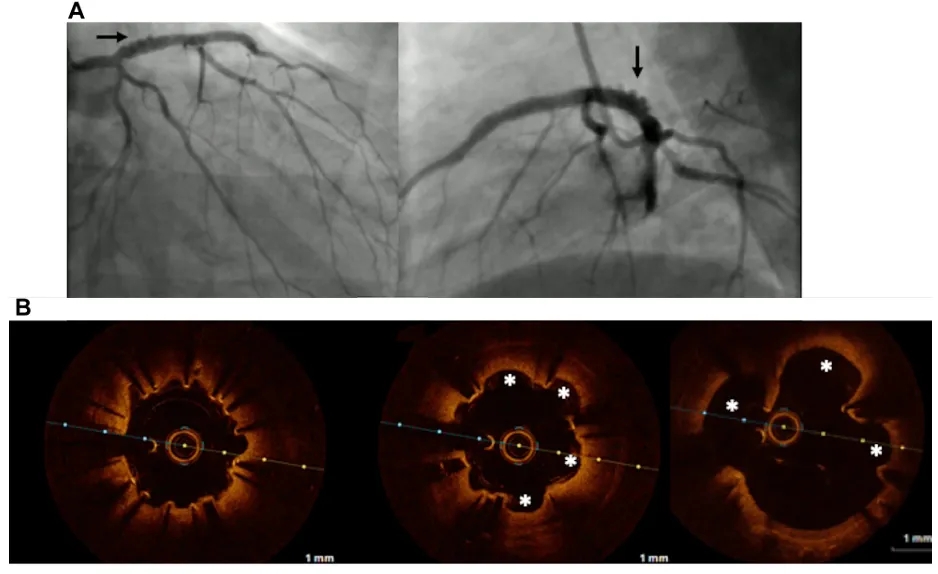
图5 患者4(病例4)的OCT检查在随访血管造影期间进行
(A) 冠状动脉造影和 (B) 光学相干断层扫描 (OCT) 显示冠状动脉瘤(分别由箭头和星号标出)。
讨论
冠状动脉瘤(CAA)的特征为冠状动脉异常扩张,其直径超过相邻正常节段至少50%。尽管自发性CAA的具体发病机制尚未明确,但已有多种理论被提出,包括感染、吸烟或动脉粥样硬化等因素。然而,血管成形术后发生的 CAA 则归因于手术操作及使用的器械。潜在影响因素包括初始操作中严重的急性血管损伤、超敏反应,以及药物或聚合物引发的异常血管重塑。在第一代药物洗脱支架(DES)时代,紫杉醇与用于药物释放的聚合物联合使用可引发炎症,导致异常重塑。但该现象在当代DES中已不再观察到,因支架上的紫杉醇涂层技术已更新,且所用聚合物具有生物相容性。由于紫杉醇的高亲脂性使其药物转移效率优于西罗莫司,且血管造影重塑效果更佳,故仍为球囊涂层的首选药物。紫杉醇具有抗增殖生物学效应,在转移至血管壁后可作用于平滑肌细胞、内皮细胞和成纤维细胞。使用紫杉醇可减少新生内膜增生,但伴随持续性纤维蛋白沉积、巨噬细胞浸润及平滑肌细胞总体减少,进而损害血管愈合并促进炎症反应。与西罗莫司不同,紫杉醇是细胞毒性药物。近期动物模型研究显示,紫杉醇涂层球囊(PCB)治疗节段可出现血管中膜坏死,这或许能解释为何PCB术后血管重塑效果优于西罗莫司涂层球囊 。药物涂层球囊(DCB)术后动脉瘤的报道几乎均见于PCB病例,这可能与前文所述的作用机制导致的过度或不良重塑有关。尽管存在这些影响,自2005年PCB问世以来,其安全性和有效性已得到证实,紫杉醇仍是球囊涂层的常用药物 。
然而,这些发现引发了一个难题:此类动脉瘤形成是否具有临床意义?值得注意的是,最后一例患者(病例4)发生猝死,其原因可能是左心室功能不全引发的致命性心律失常,或同样可能源于动脉瘤腔隙内形成的支架血栓。前3例患者虽无临床症状,但正通过冠状动脉计算机断层扫描血管造影(CTA)随访监测动脉瘤进展。所有4例接受PCB治疗的患者均为急性冠状动脉综合征(ACS),这提示异常重塑的发生可能与ACS相关。ACS时病变部位存在的活动性炎症,可能因紫杉醇的细胞毒性而进一步加重,从而使血管易发生此类异常重塑。此类动脉瘤的风险包括血管血栓形成甚至破裂。目前也不清楚PCB术后的CAA是进展性、静止性还是消退性,尤其是在触发因素(紫杉醇)消失后。潜在治疗方案之一是置入覆膜支架,将动脉瘤与主流循环隔离,从而降低血栓和破裂风险。但覆膜支架本身易发生再狭窄和支架血栓。尽管PCB在特定冠状动脉病变中为支架植入提供了有价值的替代方案,但CAA的形成是潜在的重要并发症。目前缺乏PCB术后长期血管造影随访数据,难以明确DCB术后CAA的实际发生率。需要进一步研究以阐明DCB使用后CAA形成的机制,并确定最佳治疗策略。现阶段尚不清楚哪些患者和病变亚群易发生此类异常重塑。我们是否应转向雷帕霉素类涂层球囊(其安全性范围更广)?我们是否正在见证西罗莫司涂层球囊在临床试验中疗效数据的涌现? 这些重要问题需要进一步研究来解答。
文献来源:Saboe, A,Upadhya, C,Finn, A.et al.Coronary Artery Aneurysm Post Drug-Coated Balloon Angioplasty.J Am Coll Cardiol Case Rep.2025 Jul,30 (17) .
- End -
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动