袁祖贻教授:ASCVD干预新靶点:Lp(a)循证医学进展
动脉粥样硬化性心血管疾病(ASCVD)血脂干预的首要靶标是低密度脂蛋白胆固醇(LDL-C),但随机对照和真实世界研究表明,即使LDL-C水平控制在最佳范围内,心血管事件的残余风险仍然存在。近年来大量研究表明脂蛋白(a)[Lp(a)]升高是ASCVD的独立危险因素,Lp (a)成为备受关注的血脂干预潜在新靶点之一。各国也颁布了Lp (a)相关指南/共识,但推荐的关于CV风险的Lp(a)阈值差异很大。目前还没有特异性降低Lp (a)的药物,但新药物正在研发中,有些已经进入二三期临床试验,取得了较好的预期效果。在2023长安国际心血管病论坛上,西安交通大学第一附属医院袁祖贻教授对Lp(a)成为ASCVD干预新靶点目前的证据与未来的进展进行了精彩的分享。

一、Lp(a)简介
1.Lp(a)的发现
1963年,Berg(瑞典遗传学家)在分析兔抗血清与人LDL反应时,发现了一种新的脂蛋白,电泳时位于β和前β脂蛋白之间,认为是LDL的遗传变异。Berg称之lipoprotein (a)[Lp(a)],即脂蛋白(a)。
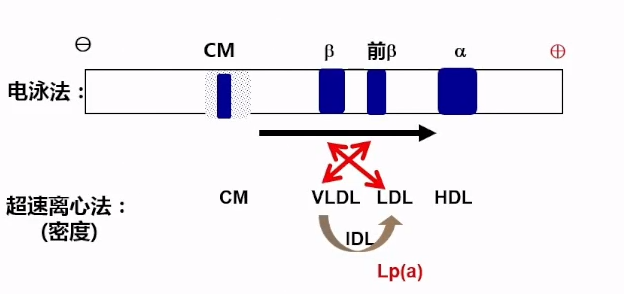
2.Lp(a)的结构
Lp(a)是一种在肝脏中产生的致动脉粥样硬化的脂蛋白,其中LDL的ApoB-100成分借助二硫键与Apo(a)共价结合。电镜下Lp(a)呈圆球型,直径约21nm,密度约1.05-1.10g/ml,电泳时Lp(a)在前β与β区带之间的位置。
Lp(a)结构包括:
①LDL-C(包括ApoB100)— 约含有30-46%的胆固醇,是血浆中总胆固醇的重要组成部分。
② Apo(a)— 一种高度糖化的亲水蛋白质,占Lp(a)总量的25-40%。Apo(a)肽链长度不一,具有高度多态性。
③OxPL(氧化磷脂)。
二、脂蛋白(a)与ASCVD
-
1980年,首次发现Lp(a)与心血管疾病有关,第一次提出30 mg/dl为其阈值。
-
1987年证实Apo(a)与纤溶酶原有高度同源性,从而认为Lp(a)不仅是动脉粥样硬化性疾病的危险因素,而且可能与血栓性疾病相关。
-
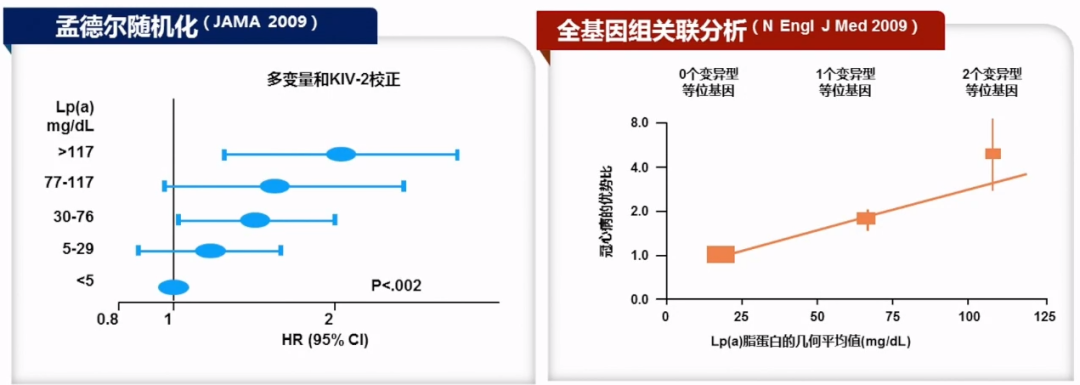
2009年两项遗传学研究提示Lp(a)与冠心病具有因果关系。JAMA杂志发表了三项来自丹麦哥本哈根的白人研究,在哥本哈根一般人群研究(CGPS)及哥本哈根城市心脏研究(CCHS)中,Lp(a)66-89百分位的个体患冠心病的MI(心肌梗死)风险更高。Lp(a)水平高于95百分位(>117 mg/dL)的病例,MI的OR为2.6(95% CI,1.1-2.2)。同时结果还表明LPA基因中KIV2(kringle 4 type 2)重复数和冠心病MI风险呈反比。
-
新英格兰杂志发表的PROCARDIS(早发性冠状动脉疾病)研究,使用一种新的基因芯片,在2100个候选基因中包含48742个单核苷酸多态性(SNPs),检测3145名冠心病患者和3352名对照者的相关性。在三个独立人群中测试复制,涉及4846名额外的冠心病病例受试者和4594名对照受试者。结果发现LPA位点上的rs10455872和rs3798220两个SNP与CAD显著相关。表明遗传变异对Lp(a)水平和CAD存在剂量反应关系。
-
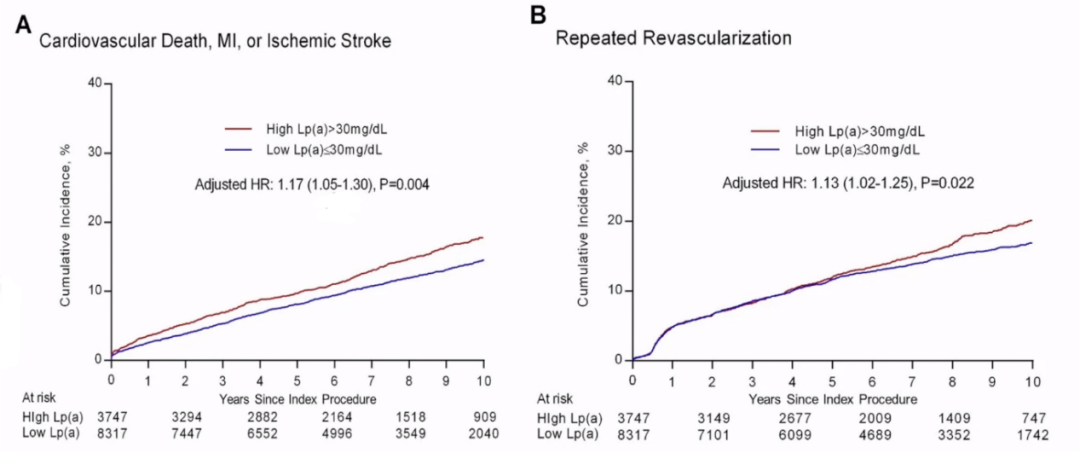
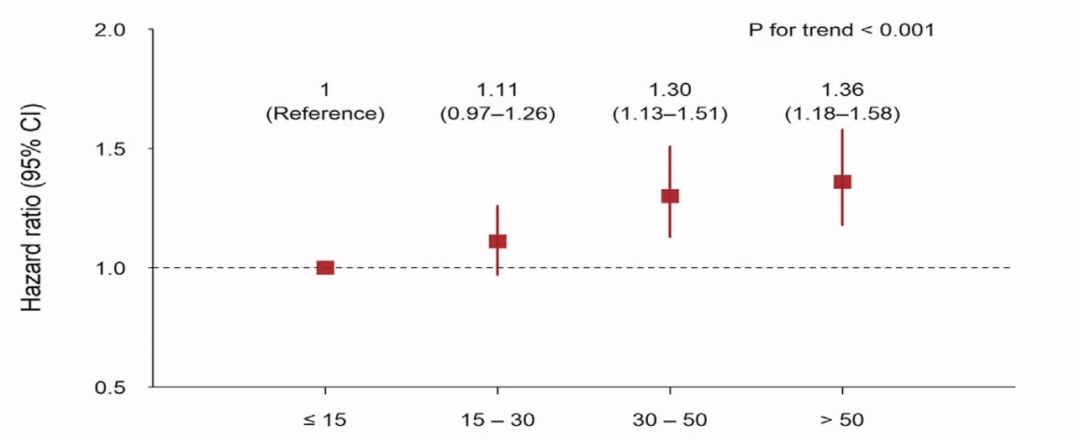
2021JACC发表研究,表明Lp(a)水平与PCl术后复发缺血事件有明显关联,呈线性关联,Lp(a)水平越高,缺血事件越容易复发。
-
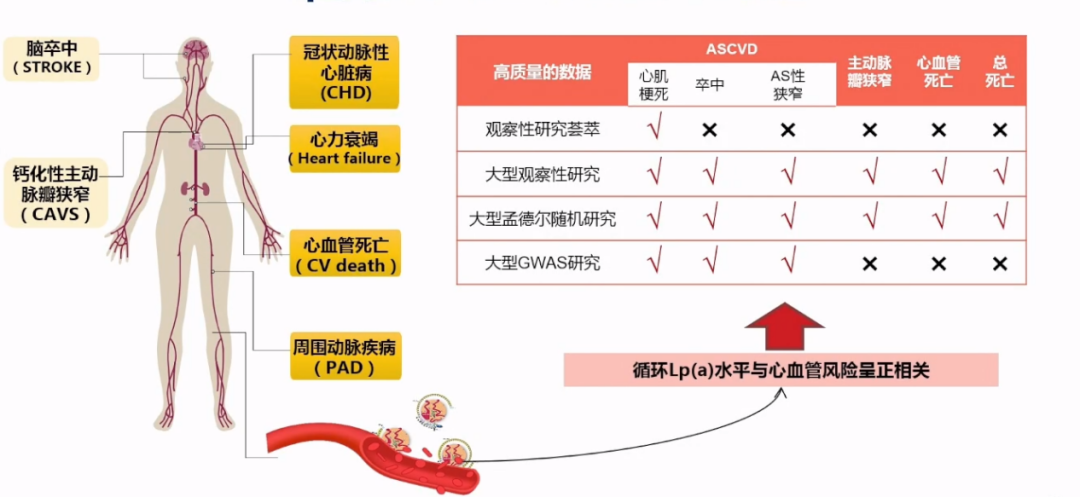
2019年美国NLA发布Lp(a)临床实践共识:Lp(a)水平与心血管风险呈正相关。
-
2020年《Circulation Research》发表综述,2022 ESC专家共识共同认为Lp(a)是CV风险管理中新的脂质前沿和治疗靶点,关注Lp(a)临床意义的时代已经到来。
三、脂蛋白(a)水平的人群分布
据估计,全球有14亿人的Lp(a)高于50 mg/dL(约1/5),由于Lp(a)水平升高,全世界每5人中约有1人发生了ASCVD的高风险。
1.一般人群(包括患者)的Lp(a)分布—偏态分布
与正常分布的LDL-C水平不同,Lp(a)水平在大多数人群中是偏态分布的,大多数个体(约70%)具有正常范围内的值(30mg/dL)。
-
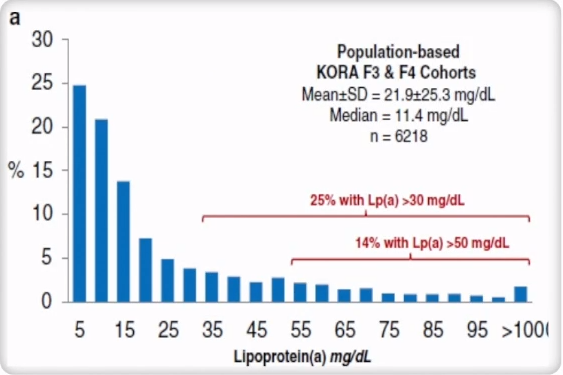
德国人群研究中Lp(a)水平的分布
KORAF3和KORAF4是从KORA S3和S4调查招募的以人群为基础的随访研究,代表了德国南部奥格斯堡的一般人群。从KORA F3和F4的组合分析中观察到Lp(a)浓度在6218个人中的偏斜分布。25%的人群Lp(a)水平>30mg/dl,14%的人群Lp(a)水平>50 mg/dl。
-
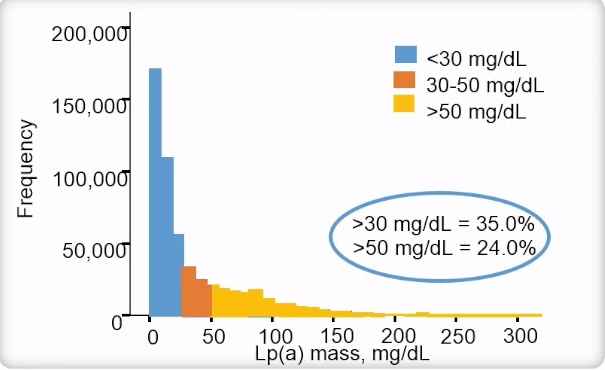
美国人群研究中Lp(a)水平的分布
2016年进行了一项研究以确定美国Lp(a)水平升高的患病率和患者阈值。研究分析了532359例患者的Lp(a)水平。来自推荐实验室的531144名受试者和来自三级转诊中心的915名患者。Lp(a)水平如预期倾斜。35%的人群Lp(a)水平在30~50 mg/dl,24%的人群Lp(a)水平>50 mg/dl。
-
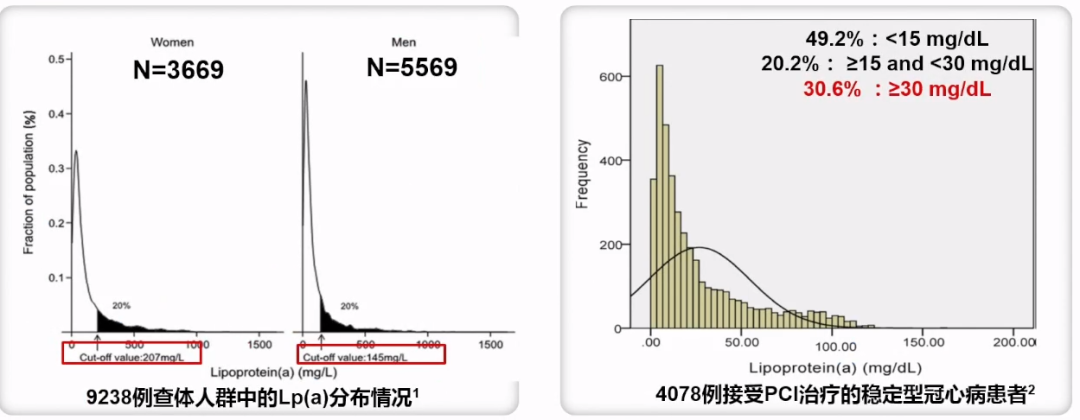
中国的Lp(a)相关流调&人群分布数据—偏态分布
相比其他国家及人种,中国人群偏态分布特征一致,Lp(a)>50 mg/dL的比例较低。49.2%的人群Lp(a)水平<15 mg/dl、20.2%的人群Lp(a)水平15~30 mg/dl、30.6%的人群Lp(a)水平≥30 mg/dl。
四、Lp(a)检测:指南推荐
1.Lp(a)是各大指南/共识公认的ASCVD独立危险因素,指南中推荐的关于CV风险的Lp(a)阈值差异很大
2010 EAS关于Lp(a)的专家共识:Lp(a)升高是明确的心血管疾病危险因素,其水平与CVD风险呈线性关系,没有明确的切点或阈值。理想的Lp(a)水平应50mg/dL以下。
2016加拿大血脂异常管理指南:Lp(a)水平>30 mg/dL是心血管疾病的危险因素。
2016 ESC/EAS血脂管理指南:Lp(a)是ASCVD的独立危险因素,当Lp(a)大于第80百分位数(50mg/dL)时,认为风险有显著统计学意义。
2016中国成人血脂异常防治指南:在排除各种应激性升高的情况下,Lp(a)被认为是ASCVD的独立危险因素。Lp(a)通常以30 mg/dL为切点,高于此水平者患冠心病的危险性明显增高。
2018 AHA/ACC血脂异常管理指南:Lp(a)>50mg/dl是ASCVD的独立危险因素。
2019 NLA关于Lp(a)的科学声明:Lp(a)是广泛被认可的ASCVD独立危险因素,Lp(a)>50 mg/dL提示存在显著风险。
关于Lp(a)致心血管风险增高的切点值,不同国家指南和共识中的推荐并不一致,较多使用的是50mg/dl。中国共识建议将30mg/dl作为风险增加的切点。
2.各大指南/共识推荐对Lp(a)检测及筛查
2019年英国脂蛋白(a)专家共识建议对5类高危患者推荐Lp(a)检测:
①有早发ASCVD个人或家族史者;
②一级亲属的Lp(a)水平>200 nmol/L;
③家族性高胆固醇血症患者;
④钙化性主动脉瓣狭窄患者;
⑤具有临界(但<15%)10年心血管事件风险的患者。
Lp(a)水平升高患者的管理应包括:
①降低整体动脉粥样硬化风险;
②通过理想的非HDL-C水平<100 mg/dl(2.5mmol/L)控制血脂异常;
③考虑脂蛋白置换术。
3.2019年ESC血脂指南建议所有成年人至少进行一次Lp(a)检测
成人应考虑一生至少检测一次Lp(a),以识别具有遗传的很高水平Lp(a)[>180 mg/dL(430 mmol/L)]水平的患者,这些患者终生动脉粥样硬化性心血管疾病(ASCVD)风险与杂合子家族性高胆固醇血症(HeFH)患者相似。
部分患者应考虑Lp(a)检测,如有早发心血管疾病家族史的患者,便于对处于中度和极高风险之间的患者进行重新分类。

五、降低脂蛋白(a):距离临床还有多远?
1.降低高Lp(a)的可能治疗方法
既往研究结果提示,现有降脂药物对Lp(a)的降幅很可能无法达到带来显著临床获益的效果。
反义寡核苷酸类药物可有效降低Lp(a)水平from:150mg/dL to <30mg/dL(降至指南建议的最低CV风险阈值以下)。
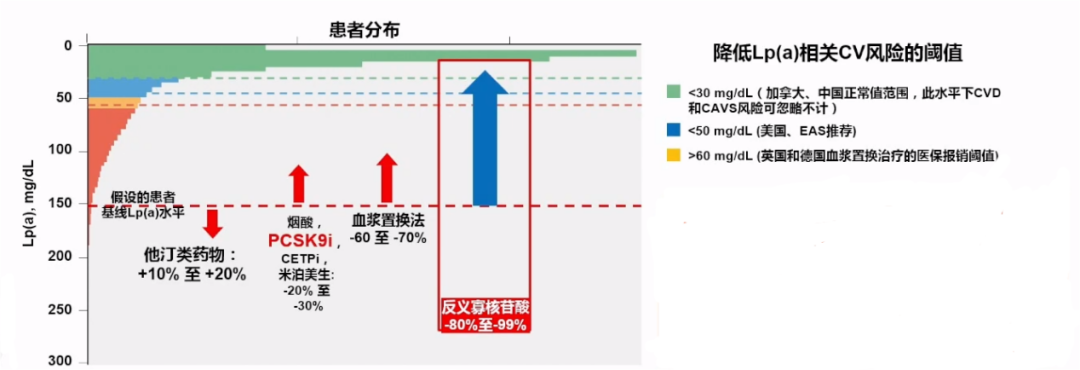
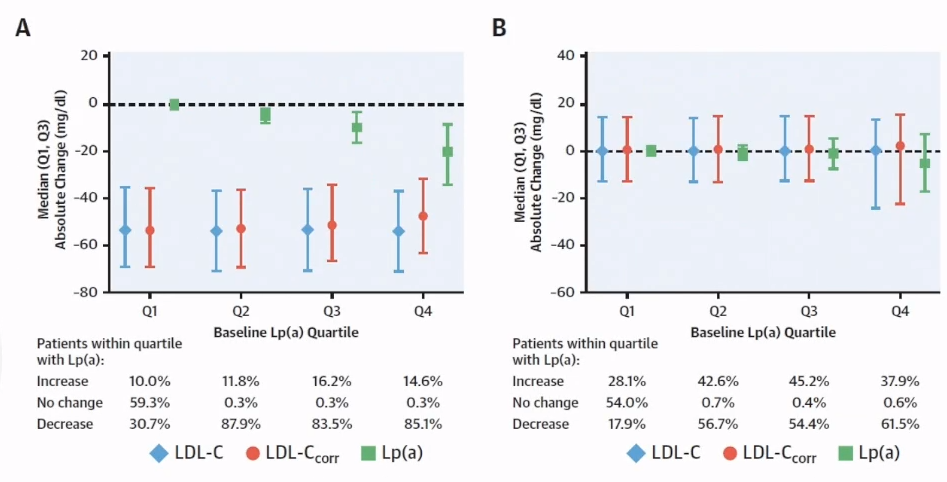
一项关于PCSK9i单抗的FOURIER研究结果显示,PCSK9i单抗使LDL-C平均显著降低50%至60%,同时Lp(a)也适度降低25%至30%。
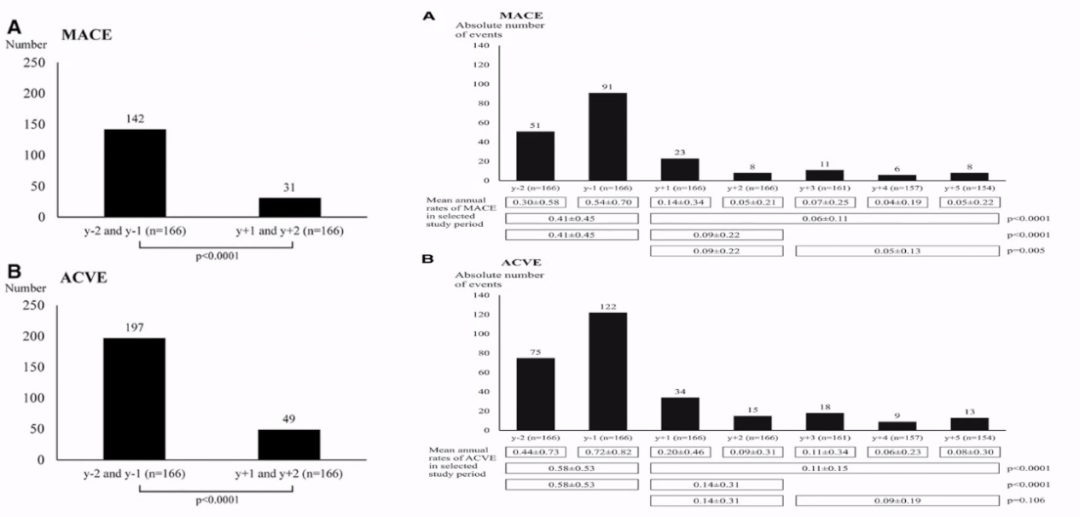
血浆置换降低Lp(a)-60%~-70%,MACE/ACVE-70%~-80%。
2.目前研发中的旨在大幅降低LP(a)水平的新型在研药物

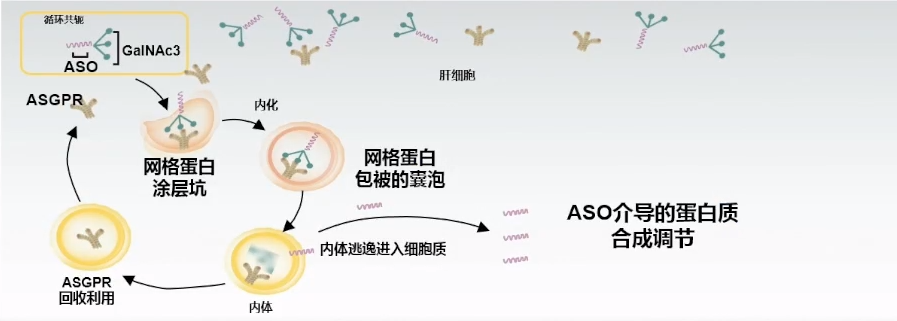
(1) TQJ230(Pelacarsen):通过肝脏GalNAc系统递送,RNA靶向降低Lp(a)
Pelacarsen是一种反义寡核苷酸,与载脂蛋白(a)的mRNA相结合,抑制转录为蛋白质,使Lp(a)降低70-90%。
-
核心成分—ASO(反义寡核苷酸):
Pelacarsen(TQJ230)是由硫代磷酸酯和磷酸二酯键顺序连接由20个核苷酸分子通过化学合成的寡核苷酸单链(混合骨架设计)。
-
化学修饰+递送系统—GalNAc
通过肝脏GalNAc系统递送,RNA靶向降低Lp(a)。这是一项最新的创新,可以增强肝脏摄取药物。
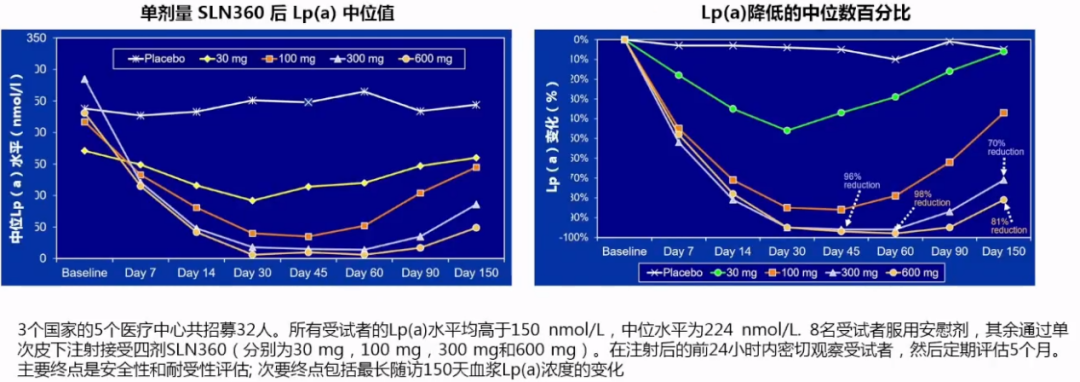
(2)APOLLO研究:siRNA药物-SLN360可显著降低Lp(a)水平
SLN360,一种小干扰RNA,旨在通过靶向降解LPA基因转录的mRNA来降低Lp(a)的产生(即基因“沉默”疗法),接受300mg和600mg SLN360的受试者Lp(a)水平分别降低96%和98%,5个月时与基线相比降低70%和81%。
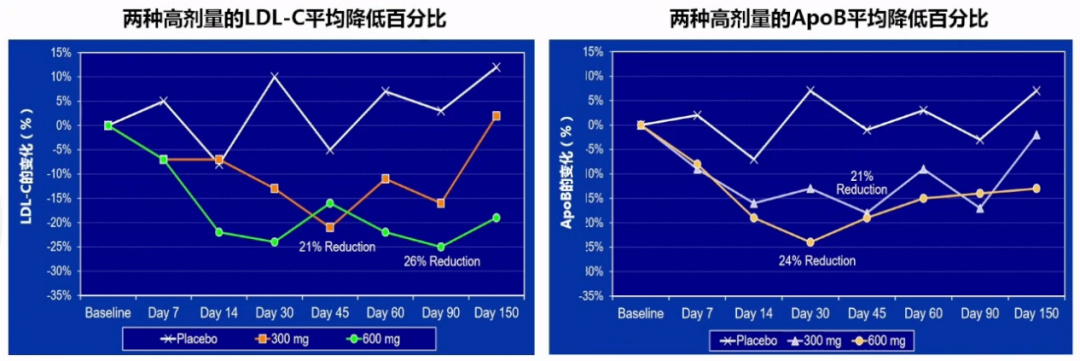
最高剂量(600mg)的SLN360使LDL-C降低21%-26%,最高剂量(600mg)的SLN360使ApoB降低21%-24%。
小结
-
Lp(a)水平主要由遗传因素决定,其他环境条件也在Lp(a)调控中发挥作用;
-
临床上意识到Lp(a)升高很重要,有助于风险管理决策及识别出高危个体;
-
高Lp(a)水平与动脉粥样硬化、血栓形成和主动脉瓣钙化风险增加有关;
-
目前虽然尚无获批药物用于降低LP(a)水平和相关ASCVD风险,但已有一些试验证实降低LP(a)水平有助于MACE事件的减少,研发中的新药有望取得突破!
专家简介

医谱app
扫码或者点击图片下载

微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动