学术分享丨袁祖贻教授:降脂治疗最新研究进展与未来展望
西安交通大学第一附属医院袁祖贻教授以“降脂治疗最新研究进展与未来展望”为题带来精彩学术讲座。
临床上ASCVD一般指广泛的动脉粥样硬化心血管疾病的总称,ASCVD确诊疾病主要包含:急性冠脉综合征、具有心肌梗死的病史、稳定或不稳定型心绞痛、冠状动脉血管重建术(包括介入治疗和搭桥手术治疗)、其他外周动脉疾病或血管重建术后、动脉粥样硬化源性的脑卒中或短暂脑缺血发作,目前ASCVD已成为全球死亡的首位原因。
根据中国血脂异常调查研究(DYSIS-China)数据显示,我国ASCVD患者即使接受降脂治疗,低密度脂蛋白胆固醇(LDL-C)达标率仍较低,其中极高危ASCVD患者尤为严峻,其达标率不足1/3。
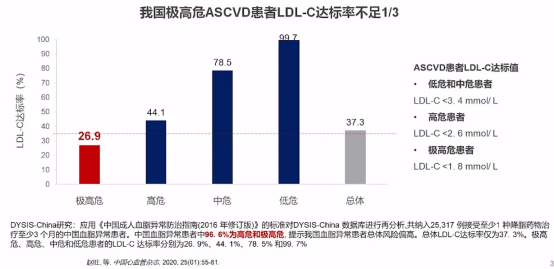
ASCVD患者LDL-C达标率
关于药物应用方面,DYSIS-China提示我国ASCVD患者降脂治疗模式90%左右为他汀单药治疗,且中等强度他汀是最常用他汀治疗当量。
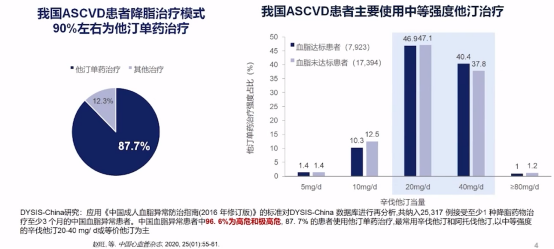
ASCVD患者降脂治疗模式
对于我国极高危ASCVD患者经治疗后,LDL-C水平距目标值差距仍较大,平均差距约40mg/dL(1mmol/L),看出目前他汀单药治疗为主的降脂治疗方案疗效有很大进步空间。
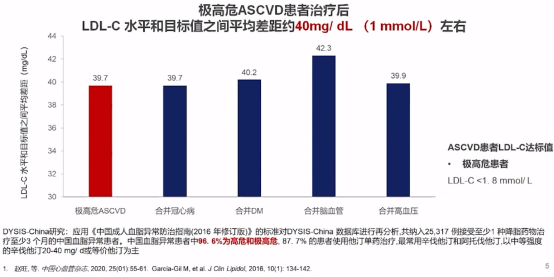
极高危ASCVD患者LDL-C水平距目标值差距大
根据美国真实世界数据调查结果,在使用高强度、低/中等强度他汀和无他汀类药物的情况下,其他药物使用率也不尽人意:Omega-3使用率最高,在8.3%-13.6%;其次是贝特类,使用率在3.8%-5.2%;依折麦布使用率在3.3%-4.9%;新型降脂药前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂初上市,其使用率在0.3%-1.5%之间。
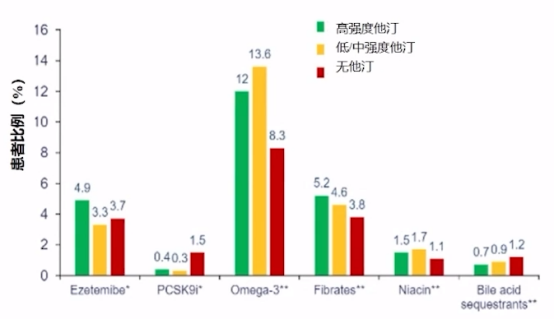
ASCVD患者降脂药物使用率
ASCVD患者LDL-C不达标率有62.4%,即使用高强度他汀类药物治疗,仍有55.6%患者的LDL-C未达标。
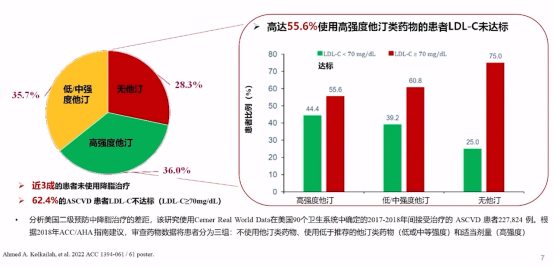
ASCVD患者LDL-C达标率
某些特殊ASCVD患者即使接受中、高强度他汀治疗后,10年心血管事件发生率仍超过30%:其中ASCVD合并糖尿病占比26%-43%,ASCVD合并慢性肾脏疾病占比34%-35%,近期急性冠脉综合征(ACS)占比32%,仍吸烟或高血压控制不佳占比28%-41%。
综上所述,超高危ASCVD患者接受降脂治疗后LDL-C达标率仍较低,部分ASCVD人群再发心血管事件风险更高。而当前较为单一的降脂治疗策略难以满足临床需求,亟需全面评估ASCVD风险,明确更高风险患者,尽早启动联合降脂治疗。
系列新证据推动着血脂管理策略更迭及提出新的LDL-C治疗靶标,根据2017年PCSK9抑制剂(PCSK9i)在极高危人群中远期心血管预后(FOURIER)研究数据显示,依洛尤单抗使LDL-C进一步降低59%,且降脂效果长期维持。
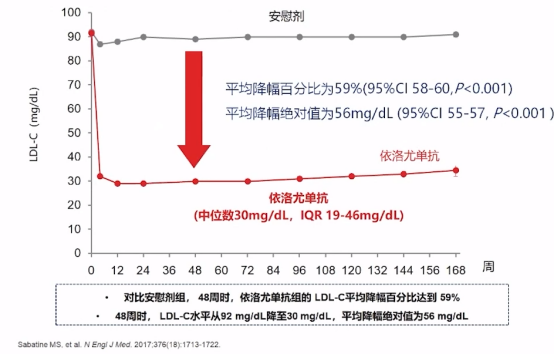
依洛尤单抗降脂效果
研究结果告诉我们,依洛尤单抗治疗较安慰剂显著降低心血管事件风险,其中主要疗效终点事件(心血管死亡、MI、卒中+UA住院/血运重建)下降15%,关键次要疗效终点事件(心血管死亡、MI、卒中)下降20%。
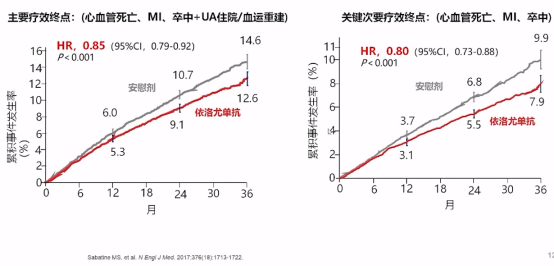
依洛尤单抗心血管事件风险
在另外一项研究中,ODYSSEY OUTCOMES显示阿利西尤单抗可以显著降低LDL-C水平并显著降低主要终点事件风险。
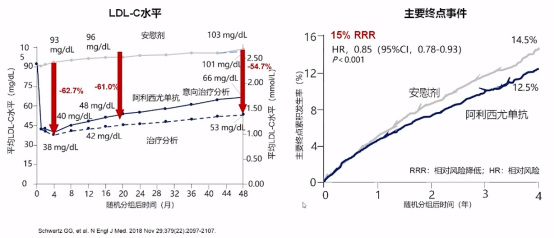
上述两个同类型药物研究所获得结果相似,均已终点事件来判断,效果良好。
2021年HUYGENS研究结果公布,OCT证实依洛尤单抗可改善NSTEMI患者斑块稳定性,研究设计是对161位非ST段抬高型心肌梗死(NSTEMI)患者,在高强度他汀治疗且LDL-C≥60mq/dL,中或低强度他汀治疗≥80mg/dL,或未治疗≥130mg/dL,随后接受最大耐受剂量他汀治疗,用OCT检测斑块稳定性(FCT、脂质弧度、巨噬细胞指数)。

HUYGENS研究设计
在实验结果中,第50周时,依洛尤单抗组最小纤维帽厚度(FCT)增加值和增加百分比约为安慰剂组的两倍,最大脂质弧和巨噬细胞指数明显下降,故在他汀基础上联合依洛尤单抗,可以进一步稳定冠脉斑块。
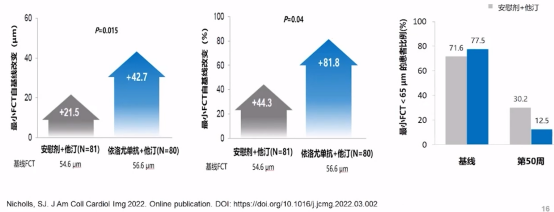
FCT厚度
2022年美国心脏病学会(ACC)公布PACMAN-AMI最新研究,并同步发表在《JAMA》杂志上。该研究旨在探讨急性心肌梗死(AMI)患者在使用高强度他汀的基础上,通过连续多模态评估冠状动脉血管内成像(IVUS、NIRS 和 OCT),观察早期给予阿西利尤单抗对冠状动脉斑块特征的影响。

PACMAN-AMI最新研究
从研究结果中看出,相较非侵入性CT,侵入性血管内超声(IVUS)、光学相关断层扫描(OCT)和近红外光谱(NIRS)更全面精准的评估了斑块体积、成分和形态,尤其在斑块负荷、脂质含量、纤维帽厚度以及巨噬细胞指数等指标上提供精确证据。
实验中借助经典的三种影像学分析方法:IVUS观察斑块负荷、NIRS观察斑块脂质含量、OCT观察纤维帽厚度。
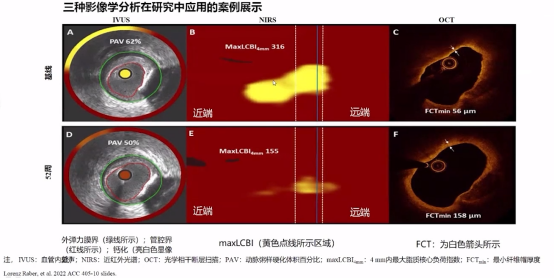
三种影像学分析在研究应用的案例展示
具体实验按照以下研究设计进行操作:
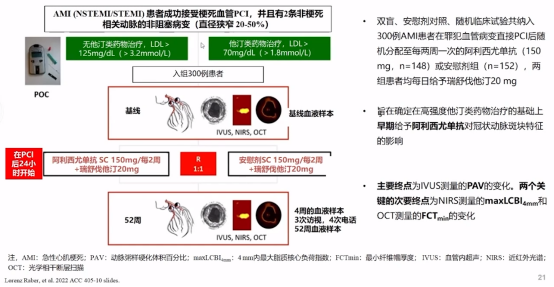
PACMAN-AMI研究设计
可以看到研究主要终点和次要终点的影像学评估如下:
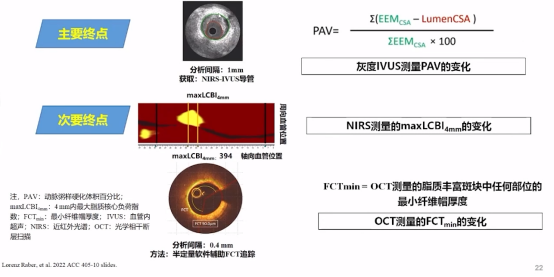
影像学评估
从主要终点得出相比安慰组,阿西利尤单抗组的动脉粥样硬化体积百分比(PAV)、4mm内最大脂质核心负荷指数(maxLCBI4mm)减少2倍。
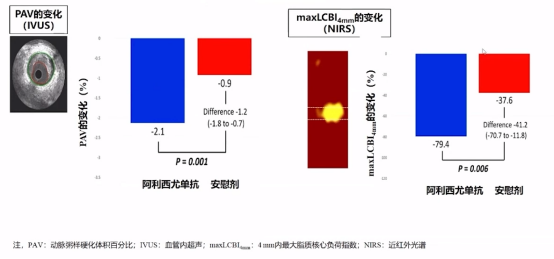
主要终点事件
从关键次要终点看出:阿西利尤单抗组的最小纤维帽厚度(FCTmin)增加2倍,非缺血导致的血运重建(非TLR)比例明显减少。
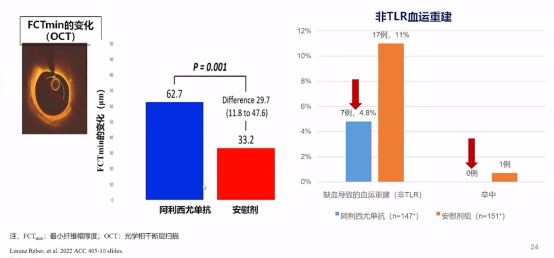
关键次要终点事件
PACMAN-AMI研究的临床意义:三种冠状动脉内成像技术证实PCSK9i对斑块(稳定性)的干预效果,从而减少心血管不良事件的发生率。
上述系列研究也进一步推动了ASCVD患者危险分层的逐步细化,并提出超高危ASCVD的概念。2018年AHA/ACC胆固醇管理指南将临床上ASCVD分为非极高风险ASCVD和极高风险ASCVD*,极高风险ASCVD*是指既往多次主要ASCVD事件或一次主要ASCVD事件合并多种高危因素。

主要ASCVD事件和高危因素
最新国内外指南/共识的更新,推动者降脂治疗策略的革新,对于LDL-C的靶目标值推荐更加严格,2019 ESC/EAS血脂异常管理指南提出了基于总体CVD风险分层的LDL-C治疗目标。
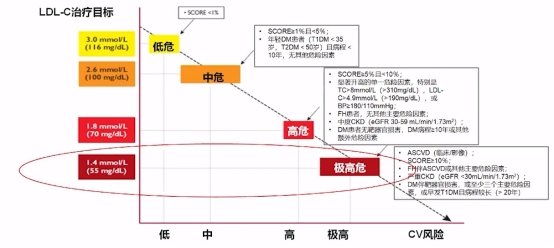
LDL-C治疗目标
目前对于调脂药物的临床研发,例如PCSK9单克隆抗体,PCSK9 mRNA的siRNA抑制肝脏PCSK9的合成,人血管生成素样蛋白3(ANGPTL3)单克隆抗体,以及Lp(a)mRNA的siRNA抑制肝脏Lp(a)的合成也加速了进程。
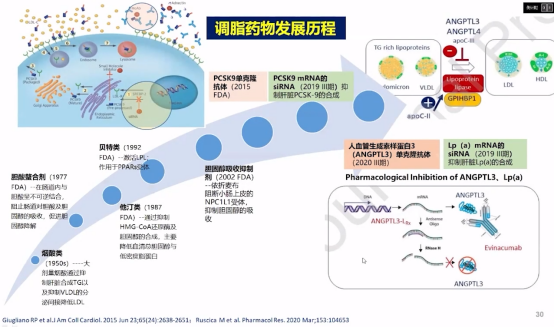
调脂药物发展历程
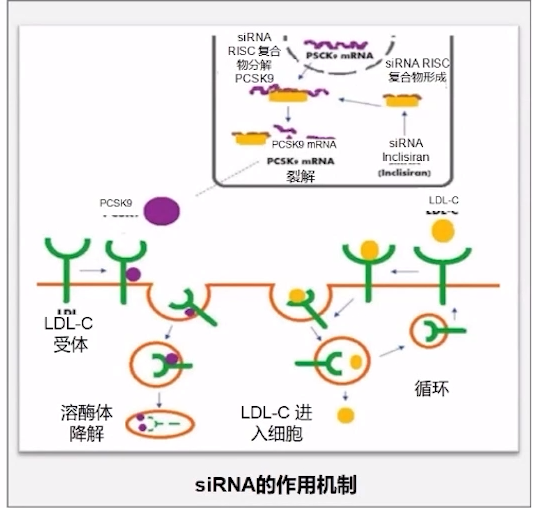
PCSK9 mRNA的小分子干扰RNA药物Inclisiran,主要是抑制PCSK9蛋白质转录翻译过程。siRNA分子遵循RNA干扰(RNAi)的自然途径,在细胞内与RNA诱导的沉默复合物(RISC)结合,从而使其能够裂解特异性编码PCSK9的信使RNA(mRNA);Inclisiran是一种针对PCSK9的长效合成siRNA,它与GalNAc3碳水化合物结合,而GalNAc3碳水化合物能与大量肝脏表达的去唾液酸糖蛋白受体结合,从而使Inclisiran被特异性地摄取到肝细胞中。
ORION 3期研究汇总分析了siRNA PCSK9 Inclisiran对LDL-C的影响,结果显示Inclisiran有效且持久降低LDL-C水平。一年仅需注射两次,可维持LDL-C稳定且大幅度(50%)降低PCSK9、TC及致动脉粥样硬化脂质水平。
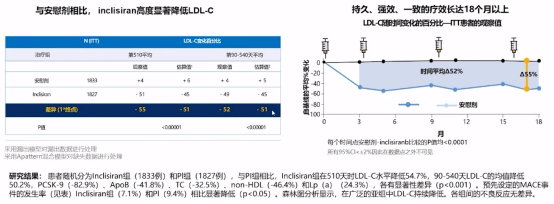
Inclisiran治疗对LDL-C的影响
同时,也可以看到Inclisiran治疗可以显著降低MACE(主要不良心血管事件、心脏骤停复苏、非致死性心梗和缺血/出血性卒中)风险。
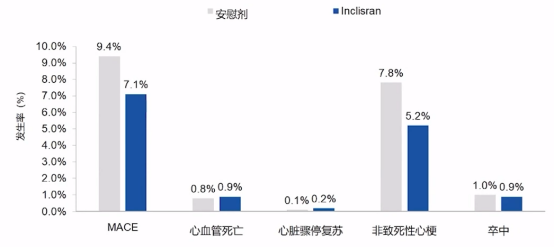
Inclisiran治疗对MACE风险
在ETESIAN研究中,AZD8233靶向PCSK9 mRNA反义寡核苷酸药物,抑制PCSK9蛋白质转录来降低LDL-C水平,并以剂量依赖性降低PCSK9水平。
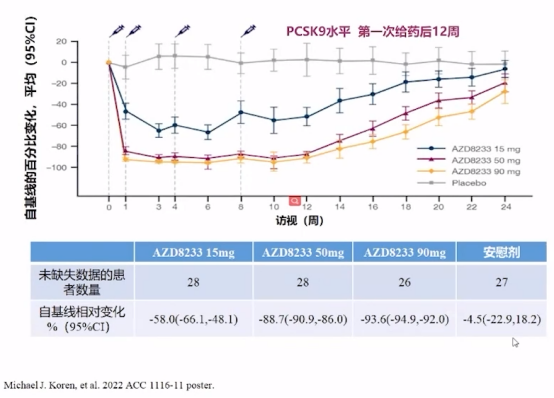
ETESIAN研究
新型降脂药物(Bempedoic acid)BA是一种ATP-柠檬酸裂解酶(ACL)抑制剂,它与他汀类药物在相同的胆固醇生物合成途径中起作用,BA靶向抑制ACL酶(HMG-CoA还原酶上游的一种酶),最终上调LDL受体并降低LDL-C水平。
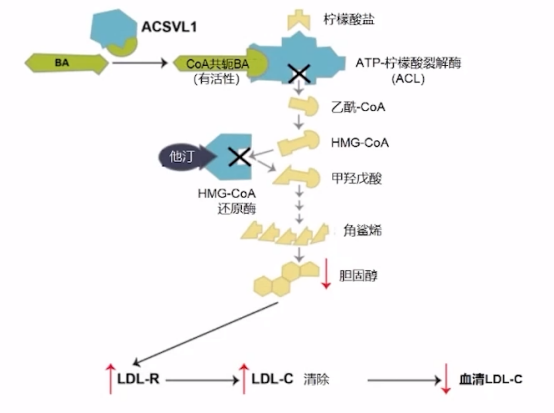
BA作用机制
BA Ⅲ期临床汇总分析:无论背景治疗中是否有依折麦布,它均显著降低LDL-C水平,所以对于他汀不耐受的患者,可以作为一个合理的替代药物。
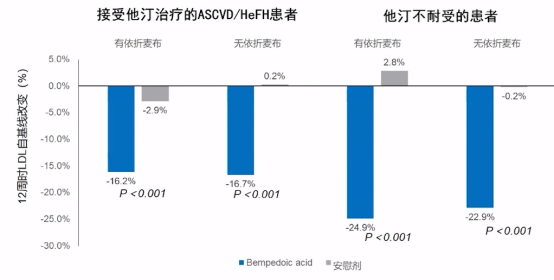
BA临床结果分析
ANGPTL3单克隆抗体-Evinacumab是一种针对ANGPTL3的全人源单克隆抗体,通过抑制ANGPTL3加强对极低密度脂蛋白胆固醇-甘油三酯(VLDL-TG)的降解和清除。
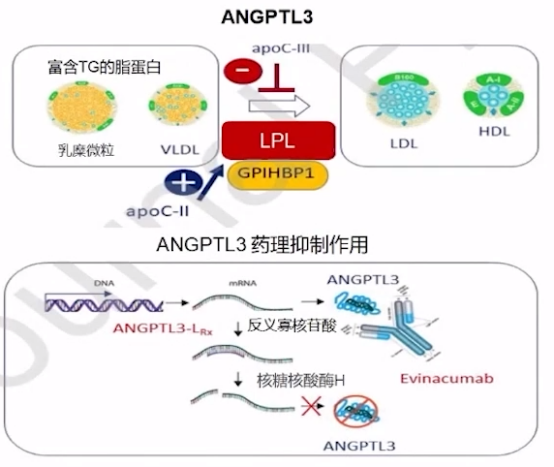
ANGPTL3作用机制
Evinacumab在治疗同型的家族性高胆固醇血症(Ho-FH)患者的研究设计中,除了降低TG外,还加速了VLDL的降解。Evinacumab Q4W还可显著降低Ho-FH患者的LDL-C水平。
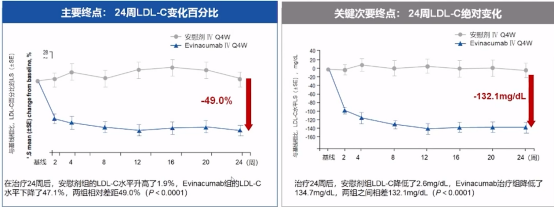
Evinacumab Q4W对LDL-C影响
在TRANSLATE-TIMI 70研究中,ANGPTL3mRNA反义寡核苷酸药物Vupanorsen可以显著降低非高密度脂蛋白胆固醇(非HDL-C)水平。Vupanorsen是一款靶向肝脏中ANGPTL3mRNA的反义寡核苷酸药物,从结果中看出非HDL-C水平下降幅度从60mg Q2W组的下降22.0%到80mg Q2W组的下降27.7%。
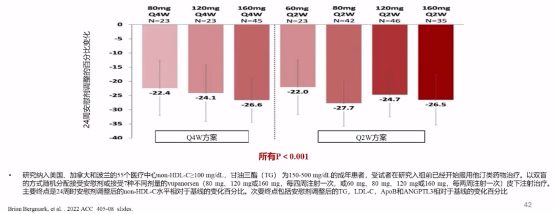
Vupanorsen对非HDL-C影响
此外,Vupanorsen显著降低TG和ANGPTL3水平。结果显示TG呈剂量依赖性降低,下降幅度为41.3%-56.8%(均P<0.001);对LDL-C和ApoB的影响较小;ANGPTL3水平也呈剂量依赖性下降69.9%-95.2%(均P<0.001)。
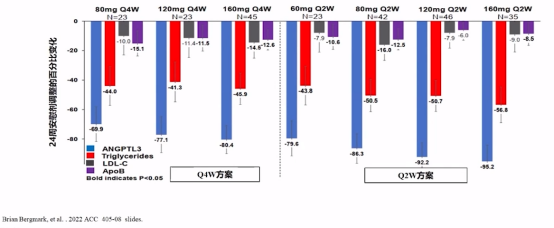
Vupanorsen对TG和ANGPTL3影响
目前研发中,旨在大幅降低脂蛋白脂肪酶(LP)a水平的新型药物主要有两种,分别作用于靶向LPAmRNA的反义寡核苷酸药物和靶向LPA的小干扰RNA药物。
Pelacarsen(TQJ230)是一种反义寡核苷酸,与载脂蛋白(a)的mRNA相结合,抑制其蛋白质转录,使LP(a)降低70-90%。
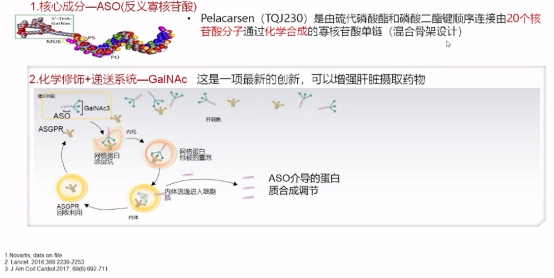
Pelacarsen(TQJ230)作用机制
在APOLLO研究中,siRNA药物SLN360可显著降低LP(a)水平。SLN360是一种小干扰RNA,旨在通过靶向降解LPA基因转录的mRNA来降低LP(a)的产生(基因“沉默”疗法),在接受300mg和600mg SLN360的受试者LP(a)水平分别降低96%和98%,5个月时与基线相比降低70%和81%。
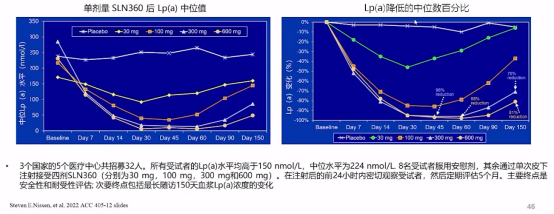
低剂量SLN360对LP(a)影响
同时,高剂量siRNA药物SLN360可降低LDL-C和ApoB水平,高剂量(600mg)的SLN360使LDL-C降低21%-26%,使ApoB降低21%-24%。
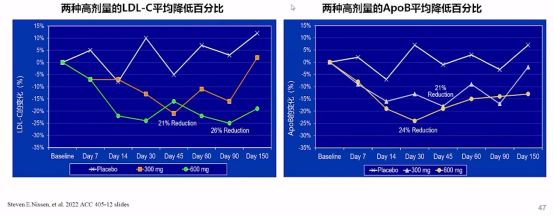
高剂量SLN360对LDL-C和ApoB影响
袁教授最后总结道,目前我国的降脂现状是超过60%的ASCVD患者LDL-C不达标,即使使用了高强度他汀类药物,依旧不理想;当前较为单一的他汀降脂治疗策略难以满足临床需求,高风险的患者尽早启动联合降脂治疗。
而PCSK9i 临床研究新证据推动着血脂管理策略更迭及提出新的LDL-C治疗靶标,FOURIER 研究 和 ODYSSEY OUTCOMES 研究,在大幅降低LDL-C水平同时降低高危ACS患者心脏 MACE事件;以及PACMAN-AMI 研究和HUYGENS 研究中,三种冠状动脉内成像技术显示PCSK9i增加高危ASCVD患者斑块稳定性。
对于其他新型降脂药物研发以及未来应用展望,他介绍了三类型药物:LPAmRNA的小分子RNA干扰药物Pelacarcen(TQJ230)、SLN360可显著降低Lp(a)、LDL-C和ApoB水平;PCSK9mRNA的小分子干扰RNA药物Inclisiran,AZD8233降低LDL-C水平和PCSK9水平;ANGPTL3mRNA的反义寡核苷酸药物Vupanorsen可显著降低非HDL-C、甘油三酯和ANGPTL3水平。