谭安安教授:急性心梗后机械并发症识别与处理

尽管进入再灌注治疗时代后,急性心梗后的机械并发症明显减少,但死亡率仍较高。早期识别并及时干预对于急性心梗后机械并发症的处理至关重要。在“2023亚心国际心血管病大会”上,武汉亚洲心脏病医院谭安安教授作“急性心梗后机械并发症识别与处理”学术分享,医谱学术特将精华内容整理成文,供临床医生参考。

学界对于AMI机械并发症的认知,经历了悠久的历程。1647年,英国William Harvey首次报道并描述了AMI后心脏破裂;1769年,意大利Morgagni收集并报告了11例尸检心脏破裂;1926年,Krumbhaar和Crowell首次明确指出心脏破裂与AMI存在相关性;1970年,美国Hatcher等首次报道心脏破裂的手术成功病例。
AMI机械并发症包括乳头肌断裂(PMR)、室间隔穿孔(VSR)、假性室壁瘤、游离壁破裂(FWR),早期再灌注治疗以及系统性管理STEMI和休克,能有效降低机械并发症的发生率和死亡率,在对STEMI和休克进行系统性管理的时代,AMI机械并发症的发生率已降至0.27%[1]。
APEX-AMI研究[2]显示,AMI机械并发症整体发生率为0.91%(52/5745),其中,FWR发生率为0.52%(30/5745);VSR发生率为0.17%(10/5745);PMR发生率为0.26%(15/5745)。
机械并发症发生机制涉及心肌梗死、胶原降解、血液浸渍、机械应力。研究[2]显示,AMI机械并发症会显著影响患者预后,存活患者整体90d存活率约40%,其中,急性MR存活率为64%;FWR存活率为63%;VSR存活率为17%。
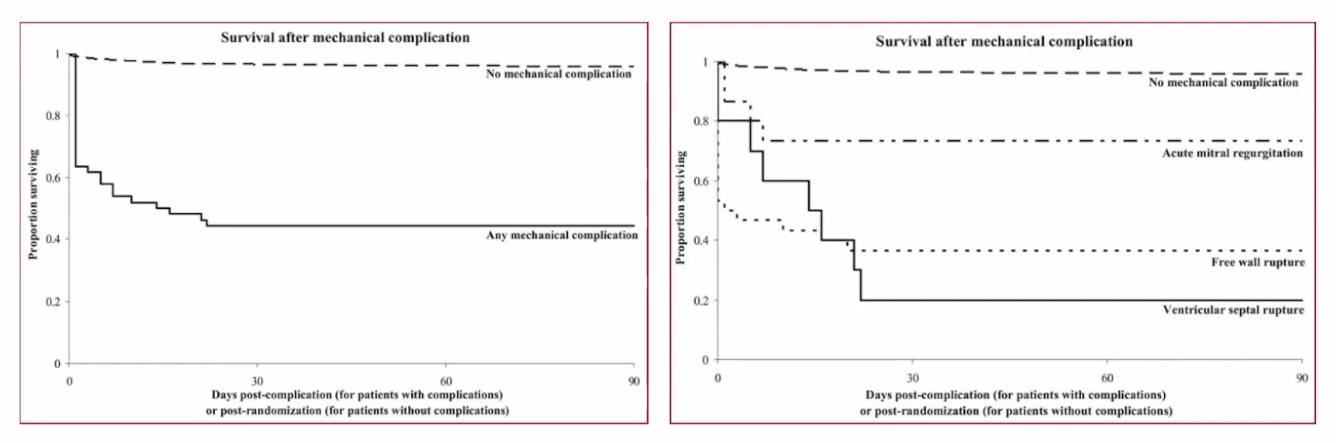
机械并发症存活患者整体90d存活率
与患者一般情况相关的危险因素
与患者一般情况相关的危险因素包括高龄、女性、低体重,具体如下表所示[3-8]。

与患者临床表现相关的危险因素
与患者临床表现相关的危险因素包括首次心肌梗死,前壁心肌梗死,前降支为靶血管,心率快、收缩压低,Killip分级高,具体如下表所示[9-12]。

与患者实验室检查相关的危险因素
有研究[3]发现,白细胞计数(WBC)>109/L的患者,机械并发症的发生率升高2.26倍;血红蛋白(HGB)>120g/L的患者,机械并发症的发生率升高3.45倍。另有研究[13]显示,超敏CRP>100g/L的患者,机械并发症的发生率升高4.56倍。
机械并发症预测模型
陈韵岱教授团队发表的一项回顾性、观察性研究[4]纳入7个中心的11234例STEMI患者,组建了一个基于7个基线临床变量的简单风险评分系统,该模型可识别机械并发症的高风险患者,为临床治疗决策提供参考。
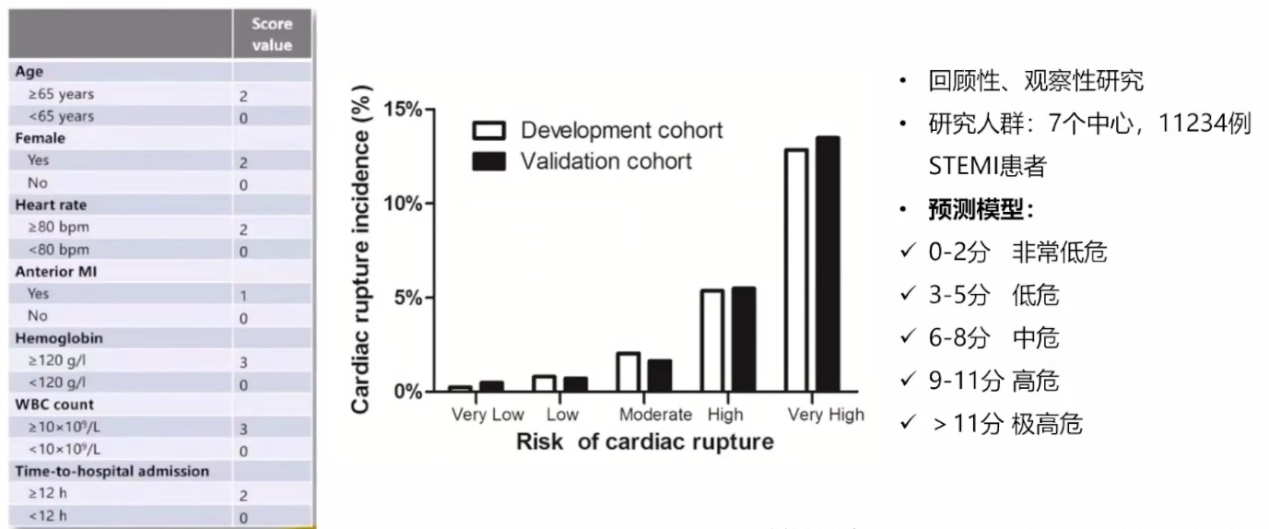
机械并发症预测模型
机械并发症保护性因素
荟萃分析[14]发现,早期使用β受体阻滞剂可使心脏破裂的发生率显著降低32%。
机械并发症的处理工作包括以下四方面:
1)做好患者的评估和转运:评估患者的血流动力学(BP、HR、心输出量等)、临床表现(持续胸痛、意识障碍等)、心脏超声(心包积液、VSR、PMR等),对于确诊或高度怀疑机械并发症的患者,应转入重症监护病房或有心脏手术能力的中心。
2)及早使用机械循环辅助装置:IABP不能改善STEMI患者的预后,不推荐常规使用,但对于因机械并发症导致的血液动力学不稳定的STEMI合并心原性休克患者,IABP可作为辅助治疗手段。对于心原性休克难以纠正的患者,也可考虑短期使用机械循环辅助装置,包括ECMO、LVAD、心室辅助系统或体外循环。
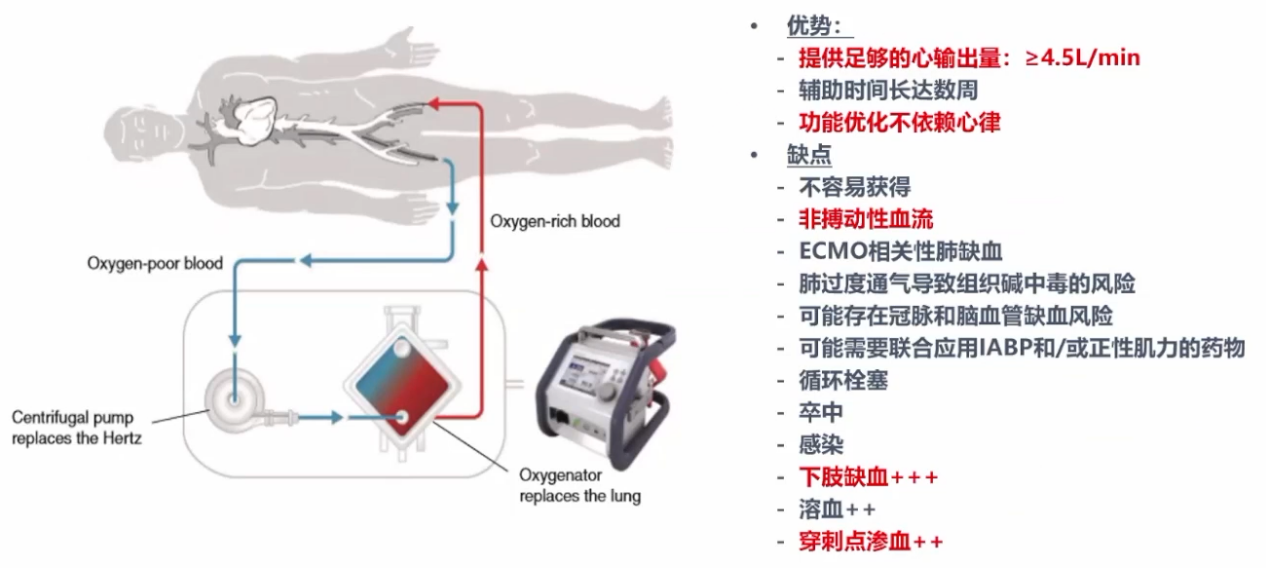
ECMO用于机械并发症引起的难治性休克的优势与缺点
3)紧急外科手术是机械并发症的首选治疗方式[15];
4)多学科联合参与机械并发症的救治[1]。
FWR的处理
多项研究证实,外科手术可改善FWR的预后,应合理选择是急诊还是择期。FWR的处理应基于血流动力学的稳定情况,在临床处理时尚无理想术式,推荐“无缝合修补”,必要时可由ECMO辅助循环。
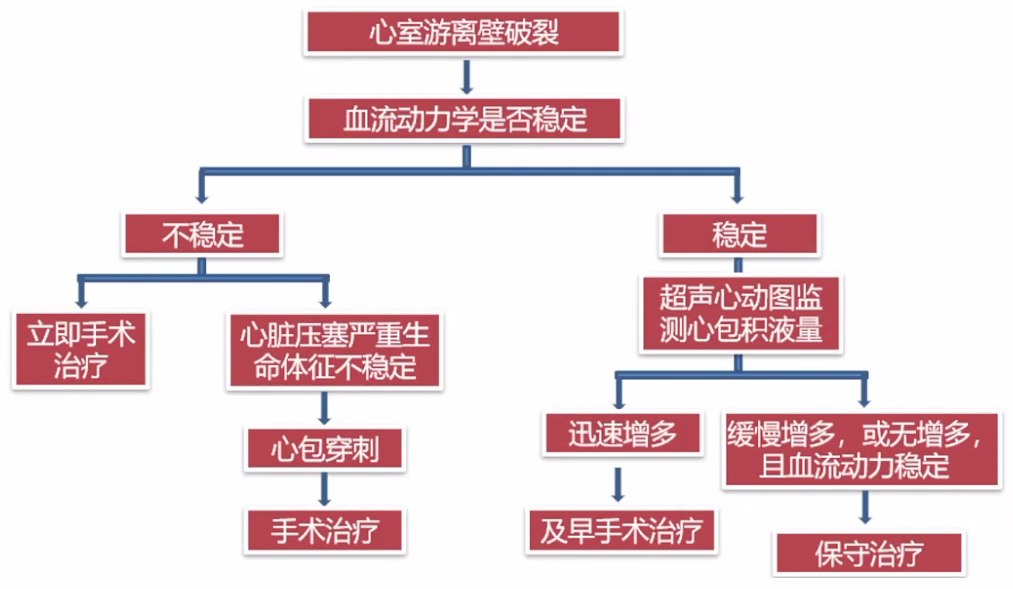
FWR的处理流程
随着医学技术的进步,学界发现一种新型水凝胶能够有力粘附于湿润器官组织表面,在光的控制下迅速成胶,快速修补动脉、心脏等创口,并耐受住血液流动或心脏收缩时产生的压力。实验表明,补心“胶水”的粘附力可以抵抗290mmHg的压力,远高于常规收缩血压(60-160mmHg),这也为AMI后心脏破裂的紧急“修补”提供了可能。

新型生物胶技术紧急处理FWR
此外,既往也曾通过心包腔内注射凝血酶治疗FWR。术中通过高剂量多巴胺维持循环稳定,紧急心包穿刺引流,置入5F血管鞘至心包腔,抽吸450m血性积液,随后注射5000U凝血酶,20ml生理盐水封管。
VSR的处理
既往研究[16]报道,在没有干预的情况下,1/4的VSR患者在24h内死亡,1/2的VSR患者在1周内死亡,2/3的VSR患者在2周内死亡,3/4的VSR患者在4周内死亡,存活超过一年的VSR患者仅有7%。
有研究[17]对STEMI合并VSR的治疗策略展开探索。研究连续入组64例VSR患者,总体人群30d、1年、5年死亡率分别为62%、72%、95%,中位存活时间32d。其中,药物保守治疗组无患者存活时间超过30d,外科手术治疗患者1年存活率48%,5年存活率32%,提示相比于药物,手术能够为患者带来更多获益。
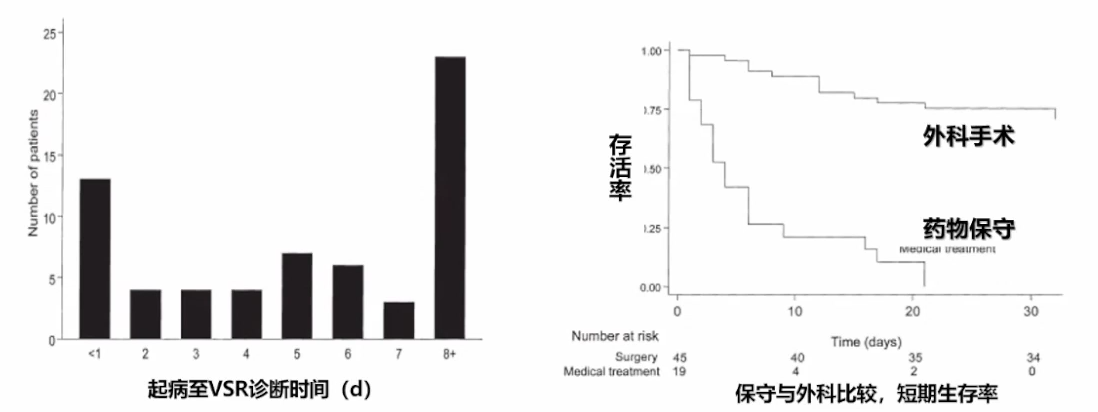
VSR患者药物治疗vs手术治疗的短期存活率
外科手术
在手术治疗中,首选外科修补手术,其在指南中是I类推荐,但平均外科手术死亡率为42.9%。
至于手术的时机,有研究[17]观察了早期(<2d)与延迟(>2d)外科手术对VSR患者1年生存率的影响,结果发现,延迟外科手术(>2d)的1年生存率为64%,早期外科手术(<2d)的1年生存率为38%,P<0.05。
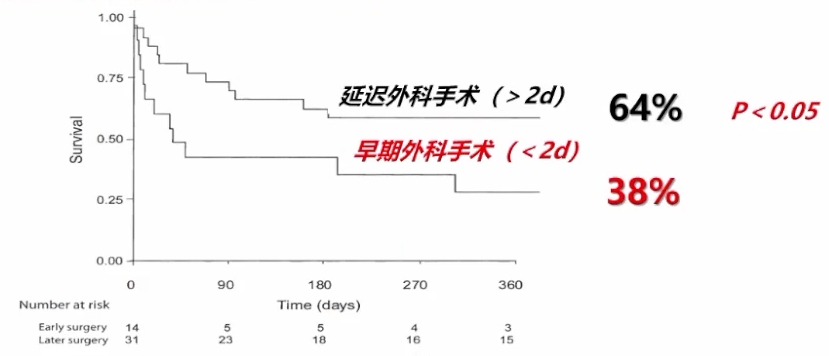
早期(<2d)与延迟(>2d)外科手术对VSR患者1年生存率的影响
亚心医院2001年-2012年AMI后VSR的患者共73例,其中14例行外科手术治疗,手术时间为心肌梗死后4 周、3周、2-3周的患者分别有7例、4例、2例,术后1个月内有34例患者存活,行外科手术的患者均存活[18]。
介入封堵
介入封堵在指南推荐级别IIb类,具有创伤小、成功率高、住院期间病死率低等优点,在有经验的中心,可在选择性病例中开展。
有研究[19]于2001-2011年间在中国5个大型心脏中心纳入35例VSR患者进行介入封堵术。其中,13例实施急性期封堵(指发生VSR 2周内,平均时间5d),22例慢性期封堵(发生VSR>2周,平均时间23d),住院期间死亡率为14.3%,3年随访存活率为100%,5年随访存活率可达到93.3%(28/30)。
关于急性期与慢性期封堵的临床预后比较,一项来自美国的单中心研究[20]在1988-2008年间纳入30例VSR患者开展介入封堵术。其中12例初始治疗为介入封堵,18例患者初始治疗为外科修补后发生残余分流,需再次介入封堵干预。研究中30d手术死亡率为42.9%,其中急性期组66.7%,择期组6.1%(p<0.01)。
根据亚心医院的经验,出现以下情况时首选介入封堵术:
✔ 直接PCI术后晚发VSR或冠脉病变适合行PCI治疗;
✔ 高龄或拒绝外科手术治疗;
✔ VSR直径:破裂孔直径≤15 mm;
✔ 外科术后大量残余分流。
谭教授指出,合并心原性休克或血流动力学不稳定,可实施紧急介入封堵术,但急性期死亡率高,建议尽可能在慢性期实施介入封堵(诊断VSR 2周后)。残余分流是介入封堵术后最常见并发症,随访过程中可逐步改善。
此外,2015年AHA、2017年ESC、2019年中国STEMI管理指南提到,STEMI起病12 h以内,如发生VSR、二尖瓣乳头肌功能不良,血流动力学相对稳定时,可在充分告知病情后,给予PPCI治疗,术中可考虑置入IABP,必要时ECMO以降低介入治疗风险。及时血运重建治疗能减轻左室不良重构,可能改善二尖瓣乳头肌血液供应或避免因VSR直径继续延展而失去介入或者外科治疗的机会。
乳头肌断裂致急性MR的处理
在2021 AHA科学声明[1]中,针对乳头肌断裂致急性MR的处理,紧急外科手术是首选。但对于选择性病例,也可实施TEER。

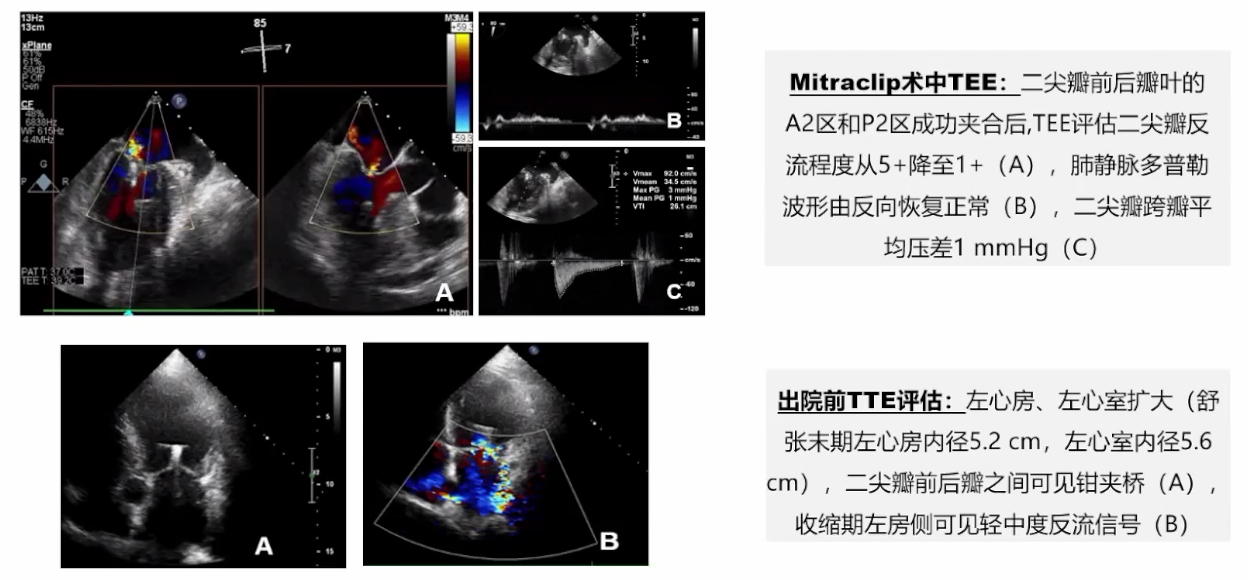
STEMI合并乳头肌断裂直接PCI术后择期Mitra clip一例
AMI机械并发症是少见的并发症,病情凶险,死亡率高。对于高危患者,要积极评估机械并发症的可能,加强与患者家属沟通。AMI在治疗过程中需要积极血运重建,尽早使用β受体阻滞剂,减少机械并发症的发生。在药物治疗基础上,应及早使用IABP等器械循环支持,以稳定血流动力学。适时外科手术、介入治疗是提高AMI机械并发症患者存活率的关键。
文中图片均来自授课幻灯
本文为医谱学术原创文章,转载请标注来源
专家简介





发表留言
暂无留言
输入您的留言参与专家互动