廉诚教授:封堵术后残余分流的鉴别及处理

残余分流是左心耳封堵术后一种常见并发症,是指封堵器装置与左心耳壁之间任何宽度的残余血流。左心耳结构复杂,根据使用的封堵器械或采取的手术策略,造成残余分流的部位和特征也有所差异。近期西北大学附属医院·西安市第三医院廉诚教授在第九届西北心血管病大会暨第五届心血管创新与转化研讨会(NWCC 2024)上就左心耳封堵术后残余分流的机制、影响因素及处理方法进行详细讲解,医谱学术特此整理,以供临床参考。
残余分流机制
左心耳封堵术后,残余分流现象在临床上较为常见。随着技术的进步,WATCHMAN等封堵器在实际应用中的残余分流情况相比早期研究已有显著改善。
此外,采取不同的左心耳封堵方法会导致残余分流的表现各异。WATCHMAN植入术后通常出现偏心性残余分流,而ACP封堵器植入则多见周围性残余分流。对于经皮心外膜结扎术及外科结扎术,术后常见中心残余分流,而外科切除术和外科夹闭术后几乎无残余分流发生。这表明不同术式在左心耳封堵中的效果和特点各不相同。
由于左房的解剖结构不同,不同类型的封堵器可能会有不同的残余分流发生机制。心耳口部形状不规则,塞式封堵器通常通过扩展尽量使其“撑圆”,从而更好的和左心耳贴合达到较好的封堵效果,TEE更容易识别残余分流。盘式封堵器受限于心房的天然解剖结构,TEE可能不易识别。
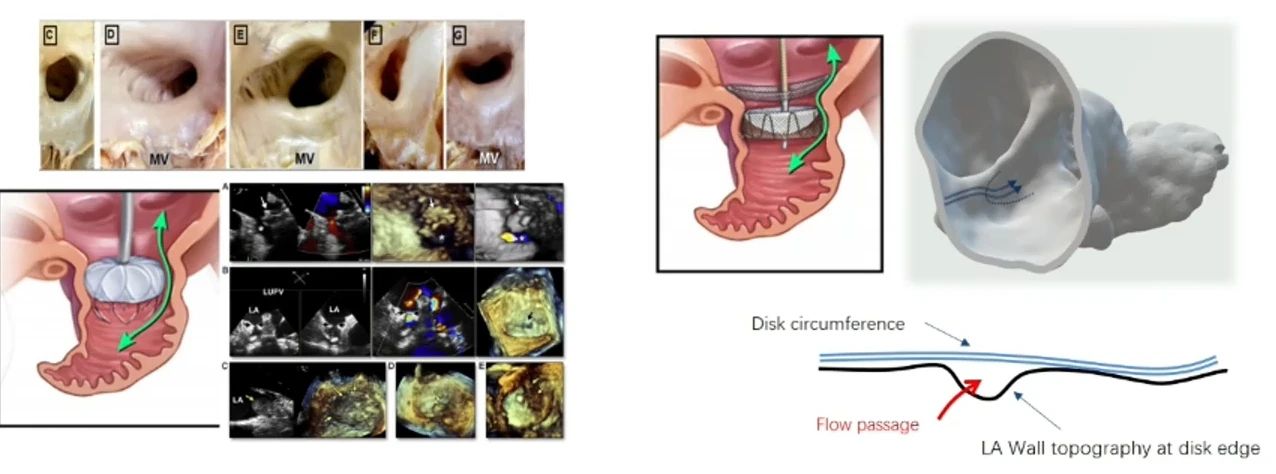
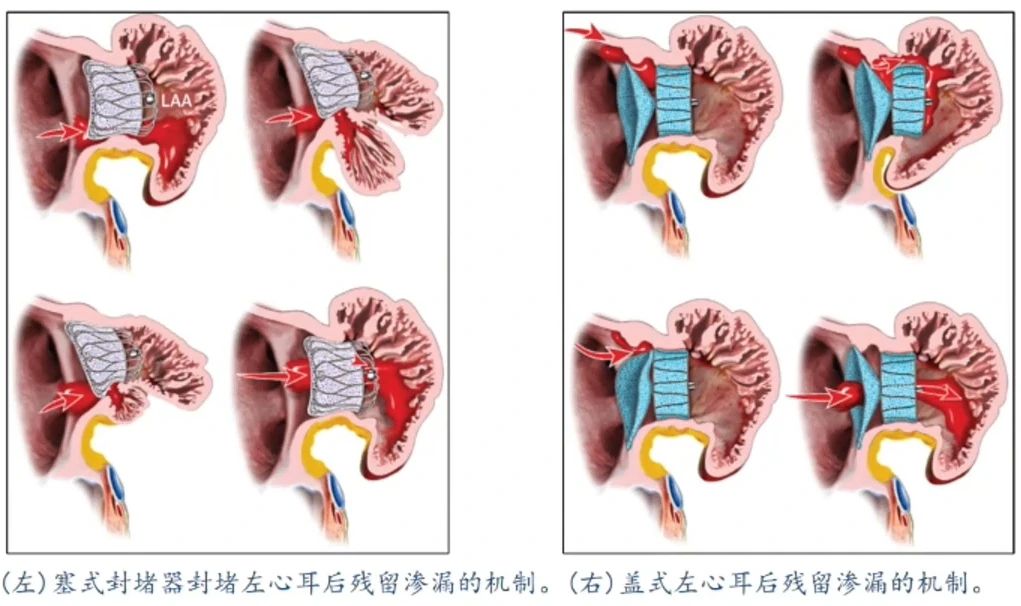
导致残余分流相关因素
研究1
一项单中心回顾性研究将101名受试者分为长期持续性心房颤动(LSPAF)组(n = 48)和非 LSPAF 组(n = 53)并进行比较。
根据残余分流的严重程度可分为:微量(<1mm)、轻度(1-2.9mm)、中度(3-5mm)、重度(>5mm)。两组患者的残余分流发生率在封堵器植入后至6周随访期间均有所增加,尤其是在LSPAF患者中,<5mm的残余分流发生率显著上升。
总体而言,LSPAF患者术后残余分流的发生率更高。可能导致残余分流的因素包括:植入后左房和左心耳的重构、器械尺寸过小以及盘式封堵器轴向不对齐等。

研究2
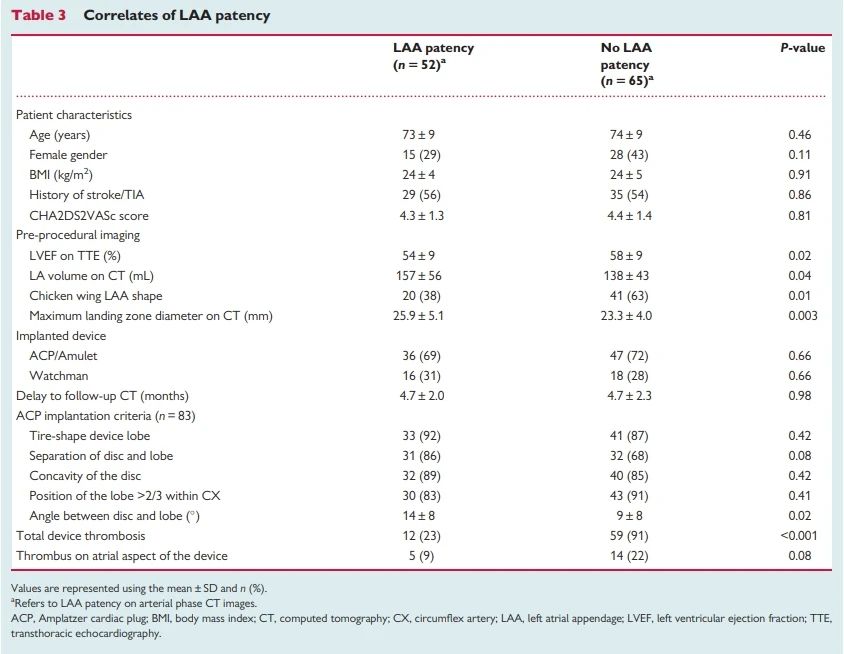
另一项2020年的研究通过对CT数据的分析,发现术后易于产生残余分流的患者通常具有以下解剖特征:左房容积较大、左心耳开口直径较大、以及非鸡翅形的左心耳形态。
此外,盘式封堵器的残余分流可能与外盘与分叶之间存在一定角度有关。
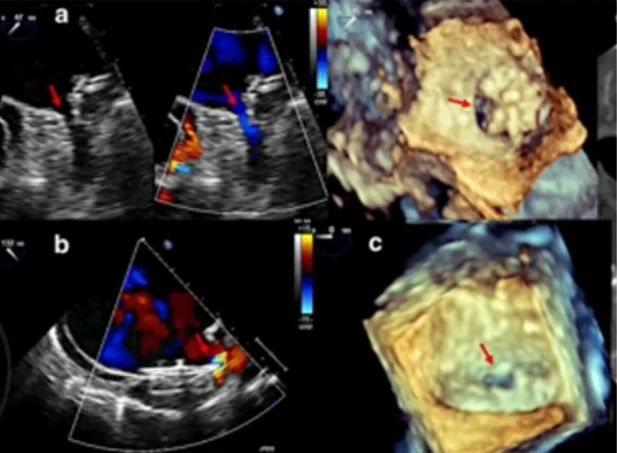
研究3
在一项纳入117名患者的研究中,受试者分别植入了ACP、Amulet和WATCHMAN封堵器。研究结果表明,具有残余分流的患者通常在基线特征上表现为左心室射血分数(LVEF)降低、左房容积较大、左心耳呈非鸡翅型结构、着陆区直径较大。
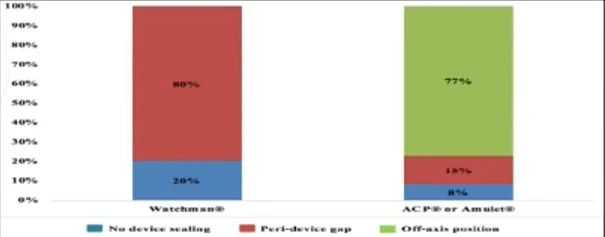
在器械选择方面,ACP和Amulet封堵器的残余分流主要发生于分叶与封堵盘之间角度较大的患者中。研究数据显示,ACP/Amulet封堵器的残余分流发生率高于WATCHMAN封堵器(36% vs 16%)。
研究4
一项研究纳入125例植入WATCHMAN封堵器的患者,在术后45天通过TEE确认有53例存在残余分流。
研究结果表明,TEE、CT和DSA测量的左心耳长度及开口直径与术后残余分流的发生密切相关;压缩比与残余分流并无明显相关性。
值得注意的是,术后即刻出现的残余分流可能随着内皮增生、微血栓形成及纤维组织覆盖填充残余分流腔隙而逐渐缩小或完全封闭。

残余分流是否影响临床结局
研究1
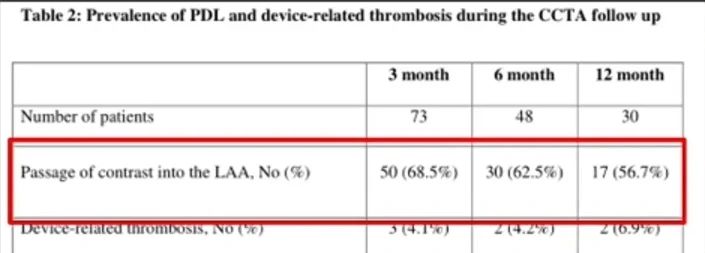
在一项涉及77例患者的研究中,植入了Amulet封堵器(n=24)、ACP封堵器(n=37)和WATCHMAN封堵器(n=16)。通过3个月至12个月的冠状动脉CT血管造影(CCTA)随访观察,发现残余分流发生率从68.5%逐渐下降至56.7%。研究表明,随着时间的推移,残余分流逐渐减小。
研究2
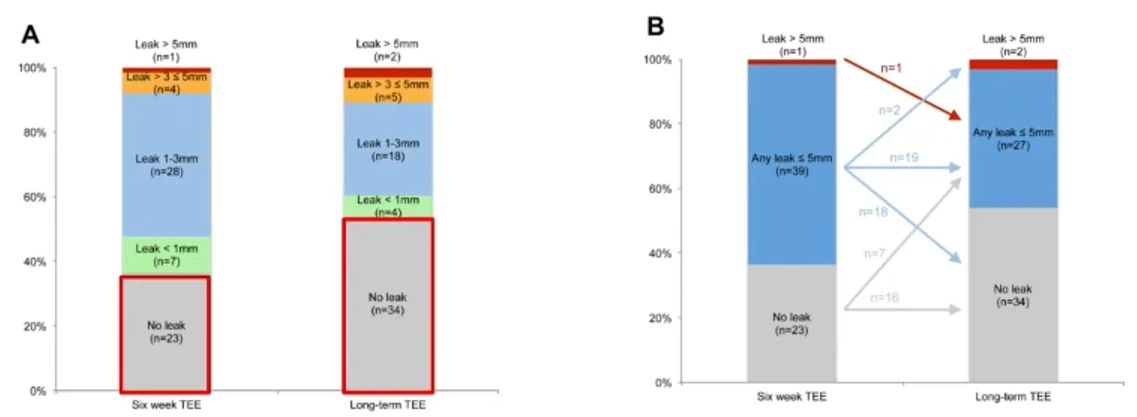
在一项随访3年的研究中,与6周随访相比,长期TEE随访(中位时间3.1年),残余分流量逐渐减小。这一发现提示,残余分流可能在术后随时间自然减少。然而,尚需通过更大规模的前瞻性试验进一步评估,在左心耳封堵术后的短期TEE随访中,是否可以将一定大小的残余分流作为指标,用于指导超过12个月的长期TEE随访,从而评估晚期残余分流的并发症风险。
研究3
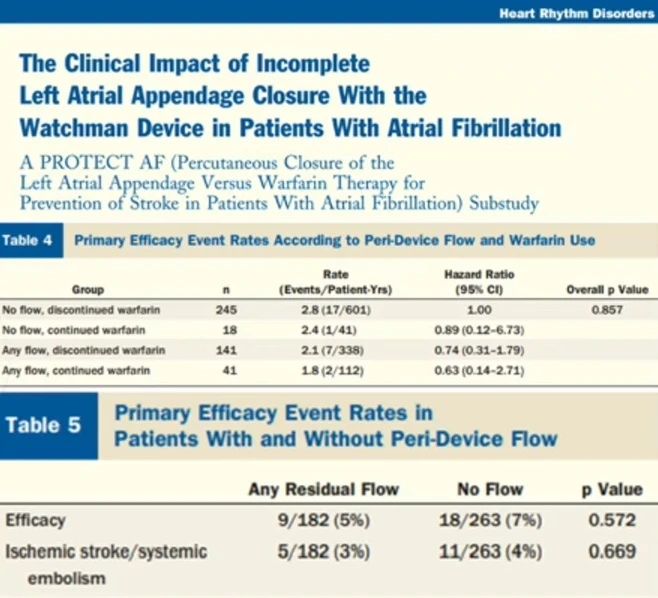
根据PROTECT AF研究结果,WATCHMAN左心耳封堵术后即使存在残余分流(≤5mm),也未显示增加栓塞风险,且在有效性方面未见统计学上的显著差异。然而,由于研究中事件发生率过低,可能对检验水准产生一定影响。
研究4
2022年一项研究显示,使用WATCHMAN装置关闭左心耳后,残余分流≤5mm与缺血性卒中或全身性栓塞的风险增加相关。值得注意的是,≤5mm与不良结果的关联主要在植入后一年内显现,而非仅在术后45天内。这一现象可能部分归因于残余分流在术后随时间变化,以及在此期间抗血栓治疗方案的调整。这些发现表明,手术时,操作者应尽可能优化设备的放置位置,以降低残余分流的发生。

研究5
在一项纳入51,333名患者的大型研究中,37,69 名(73.4%)无残余分流,13,258名(25.8%)有少量残余分流,379名(0.7%)有大量残余分流。

患者基线特征差异不大,但具有统计学差异;在深度镇静、ICE的使用、射线量、造影剂用量、住院期并发症方面没有差异。
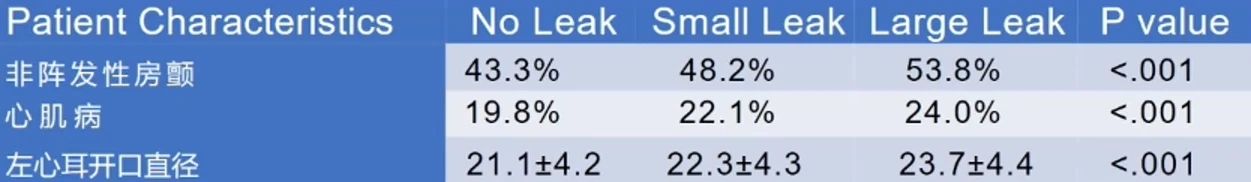
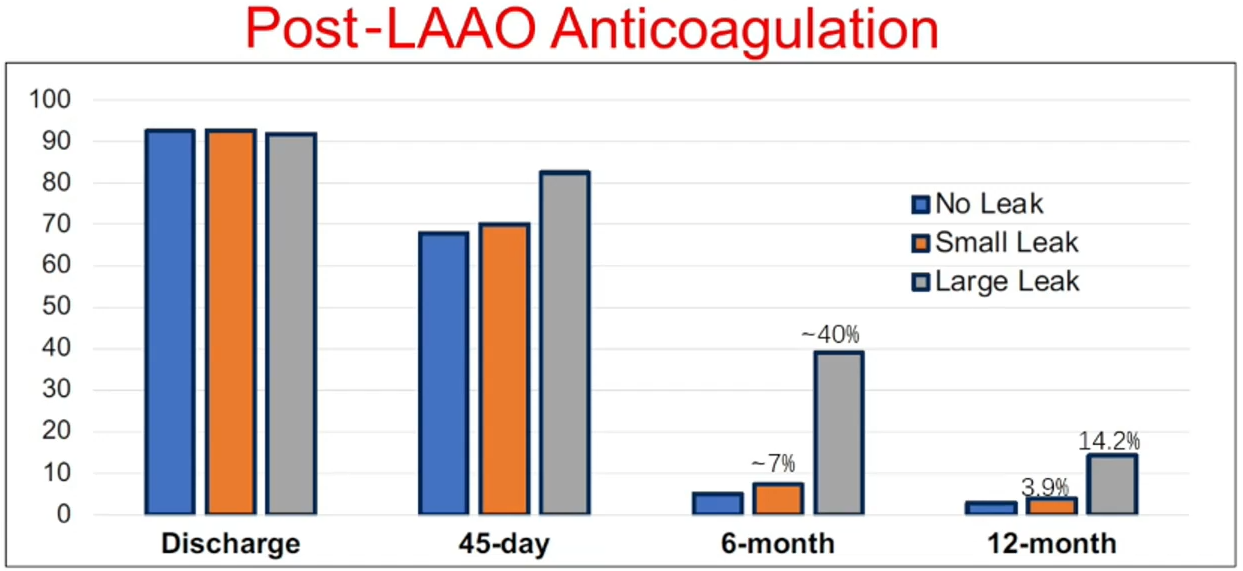
术后45天、6个月、12个月的随访发现,随着时间的延长,残余分流的比例呈整体下降的趋势。
在生存分析中,可以看到在主要终点上,小分流患者发生率高于没有分流的患者,存在统计学差异。但大分流患者发生率虽然高于没有分流的患者,但是没有统计学差异。考虑可能是由于这部分患者中有部分患者仍然应用抗凝,且这部分患者样本量过小。
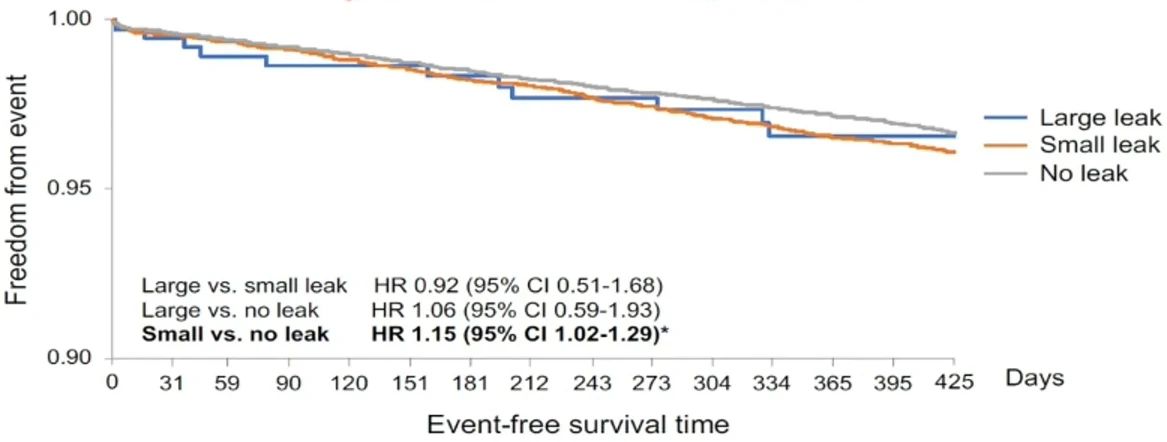
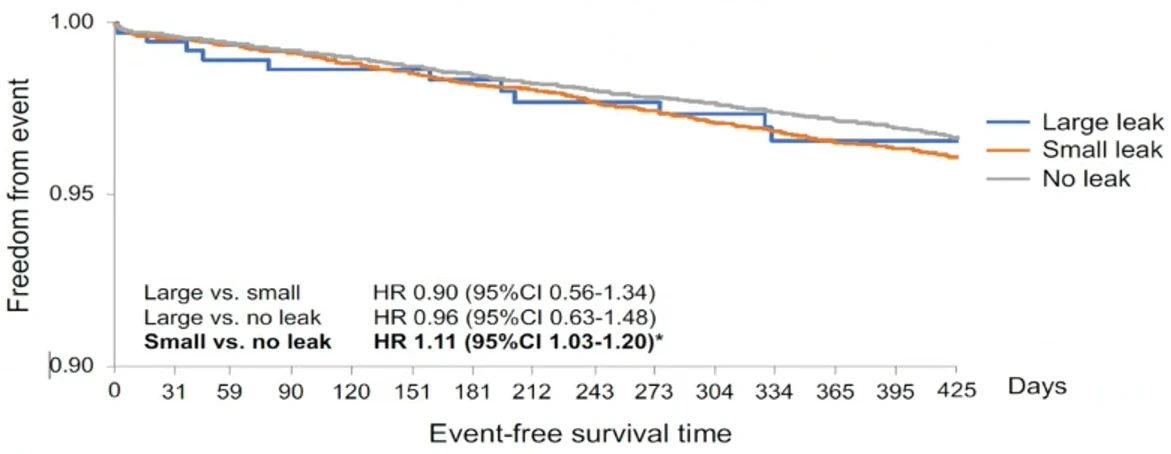
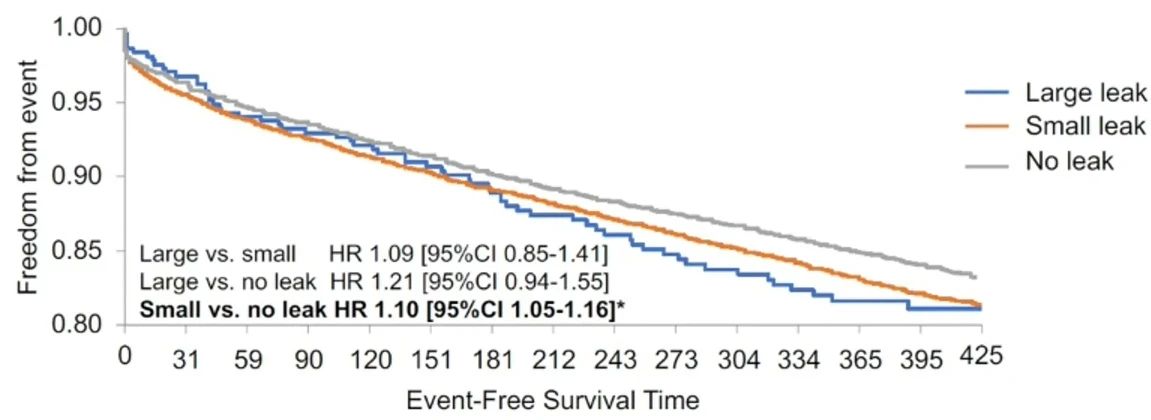

大样本研究表明,残余分流可能对临床结局产生一定影响,目前缺少研究性试验验证。但左心耳封堵术后血栓栓塞事件在各组患者中均较少见,表明残余分流的实际影响有限。我们应密切关注残余分流情况,强化术前评估和术后随访,同时深入理解左心耳的结构和残余分流的发生机制,以最大化患者的临床获益。
残余分流如何进行干预管理
残余分流的干预措施包括:药物管理、更优化的器械选择、介入治疗等。
药物
为了准确评估残余分流情况,需要通过多个切面进行全面检查。在2D TEE中,应对封堵器的边缘进行完整评估,以确保残余分流的准确判定。对于残余分流大于5mm的患者,建议继续使用口服抗凝药物(OAC)以预防血栓形成。

器械
器械的优化也有助于减少残余分流。WATCHMANFLX更优化的骨架设计,增加了80%的与心耳接触的面积,更致密的骨架结构增加了封堵器对左心耳的贴合。在研究当中,一年随访时,89.5%的左心耳完全封堵,无任何残余分流。

介入
对于残余分流大于5mm的患者,处理方法包括多种介入技术,例如使用第二个封堵器、血管塞、可拆卸线圈、射频消融,或这些技术的组合。其中,Amplatzer血管塞和Amplatzer导管闭塞器(Abbott Vascular)是目前最常用于处理残余分流的设备,能够有效封堵分流以改善治疗效果。
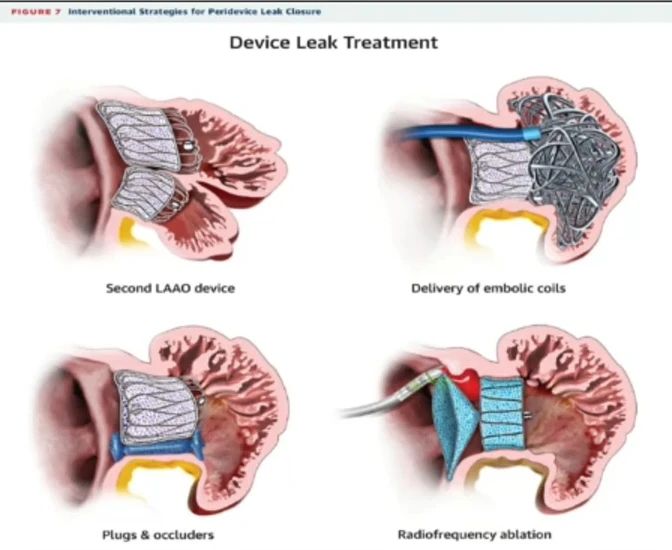
在选择弹簧圈封堵残余分流时,应根据残余分流的大小、栓塞事件的发生情况以及出血风险(如CHA2DS2-VASc评分≥3和HAS-BLED评分≥3)进行评估。此外,具有口服抗凝药物禁忌证(如有显著出血史),需要长期双重抗血小板治疗或在左心耳已封堵或切除的情况下仍发生栓塞事件的患者,也可选择弹簧圈封堵残余分流。

弹簧圈的规格和数量的选择取决于左心耳的具体解剖特征,包括左心耳及残余分流的大小,以及左心耳分叶的数量。这些因素共同决定了适合患者的封堵策略,以确保最佳治疗效果。
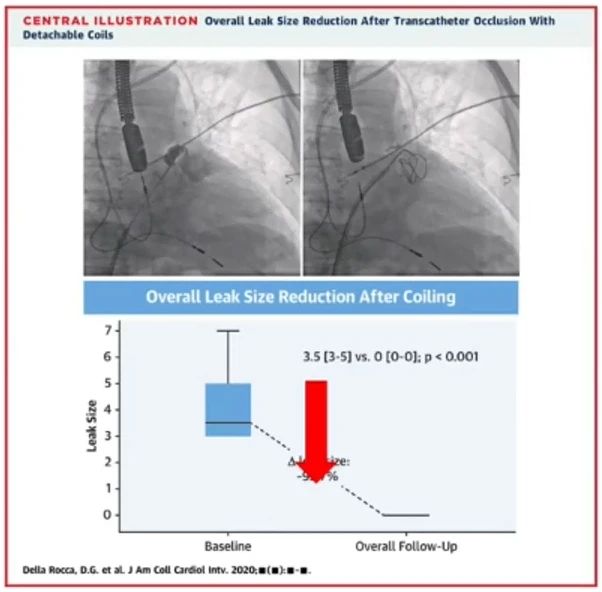
2020年一项研究结果显示,在所有30例患者中,弹簧圈封堵显著减少了残余分流,使超过90%的患者左心耳实现了完全或接近完全封堵,残余分流整体减少约93%。在随访期间,未发现与器械相关的血栓形成、弹簧圈位移或栓塞事件。
总结
不同类型的封堵器在残余分流的发生机制上存在差异,而CT可能是更为敏感的检测手段。研究显示,较小的残余分流通常会随着时间的推移而减小,而较大的残余分流则可能不会发生明显变化。在大样本量的研究中,残余分流与临床结局呈正相关,但总体事件发生率较低,因此应加强对患者的随访。针对残余分流的处理,继续进行长期OAC治疗是可行的。此外,具有口服抗凝药物禁忌证(如有显著出血史),需要长期双重抗血小板治疗或在左心耳已封堵或切除的情况下仍发生栓塞事件的患者,也可选择弹簧圈封堵残余分流。

长按识别二维码 看本次授课精彩回放
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动