庄晓东教授:功能性二尖瓣反流TEER的临床研究进展

导读
在心血管疾病领域,功能性二尖瓣反流(FMR)一直是备受瞩目的研究热点,其复杂的病理生理机制与对患者预后的深远影响促使学界不断探索更为有效的治疗策略。经导管二尖瓣缘对缘修复术(TEER)作为一项新兴的微创介入技术,为 FMR的治疗带来了革命性的变化,近年来相关临床研究呈蓬勃发展之势。然而,就现阶段而言,在FMR患者实施TEER治疗的实践过程中,临床依旧面临诸多亟待厘清与攻克的关键问题,具体包括患者筛选标准的精准界定、手术介入时机的把控、手术策略的精细规划等。
近日,中山大学附属第一医院庄晓东教授以“功能性二尖瓣反流TEER的临床研究进展”为题,就此展开了深入分享。医谱学术特此整理,以供临床参阅。
FMR病变在心肌,具有多种表型
减少反流是有效治疗
庄晓东教授开篇回溯了FMR与TEER之间的内在关联。他指出:
-
FMR的病源根基在心肌组织,这是其病理本质特征。
-
FMR属于进展性的心血管疾病,其病程演进呈现出从心室逐步累及心房,进而引发三尖瓣处肺压力传导升高,这些体征表现是判断病情发展阶段的关键指征,同时也为临床干预时机的抉择提供了重要依据。
-
依据心房心室的结构差异细分亚型,FMR可归类为室性与房性两大类别,其中,房性作为独立分支存在,而室性又进一步细化为等比例与不等比例两种亚型,这种精细分类对于精准诊疗意义重大。
1
COAPT
研究
COAPT研究、MITRA-FR研究以及RESHAPE-HF2研究是FMR TEER的临床研究进展的三个重要研究。其中,MITRA-FR研究是一个阴性结果,因为其入组患者反流程度不重,心室更大。COAPT研究则是一项不等比例的研究,最终呈阳性结果。研究回答了几个关键问题,具体如下。
问题1:减少反流是否始终能达成有效治疗目的?
既往认为反流越重,预后越差。那么,是否可以推断减少反流会改善预后?换句话说,以反流作为治疗靶点,其效果是否会更佳?从过去研究的汇总结果来看,在使用器械进行单纯瓣叶夹合时,无论是使用MitraClip还是PASCAL device系统,都能显著减少反流。而大多数药物、PCR、CRT甚至射频消融等,对反流的作用强度不如TEER。
从既往研究数据来看,降低二尖瓣反流(MR)程度的确能够使患者病情有所改善。具体而言,MR程度降低一个等级与降低两个等级所带来的改善效果相近;然而,倘若术后MR程度达到三个等级甚至更高,那么患者的预后往往较差。
由此可见,将减少反流作为一项合理的治疗策略具有一定的依据。
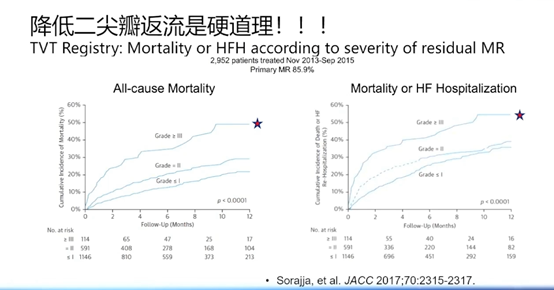
问题2:究竟哪部分患者应当纳入降低反流的治疗范畴,又该依据何种标准对其加以筛选?
COAPT研究针对这一关键问题给出了极具分量的解答。
(1)符合“3个7”标准的患者群体更适宜接受TEER治疗。“3个7”标准具体是指:患者左心室收缩末期内径需在70mm以内,肺动脉收缩压在70mmHg以内,同时左心室射血分数处于20%~50%,亦即在70%以内。符合“3个7”标准的患者,在对其实施TEER手术后,其疗效显著优于药物治疗;不符合“3个7”标准的患者,TEER的疗效与药物治疗大体相仿。
(2)对于不符合COAPT研究纳入标准的患者,若强行实施TEER手术,尽管患者的预后可能欠佳,但在生活质量维度,乃至其他指标的呈现上,相较于未接受TEER手术的患者,依然展现出一定优势。
由此,我们能够推导出如下结论:精准挑选适宜的患者开展手术,无论是在死亡终点事件的发生率,还是临床终点指标的改善方面,均可实现显著提升。即便是那些略微偏离FMR手术理想条件的患者,接受TEER手术同样可能收获一定的疗效,尽管该疗效有限,但相较于单纯的药物治疗,依然具备相对优势。
问题3:TEER干预的最佳时机在哪里?
COAPT研究发现,疾病发展至第三或第四阶段时,乃是实施治疗干预的最优时机。另外,COAPT研究中大部分患者的有效瓣口反流面积(ERO)与左心室大小呈现出不等比例关系,由此可见,MR的成比例性构成了TEER治疗决策的一项至关重要的切入点。
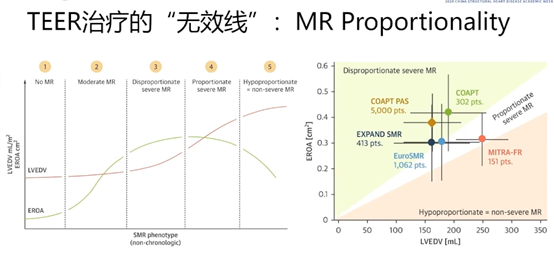
那么,若MR不成比例又会引发何种状况呢?经临床观察可知,此类不成比例的患者预后往往较差。回顾去年COAPT标准发布的5年随访研究,起初学界对于FMR能否采用TEER治疗尚存争议,后续逐步证实了其有效性,直至5年随访时发现,无论是死亡率指标,还是相对较强的复合终点指标,均呈现出阳性结果。
鉴于此,当前在FMR患者是否适宜接受TEER治疗这一问题上,学界已基本达成共识,相关指南亦普遍将其推荐级别定为Ⅱa类。这意味着现阶段以TEER治疗FMR,既具备可行性,也具备必要性。
2
RESHAPE-HF2 Trial
研究
2024年8月,欧洲心脏病学会(ESC)公布了RESHAPE-HF2试验研究成果。RESHAPE-HF2试验与此前的COAPT研究在研究人群设计层面存在相似之处,二者均围绕FMR患者展开。研究结果显示,相较于对照组,TEER组在主要终点、次要终点,以及生活质量、心功能等维度上均呈现出显著的、具有层级差异的改善态势。
然而,这并不意味着RESHAPE-HF2试验是对COAPT研究与MITRA-FR研究的简单重复。事实上,三项研究各自聚焦不同特征人群:MITRA-FR研究选取的是被判定为不适宜接受TEER手术的对照组人群,最终得出阴性结果;COAPT研究纳入的是符合“3个7标准”的特定患者群体,收获了理想的阳性结果;RESHAPE-HF2试验则独辟蹊径,重塑了学界对于相关心脏问题的认知架构。此项研究纳入人群呈现等比例分布特征,尤为突出的是,研究纳入了大量MR程度为3+的患者,将TEER治疗FMR的适应证拓展至MR程度达3+的患者群体范畴。
进一步分析研究数据发现,RESHAPE-HF2试验中患者接受改善心肌重塑药物治疗的比例,相较于COAPT研究与MITRA-FR研究显著更高。这一发现强有力地暗示,针对此类患者,采取更早期、更积极主动的干预措施以应对MR,有望为患者带来更为良好的临床预后结局。
减少反流
“滴水不漏”or “疏而不漏”?
(1)在对FMR患者施行TEER时,二尖瓣的理想夹闭程度,是手术成功的关键考量。精准夹闭对改善MR意义重大,与此同时,确保手术的成功率与夹子的长期耐久性,同样不容忽视。临床实践表明,与需二次干预的患者群体相比,TEER手术后1年复查时未进行二次干预的患者,往往能展现出更为显著的获益。
(2)术后残余反流的评估是另一要点,“反流程度越低越好”并非适用于所有情形。如果患者左心室与右心室功能良好,尽可能降低反流程度对改善预后有益;然而,对于那些本身心脏功能不佳,尤其是右心功能较差的患者,残余反流程度为1+与2+时,在短期预后表现上并无显著差异。在此类情况下,临床可接受一定程度的残余反流,不必过度苛求将反流降低到极致,而是要结合患者多项心脏功能参数进行全面、综合的考量,以制定最为适宜的治疗策略。
(3)压差监测同样不容忽视。部分患者术后反流状况虽有所好转,但一旦压差过高,无疑预示手术效果欠佳。在临床实践中,常以5mmHg作为关键区分阈值。围绕这一问题,学界争议颇多,理想状态自然是在无压差的同时实现反流的最大程度降低。但现实中,当必须面对一定程度的反流时,究竟是选择接受相对多的反流以换取更低的压差,还是反之,成为棘手抉择。EXPANDED研究揭示出两个显著趋势:其一,二尖瓣跨瓣压差(MVG)>5mmHg的受试者在术后1年时MVG呈现下降态势;其二,无论MV梯度如何,术后MR<1+的受试者在30天后至1年期间的全因死亡率相较于MR>2+的患者显著更低。该研究深刻提示,除非压差处于极高水平(需注意压差受心率、患者即时状态等诸多因素影响),否则不必过度聚焦于压差指标,而是应将反流程度与其他心脏功能参数统筹考量。
总之,临床还是应尽可能的追求术后滴水不漏或者更低的残余反流效果,但是部分患者对残余反流容忍度应更高(疏而不漏)。
除了反流-压差平衡之外
需关注围术期GDMT、心脏重构趋势
(1)除了反流-压差平衡之外,TEER治疗过程中还需要考虑其他的因素。研究表明,患者接受TEER手术后,服用三种药物的GDMT与服用两种药物的GDMT,其治疗效果之间存在显著差异。这表明手术并非一劳永逸的解决方案。此外,患者在TEER手术后可能需要调整药物剂量。GDMT在术前、术中和术后是一个动态的过程,需要考虑滴定的问题。
(2)TEER术后,临床观察发现部分患者在夹子植入后左房出现自发显影现象,现阶段该现象通常被视作反流夹闭术取得良好成效的重要标志之一。然而,深入探究可知,这一表象背后隐匿着房室重构这一复杂问题。TEER术后,患者群体呈现出两种截然不同的重构走向:其一为“负性重构”,表现为术后射血分数降低,这无疑会对病情恢复造成负面影响,阻碍患者康复进程;与之相对的是“正性重构”,即术后射血分数呈上升态势,利于患者病情的好转。回顾2023年针对40~50例患者的专项研究,结果显示约14例患者(占比近30%)出现了不同程度的射血分数下降情况。经综合分析,这一现象与多个因素紧密关联,其中,右房功能状态以及反映右房炎症水平的标志物如C反应蛋白等,均在其中扮演关键角色。
因此,评估TEER术后效果不单单看术后反流和压差,还应关注术后重构的结果。对于FMR患者,首先应进行药物治疗,有CRT指征就做CRT,有必要做PCI就做PCI,然后反复做超声。如果结果仍然显示为不等比例、符合“3个7”标准,我们再去做TEER并优化治疗。
FMR-TEER的解剖挑战与操作
当前,FMR-TEER在操作时会面临诸多挑战,比如瓣叶对合、栓系、瓣环、心肌等。在众多要素中,FMR应重点关注以下方面:
(1)栓系的模式:对称和不对称的栓系模式会直接影响预后。
(2)前叶和后叶的变化:通常后叶更重要,因为后叶本身较短。此外,其变化幅度也往往更大。在实际操作时,后叶要么短小,要么栓系,这将决定一台手术是否可行或面临的挑战程度,因此,除了栓系模式,我们还要关注其策略。中心性反流的患者,如果因贴合度不够,导致TEER后反流的变化不大,此时应使用长夹或短夹,使其更好的贴合;而非中心性反流的患者,如果存在假性脱垂,其关键在于恢复后叶的栓系。
总结
最后,庄晓东教授总结如下:(1)FMR有多种亚型,“不等比例”的人是可治可夹,是否“早夹早好”目前还没有明确的结论;(2)对于夹持,是追求滴水不漏还是疏而不漏,这需要根据具体情况来判断。大部分情况下持续的减少反流(滴水不漏)是硬道理;部分患者对残余反流容忍度更高(疏而不漏);(3)除了降低反流之外,还要关注压差的平衡、围手术期GDMT,心脏重构趋势;(4)进行TEER时,若想达成理想治疗效果,需从多维度考量。首先,要精准筛选合适的患者(这类患者通常MR程度较重),为手术奠定良好基础。同时,要配合药物治疗,确保患者心脏不出现负性重构,维持稳定的机体状态。术中操作时,要密切关注瓣叶栓系程度与反流的对称性,并确保术后跨瓣压差与残余反流情况适宜,通过精细化的操作,方能实现最优的治疗效果。

长按识别二维码 看本次授课精彩回放
撰稿/lianger;审校/Tina
本文为医谱学术原创文章,转载请标注来源
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动