Circulation丨ALDH1A1下调诱导主动脉瓣钙化,RARα激动剂或成治疗新策略
研究方法
本研究于2017年11月至2018年12月在法国里尔大学医院心脏外科开展。研究人员从患者和器官捐赠者心脏中收集移除瓣膜,并纳入来自欧洲同种异体移植库(EHB)的正常主动脉瓣作为对照组,对来自钙化(二尖瓣和三尖瓣)与对照瓣膜的瓣膜间质细胞(VIC)进行了比较转录组学分析。
在对照人类主动脉瓣的VIC培养中,研究团队分析了醛脱氢酶1家族成员A1(ALDH1A1)下调的机制及其后果。通过在VIC中抑制或沉默ALDH1A1,研究评估其对成骨标志物表达和钙化过程的影响。此外,在人类VIC培养以及两种动物模型(大鼠皮下植入牛心包膜和幼年绵羊异种移植主动脉瓣置换)中测试了全反式维甲酸(ATRA)对钙化的影响。
研究结果
1. 人类VIC转录组分析显示,ALDH1A1是钙化瓣膜与对照瓣膜VIC中下调最多的基因。
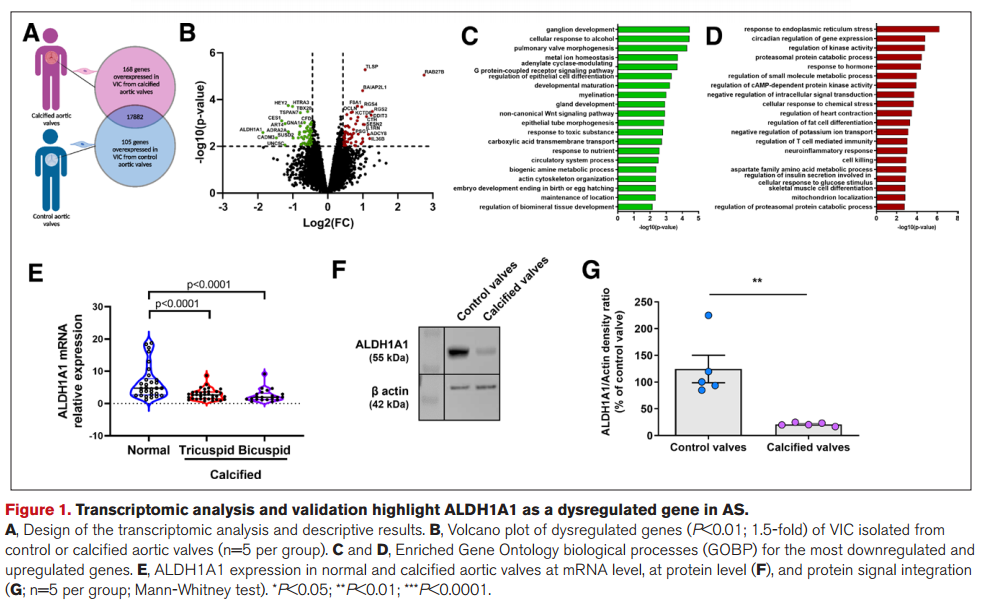
2. 在人类VIC中,ALDH1A1的表达通过TGF-β1以SMAD2/3依赖的方式下调。
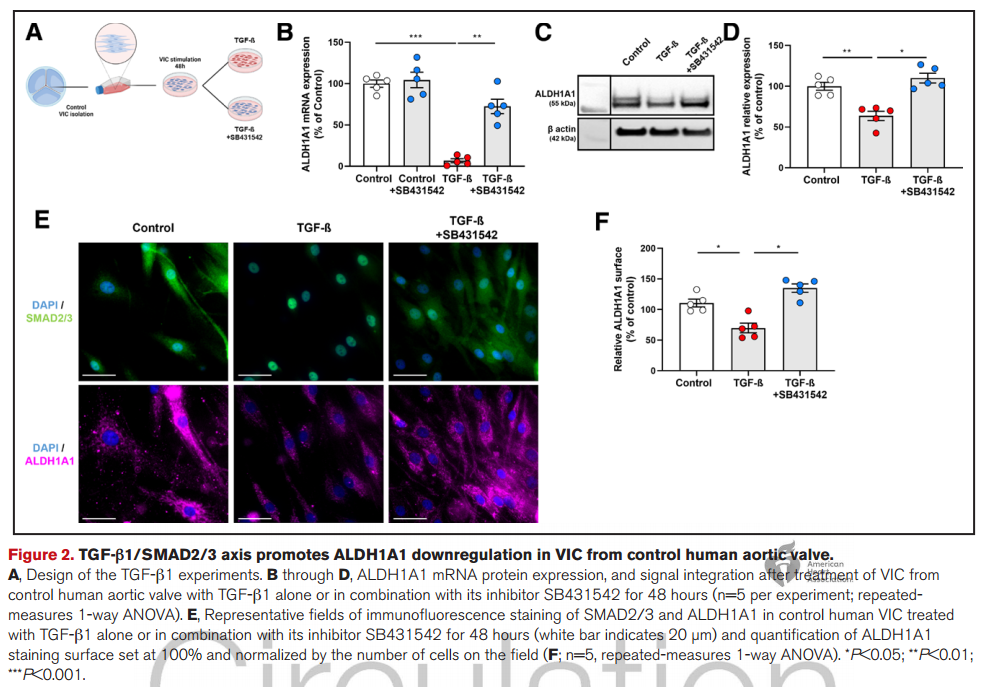
3. ALDH1A1抑制促进成骨细胞样VIC表型,并通过抑制全反式维甲酸受体 α(RARα)信号传导,增加钙沉积。
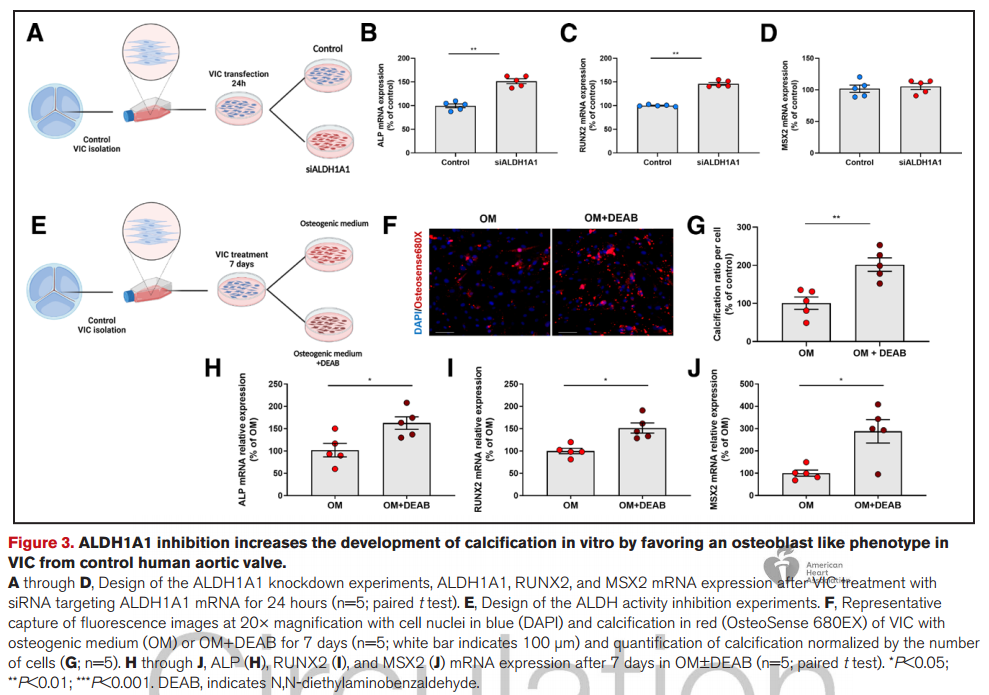
4. 用维甲酸处理VIC可减少钙沉积并减轻VIC成骨细胞活性。
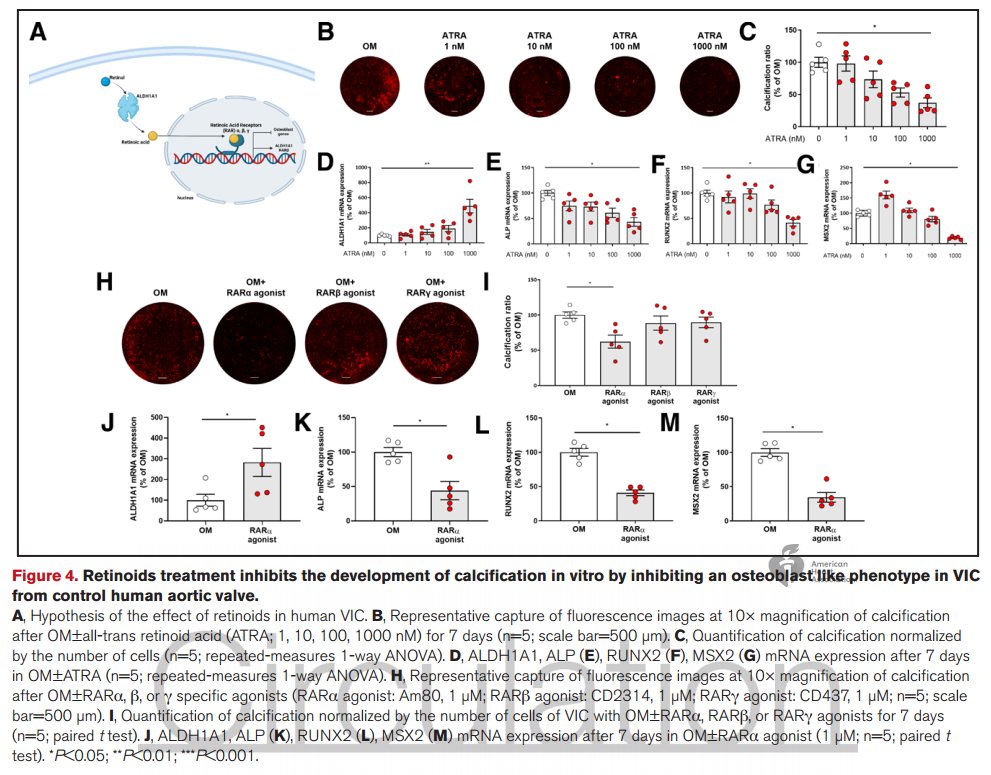
5. 全反式视黄酸抑制主动脉BPV的钙化发展,并在异种移植绵羊模型中改善了主动脉瓣超声心动图参数。
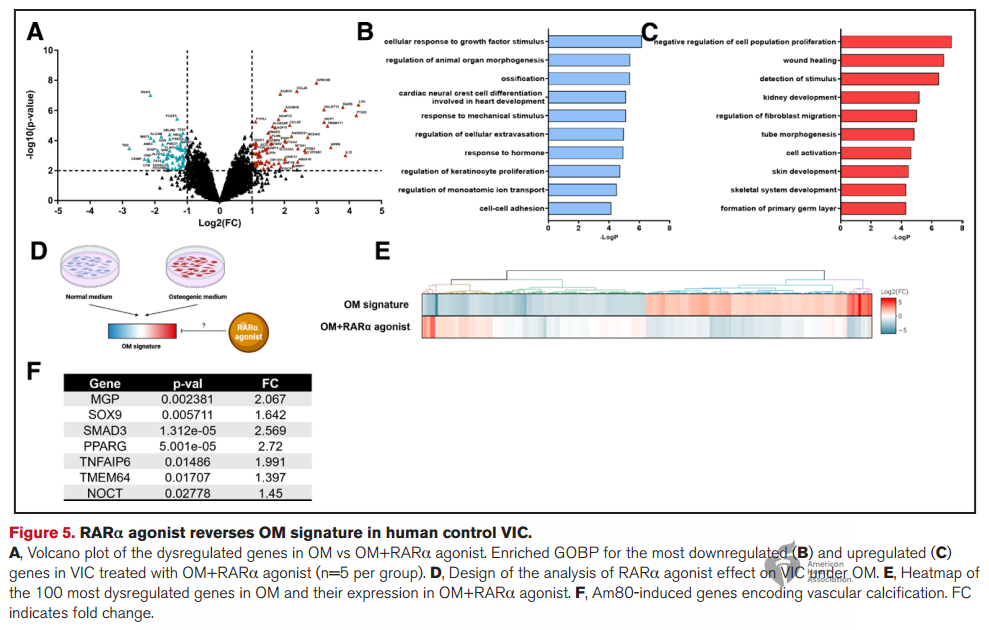
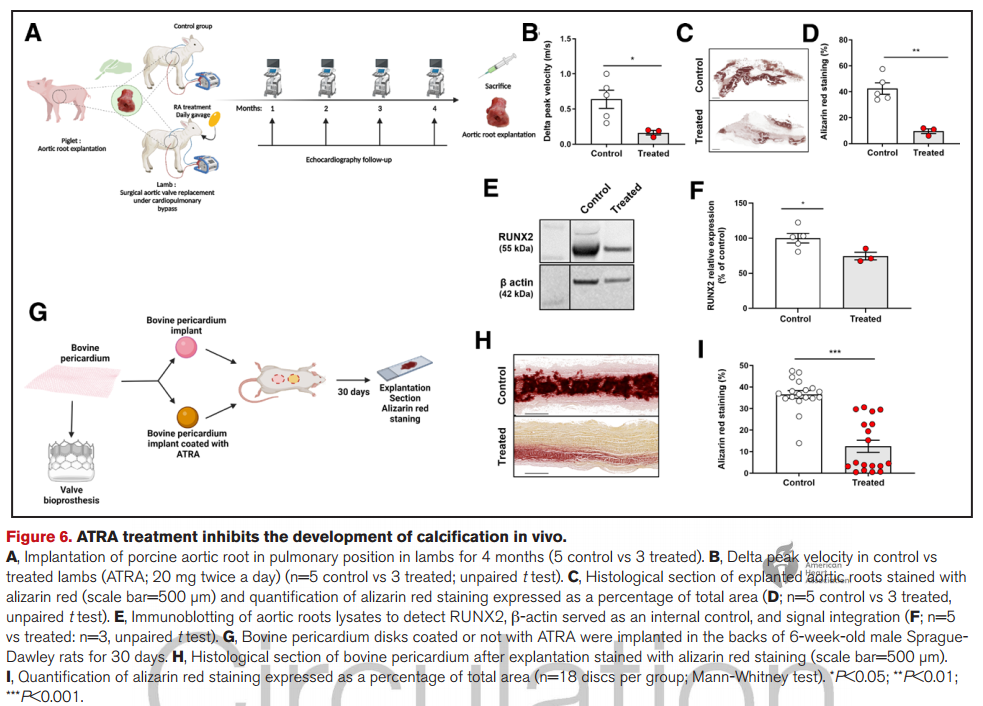
研究结论
研究结果表明,ALDH1A1在钙化瓣膜中下调,从而促进VIC向成骨细胞表型转变。RARα激动剂包括通过药物重新定位策略的全反式维甲酸,代表了一种有希望且创新的药物治疗方法,展现出预防主动脉瓣和BPV钙化的潜在应用前景。
这项研究不仅揭示了ALDH1A1在主动脉瓣钙化中的关键作用,还为预防和治疗主动脉瓣狭窄和生物瓣膜退化提供了新的药物靶点。此外,研究还提出了将RARα化合物应用于生物瓣膜涂层的创新思路,类似于药物洗脱支架的设计,这可能进一步延长生物瓣膜的使用寿命,减少患者再次手术的风险。
思考
1. 瓣膜间质细胞中的ALDH1A1信号通路
2.在体外利用ATRA和RARα激动剂靶向作用于ALDH1A1信号通路
3.ATRA可在体内预防瓣膜及生物假体的钙化
参考文献
1. Rosa M,Dupont A,Smadja DM,et al.Aortic Valve Calcification Is Induced by the Loss of ALDH1A1 and Can Be Prevented by Agonists of Retinoic Acid Receptor Alpha: Preclinical Evidence for Drug Repositioning.Circulation.2025 Feb 24.
撰稿/YC;编校/;lianger
本文为医谱学术原创文章,转载请标注来源
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。




发表留言
暂无留言
输入您的留言参与专家互动