周达新教授:TEER技术历史沿革及技术展望

经导管缘对缘修复(TEER)是继经导管主动脉瓣置换(TAVR)之后结构性心脏病最热门的技术,目前已经在全世界逐渐推广开来。近日,TEER20周年纪念活动在“第七届中山医院脑卒中防治——心神联合高峰论坛”上成功举办,复旦大学附属中山医院周达新教授作“TEER技术历史沿革及技术展望”精彩分享,不仅回顾了TEER技术的来时路,分享了TEER目前应用现状,更指明了TEER未来的发展方向。医谱学术特将精华内容整理成文,供临床医生参考。

1991年,意大利医生Ottavio Alfieri为一名29岁的患者实施ASD外科修复手术。术中发现该患者二尖瓣为双孔型,仔细研究后发现这样的二尖瓣在功能上也是正常的。经过长期随访,该患者仍可健康的存活。
在这一病例的启发下,Ottavio Alfieri教授在为1例腱索断裂、二尖瓣脱垂患者进行二尖瓣修复时,由于使用传统的外科二尖瓣修复技术无效,便对该患者进行缘对缘缝合,术后患者效果满意、预后良好。
于是,Ottavio Alfieri教授提出了缘对缘修复技术 (edge-to-edge repair),其核心技术就是将二尖瓣进行缘对缘缝合,将二尖瓣双孔化,从而达到治疗反流的目的。这种技术简单、重复性高且可靠,可修复一些在当时并不适合Carpentier技术或者实施难度较大的二尖瓣病变,被称作“Alfieri Stitch”。Ottavio Alfieri教授也因发明了这一技术,于2023年荣获AATS终身成就奖。
1998年,Alfieri教授团队发表了该技术5年随访结果[1]。在纳入的121例患者中,绝大部分为前瓣及双瓣叶脱垂的患者,随访5年以上效果良好。在该篇论文中,Alfieri教授大胆提出:缘对缘修复技术由于技术操作简单,具有转化成经皮修复技术的前景。
早期的TEER装置包括经心尖二尖瓣缘对缘螺旋闭合(Morales,1999)、经左心耳缘对缘穿刺缝合系统 (Ottavio Alfieri,2002)、经股静脉房间隔穿刺瓣叶缝合缘对缘系统Mobius (2007,爱德华),但均未能取得成功。随后,在2002年,MitraClip原型产品问世,并于2003年6月27日在委内瑞拉完成人体首例植入。
2020年美国心脏病学会/美国心脏协会(ACC/AHA)的瓣膜病管理指南[2]将经导管缘对缘修复技术单独命名为 transcatheter edge-to-edge repair,简称TEER,体现出最新版瓣膜病指南对TEER技术的强调和肯定,但该指南并未对TEER进行定义。
葛均波院士、周达新教授、潘文志教授等学者在《经导管缘对缘修复 :定义、分类及技术更新》[3]一文中将TEER定义为:采用二尖瓣夹合装置,经股静脉或心尖路径置入,在超声及X线引导下夹住二尖瓣反流(MR)区的前、后瓣叶并使之接合,使心脏收缩期时瓣叶之间间歇减少或消失,而舒张期时瓣口变成双孔或多孔,从而达到减少或消除MR的效果。
锁定装置是二尖瓣夹子的核心部件,其作用是在捕获夹合二尖瓣叶后防止夹子打开。目前TEER器械(二尖瓣夹子)根据锁定方式可分为三类[3]:
1 机械锁定夹子:该类器械以 MitraClip、Dragonfly为代表。其采用机械传动控制夹子的关闭,当夹子捕获瓣膜后关闭夹子,之后启用机械锁定装置,使得夹子无法再被打开。当然,该机械锁定装置也是可逆的,通过采用线控方式拉动拉线可以打开锁定装置,使得夹子能够再次被机械传动而开合。
2 自锁定夹子:该类器械以PASCAL为代表,同样采用器械的传动控制夹子的关闭,但夹子是记忆金属制成,自然状态下夹子是关闭的,当夹子捕获瓣膜后,夹子由于自身形态记忆弹性实现自我关闭。
3 闭合环锁定夹子:该类器械以 ValveClamp为代表,采用闭合环锁定装置。
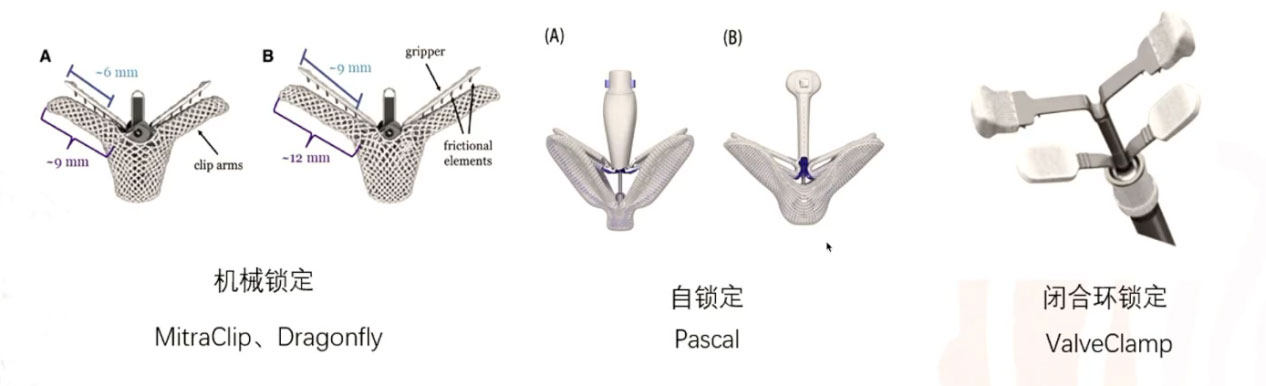
二尖瓣夹合装置可经股静脉或心尖路径置入,MitraClip、PASCAL、Dragonfly、ValveClasp等经外周血管置入,创伤小,内科可独立完成;ValveClamp操作简单,学习曲线短,导管操作时间短,夹合范围宽,夹合效能强。
TEER技术的优点在于[4]:
①靶点精确、植入物少:二尖瓣夹子几乎只作用于病变部位,没有太多附属结构,不会对心脏其他组织结构及功能形成干扰,这相对其他二尖瓣介入器械有明显优势。
②原理简单,容易导管化:外科缘对缘仅需把病变瓣叶和对侧瓣叶缝合,使用几个垫片缝合几针就可以完成。这种简单方式使得容易导管化。同时,瓣叶附近操作空间充分,干扰结果少,在操作上容易实现。
③医学原理可靠,以不变应万变:外科缘对缘修复技术(SEER)一开始是在其他外科修复技术无效情况下,作为后补技术出现的。因此,无论是简单病变还是复杂病变,均可使用SEER或TEER。
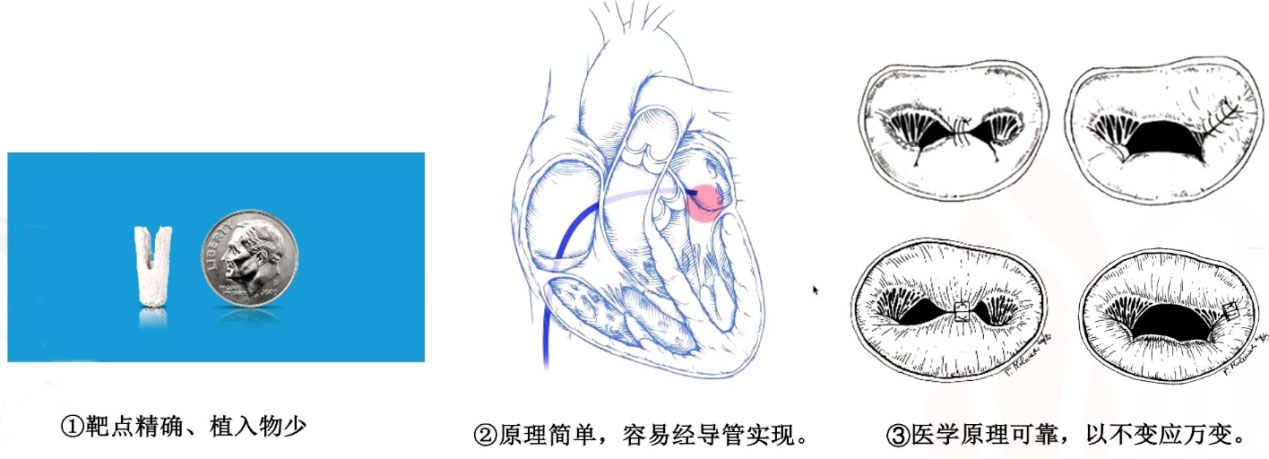
那么,为何SEER在临床中应用较少?这是因为SEER在心脏停跳下进行,不能实时评估血流动力学,可能导致术后二尖瓣狭窄;外科发明了一些更好的修复技术,如腱索植入、瓣叶切除、瓣叶延长技术等,这些技术在有效治疗反流的同时不会引起瓣口狭窄,因此替代了SEER。但这并不意味着SEER效果不好,或者SEER对复杂病变无效果,而是“优中选优”的结果。而且,TEER并不完全等同于SEER,甚至有超越SEER的可能。
SEER vs.TEER

近年来,随着产品的迭代及经验的积累,TEER效果持续提升,向外科手术水平接近。CLASP IID随机对照试验首次比较了PASCAL和MitraClip系统在有明显症状性退行性MR(DMR)且有外科手术禁忌的患者中的结局。
▪ 主要疗效性终点:术后6个月时,PASCAL组和MitraClip组MR≤2+患者比例分别为97.9%和95.7%,非劣效性界值>-18%。
▪ 次要疗效性终点:术后1年PASCAL系统的MR≤2+和MR≤1+率不劣于MitraClip系统。PASCAL组和MitraClip组MR≤2+患者比例分别为95.8%和93.8%,大于预先确定的-18%的非劣效性界值;MR≤1+患者比例分别为77.1%和71.3%,非劣效性界值>-18%。

基线、出院时、术后30天,6个月及1年时MR严重程度分级及占比
而且,TEER对复杂病例和简单病例的效果相当。在EXPAND G4研究中,TEER术后30天,患者MR显著降低(MR≤1+达91%);在1年时,所有患者MR程度明显降低。其中,92.6%的患者达到了MR≤1+,98.5%的患者达到了MR≤2+。91.2%基线MR≥3+的受试者在1年时达到MR≤1+,87.2%的原发性MR(PMR)基线MR≥3+和94.5%的继发性MR(SMR)基线MR≥3+的受试者在1年时达到MR≤1+。
目前,全球累计MitraClip植入量已超20万台,TEER相继获得国内外指南的推荐。同时,经导管二尖瓣、三尖瓣治疗技术在2019-2020年被克利夫兰医学中心列为十大医疗创新方向,其发展呈现一派欣荣之景。

DMR患者的TEER手术策略为[4]:
①长驱直入:在不引起瓣叶撕裂、瓣膜狭窄情况下尽量多夹瓣叶,尤其是病变侧的瓣叶,保证即刻及远期效果;
②斩草除根:尽量夹掉脱垂瓣叶,保证远期效果,补充二夹有时候是需要的;
③尽善尽美:反复尝试,尽量把反流减低到0-1+,保证远期效果;
④避免狭窄:轻度狭窄预后差于中度反流,应该尽量避免。
功能性MR(FMR)患者TEER手术策略为适可而止,不求完美:允许中度2+残余分流,或者轻度压差,这并不影响患者预后和症状,同时这一策略可以避免过多操作导致的并发症以及减少手术时间。
发展方向1:向复杂解剖病例推广
TEER未来的应用将向非A2P2(二尖瓣叶中央区位置)复杂病变推广。事实上,无论是EXPAND研究还是EXPAND G4研究,均有纳入非A2P2病变的复杂解剖患者,亚组分析显示,其效果与经典的A2P2病变患者差别不大。
发展方向2:向中低危病人发展
随着器械改进和技术成功率的不断提高,TEER会由高危人群逐渐向低危人群拓展。与外科手术随机对照的REPAIR MR研究正在对此进行探讨。
发展方向3:TEER衰败后介入治疗
例如经导管电切中间结合桥再行TMVR,TEER失败后再TEER等。
发展方向4:影像及人工智能辅助手术策略优化
未来可尝试全息影像、人工智能、机器人等指导TEER手术策略的优化。
发展方向5:TEER治疗三尖瓣反流
目前已有许多中心将TEER技术应用到三尖瓣反流的介入治疗,并取得初步满意的治疗效果。特别是PASCAL系统,在三尖瓣反流研究中报道较多。
参考文献
[1]Eur J Cardiothorac Surg.1998;13(3):240-245
[2]Ommen SR,et al. J Am Coll Cardiol,2020,76(25):3022-3055.
[3]潘文志,等.经导管缘对缘修复:定义、分类及技术更新中国介入心脏病学杂志,2022,30(06):440-444.
[4]潘文志,等.经导管二尖瓣缘对缘修复:当前认识与策略原则,中国胸心血管外科临床杂志,2024
本文图文来自幻灯
本文为医谱学术原创文章,转载请标注来源
专家简介
- End -
关注我们
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。




发表留言
暂无留言
输入您的留言参与专家互动