“北三心声”丨72岁肿瘤患者出现心力衰竭,多方探秘病因待明!下一步治疗何去何从?

《北三心声》大查房第5期

12月23日,北京大学第三医院心内科重磅推出的《北三心声》栏目第5期精彩亮相。本期的大查房将目光聚焦于一位72岁的患者,该患者由于患有肺粘液腺癌,在抗肿瘤药物治疗后,相继出现肾衰竭以及心力衰竭等一系列表现。这其中的致病机理与病情发展态势究竟怎样?
让我们一同跟随北京大学第三医院多学科领域权威专家的脚步,共同深入剖析该例患者的病情,解密下一步治疗方案。

病例信息
患者为72岁男性,主诉间断乏力、呼吸困难3月余。
现病史
患者3月余前(7-10)因肺粘液腺癌应用阿来替尼及地舒单抗治疗,用药后患者出现乏力、气短并逐渐加重。用药1月余后(8-16)患者劳力性呼吸困难逐渐加重,可耐受步行1km左右,伴双下肢足踝处轻度水肿。无发热、咳嗽、咳痰,无胸闷胸痛,无尿量及尿色改变,无腹胀、纳差。3天内体重增加2Kg。遂于外院住院诊治,查NT-proBNP 2127.51pg/mL,超声心动图示:左房增大,二尖瓣大量反流,LVEF 60%,诊断“心力衰竭”,给予二甲双胍恩格列净1片 Bid、螺内酯 20mg Qd、呋塞米20mg Qd治疗后好转。
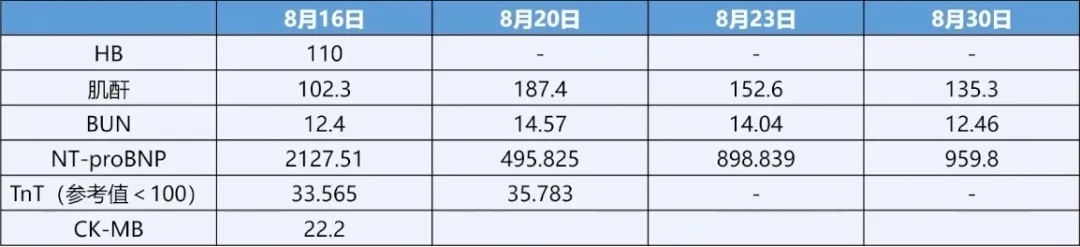
患者2024年3月份体检和8月份入院后ECG提示均为窦性心律,肢体导联低电压,无特殊异常。
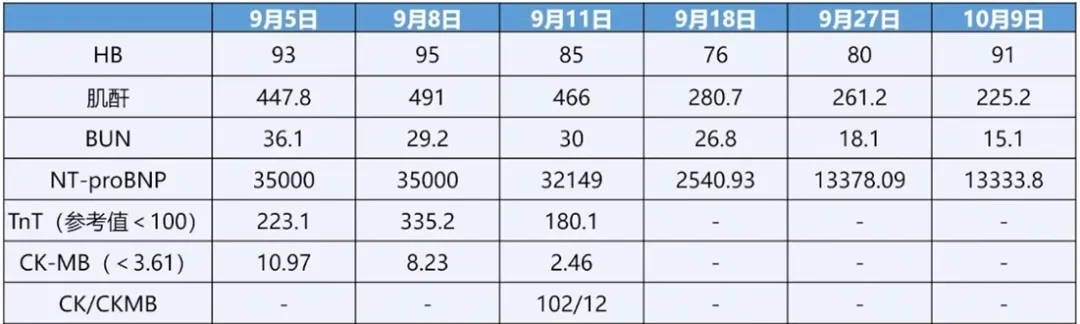
9月3日患者受凉后再次出现活动时呼吸困难、伴心前区压迫感,伴心悸、伴咳,步行10米左右即可出现症状,无胸痛、无明显咳痰,后症状加重,出现端坐呼吸,无尿,双侧足踝指凹性水肿,再次当地住院诊治,查血NT-proBNP>35000pg/mL,高敏肌钙蛋白T223.1ng/mL,血肌酐447.8umol/L,血气分析提示Ⅰ型呼吸衰竭,心电图见V4-V6导联ST-T改变、T波倒置,床旁超声心动图示:左房增大,二尖瓣反流LVEF 60%,各室壁运动正常;行胸腔超声提示双侧胸腔积液,考虑诊断急性心力衰竭、急性肾衰竭、Ⅰ型呼吸衰竭,给予经鼻高流量、抗感染、停用靶向药物、间断透析、利尿药物治疗后症状部分缓解。
患者心电图和2024年3月份体检时相比,出现V4-V6导联ST段压低,T波倒置。
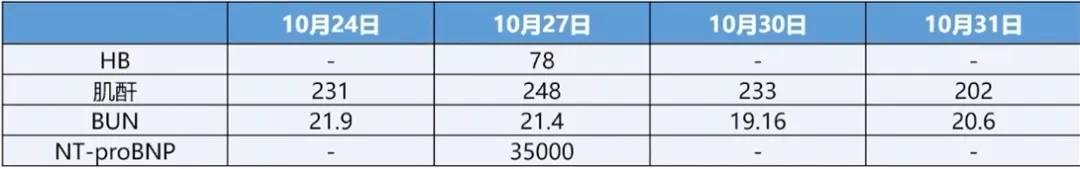
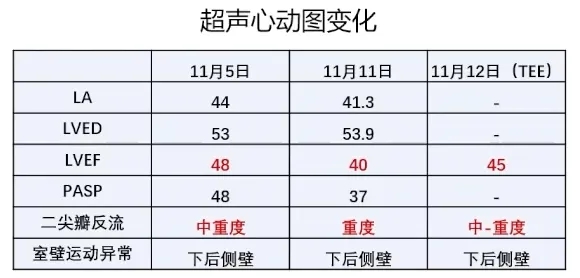
9天前(10-24)患者呼吸困难再次加重,于当地医院就诊,超声心动图示:LA43mm、二尖瓣中量反流,肺动脉收缩压增高(37mmHg),左室下后壁室壁节段性运动异常,LVEF37%,查血NT-proBNP 13333.8pq/mL,血肌酐225.2umol/L,BUN15.1umol/L,考虑急性心力衰竭, 给予诺欣妥、螺内酯、SGLT2-i、比索洛尔,静脉利尿剂、新活素利尿、左西孟旦强心等治疗,症状好转。复查超声示:二尖瓣中度反流,左室下后壁运动略减低,LVEF58%。出院后长期应用唯立西呱2.5mg Qd、托伐普坦7.5mg Qd及金水宝4片Tid治疗,但仍有间断呼吸困难症状,监测血NT-proBNP较前无明显下降,现为进一步诊治收住入院。患者自发病以来,精神欠佳,睡眠欠佳,食欲尚可,近期小便约1200mL/天,大便无异常,体重下降8Kg。
既往史
冠心病8个月,体健,行CTCA示LAD近段钙化,管腔轻微狭窄约<24%。对角支轻度狭窄约25%;LCX血管闭塞,因无症状,未规律治疗。
肺粘液腺癌8个月,体检行胸部CT发现左肺上叶尖后段占位性病变(2.6cm*2.1cm),因性质未明确当时未予诊治,后复查胸部CT病变较前增大(2.9cm*2.1cm),行骨扫描提示多发骨转移(腰椎及肋骨),行CT引导下穿刺活检诊断为粘液腺癌,后行病理基因检测后EML-4(exon6)- ALK(exon20)融合突变,予阿来替尼600mg Bid靶向治疗(7-10起),地舒单抗每月1次皮下注射抑制骨转移,9月5日因急性心衰、呼吸衰竭、急性肾衰竭停用。
2型糖尿病10余年,曾口服二甲双胍降糖,现三餐前门冬胰岛素4-4-4U及晚德谷胰岛素6U皮下注射降糖,血糖控制欠佳。急性肾功能不全3个月,2个月前急性肾衰竭透析治疗,现服用金水宝治疗,既往8个月前体检时肾功能正常。
否认高血压,否认脑血管疾病。
个人史:吸烟20余年,平均10支/天,戒烟20年。饮白酒1-2两/天,3月前戒酒。
家族史:否认家族性遗传病史,否认早发冠心病家族史。
体格检查
体温36.0℃,脉搏68次/分,呼吸18次/分,血压124/64mmHg;神志清楚,精神差,查体合作;颈静脉未见充盈或怒张,肝颈回流征阴性;双下肺呼吸音减低,右肺犹著,未闻及明显干、湿性音,未及胸膜摩擦音;心浊音界扩大,心率68次/分,律不齐,可闻及早博,4-5次/分,心音低钝,A2>P2,二尖瓣可闻及收缩期2/6级吹风样杂音,杂音无传导,未触及震颤,无心包摩擦音;腹平软,无压痛、反跳痛,腹部无包块,肠鸣音4次/分;双侧足踝轻度水肿。
结合病史,初步诊断:
1.慢性心力衰竭
2.冠状动脉硬化性心脏病
-
慢性冠脉综合征
-
陈旧性下后壁心肌梗死
-
心脏扩大(二尖瓣反流)
-
心律失常(短阵发性心动过速)
-
心功能Ⅲ级(NYHA分级)
3.左肺粘液腺癌伴骨转移
4.双侧胸腔积液
5.2型糖尿病
6.肾功能不全
7.中度贫血
入院辅助检查
血常规提示轻度贫血、以血尿素氮(BUN)升高为主的肾功能不全、心肌损伤;凝血D-dimer升高,甲功方面T3较低,其余未见特殊异常。

超声心动图提示:室壁节段性运动异常(左室下壁、后壁、侧壁基底段-中段);左房增大;二尖瓣反流(中-重度)——功能性反流;主动脉瓣反流(轻度);三尖瓣反流(轻度),PASP:48mmHg;LVEF:48%(2-D);下腔静脉内径正常(10mm)、呼吸变化率正常。
胸部CT平扫提示左肺结节(1.2cm*1.1cm),肺门、纵隔未见肿大淋巴结;双侧胸腔积液(未见明显增多),双肺下叶膨胀不全。
心电图提示窦性心律,胸前导联ST段改变。T波倒置、低平。完善动态心电图后可见短阵房速和频发的室早。动态心电图提示多为单源性的室早。
入院诊疗经过
分别经过肿瘤化疗科、肾内科、药剂科等医师会诊,给出综合治疗方案,具体如下:
肿瘤化疗科:阿来替尼不良反应相对较低,但肾损害不良反应较常见,该患者用药后出现心衰、肾损害,考虑早期阿来替尼损害可能性大,但心脏损害不明确,肺部病灶经治疗后缩小,可考虑抗肿瘤药物可调整为同类其他代药物。
肾内科:患者用药后出现急性肾损伤,尿常规未见红、白细胞,BUN升高为主,考虑心衰及药物相关肾小管损伤,存在阿来替尼药物肾损害,复查肾功能较前好转,可暂继续观察。
药剂科:阿来替尼常导致水肿、贫血、肾损伤,心脏损害,以心动过缓、QT延长常见,若抗肿瘤药物有效可考虑应用同类一代药物,相对发生水肿、肾损害发生率较低。
随后结合各科会诊意见,其具体治疗方案如下:
冠心病二级预防治疗:
阿司匹林 100 mg Qd
比索洛尔2.5mg Qd
阿托伐他汀20mg Qn
心力衰竭GDMT治疗:
沙库巴曲缬沙坦25mg Qd
螺内酯 10mg Qd
达格列净10mg Qd
托拉塞米2.5 mg Qd
唯利西呱 5mg Qd
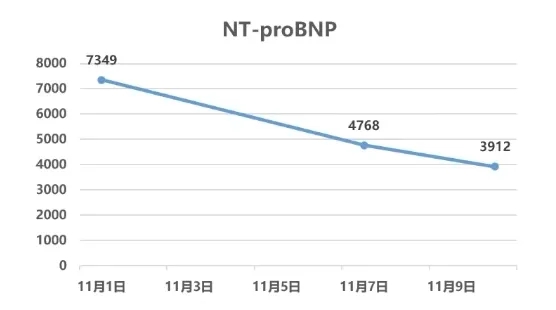
查房目的
1.患者心力衰竭病因?
2.下一步治疗方案?
-
血运重建的意义
-
是否行二尖瓣钳夹术?
-
肿瘤药物重启时机?
病例总结
该患者系老年男性,疾病呈慢性进展过程。8个月前被确诊患有冠心病以及左肺粘液腺癌。自2024年7月10日起,开始接受阿来替尼药物治疗方案。在接受该药物治疗后,患者相继出现乏力以及呼吸困难等症状表现。
回顾其病程:
(1)患者在2024年3月进行体检以及5月针对肺结节开展相关检查时,其心功能均处于正常范围,在应用阿来替尼等化疗药物治疗之后,患者于2024年8月首次出现心力衰竭症状,此时其射血分数尚处于正常水平,BNP水平则有轻度升高。
(2)当持续应用化疗药物接近两个月时,患者发生了一次心力衰竭症状较为严重的情况。此次发病时,患者的心电图显示出ST-T动态变化,肌钙蛋白T与BNP相较于之前均出现显著升高,同时并发急性呼吸衰竭与肾衰竭。虽经抗心力衰竭及利尿治疗后症状得到一定程度的缓解,但患者出院后心力衰竭症状依旧频繁发作。
(3)至2024年10月住院期间,患者首次出现射血分数下降,二尖瓣反流程度由之前的轻度进展为中、重度,同时出现下后壁节段性室壁运动异常。
综上,结合患者的病史、BNP升高以及超声心动图结果等,目前可明确诊断为心力衰竭,为射血分数下降的全心衰。
分析患者的心衰的诱因,患者几次心力衰竭发作可能存在不同诱因。总体而言,容量负荷过重与贫血可能是每次心力衰竭发作的共性相关因素。而其中第二次较为严重的心力衰竭发作,则是由感染及疑似心肌缺血所诱发。
从心力衰竭病因学层面深入剖析如下:
(1)冠状动脉性心肌病:该患者具有确凿的冠心病病史,患者于病程中虽未有显著胸痛的症状,但心电图、心肌损伤标志物及心脏超声均支持患者病程中曾发生了心脏事件,此为其发生心力衰竭的病因之一。
(2)心脏瓣膜病:患者初次出现心力衰竭时伴随二尖瓣重度反流,不过考虑可能为功能性二尖瓣反流(FMR),即因心力衰竭致使容量负荷大幅加重而产生的二尖瓣反流现象。在经历利尿剂等抗心力衰竭治疗后,患者的瓣膜反流程度曾减轻至中度。但在后续包括此次入院实施强化利尿、容量管控等抗心力衰竭治疗过程中,患者瓣膜反流不但未缓解,反而持续恶化,射血分数也呈进行性下降,由此形成心脏瓣膜病与心力衰竭之间的恶性循环。基于此,推测患者的心力衰竭极有可能是由心脏瓣膜病所诱发。随后,由于多次超声检查未发现明显的瓣膜结构异常或腱索断裂等原发性瓣膜病损害,进一步推测该患者的心力衰竭可能源于功能性心脏瓣膜病。功能性心脏瓣膜病可能是由于心脏整体功能改变、心肌病变或血流动力学异常等因素间接影响瓣膜功能,导致二尖瓣反流逐渐加重,加重心脏负担,推动心力衰竭进展。而本患者考虑可能与心肌梗死后二尖瓣腱索或乳头肌头能不全有关。
(3)肿瘤治疗相关心脏毒性:患者在抗肿瘤治疗后出现心衰,必须考虑到肿瘤药物的直接心脏毒性,通过广泛查阅相关文献,尚未发现阿来替尼直接引发心力衰竭的报道。然而,该药物确实会引发贫血、水肿和肾功能损害等其他不良反应。贫血可导致心肌缺氧,影响心脏功能;水肿会增加心脏的前负荷;肾功能损害可能影响体内液体平衡、电解质代谢以及心血管调节因子的分泌与代谢,这些因素综合起来可能诱发患者的心力衰竭。
(4)肾功能不全:在整个疾病进程中,患者存在肾功能不全情况,由此推测其心力衰竭是否由肾心综合征所诱发。该患者肾功能不全表现为BUN首先升高,而后肌酐升高,且以BUN升高为主。这种特征更倾向于因心力衰竭导致肾灌注不足从而诱发的心肾综合征。在治疗后患者肾功能逐渐恢复,但心功能仍未见恢复,这也不支持肾心综合征的诊断。
患者无论是肿瘤的治疗还是心脏的治疗都会影响患者的预后。病因分析决定着患者后面的治疗,考虑患者冠心病的基础,应建议患者进行冠脉造影评估血管病变,但是否进行二尖瓣钳夹还需商榷,另外患者心功能稳定后何时重启抗肿瘤的治疗也需讨论后给与明确的指导。

病例讨论
超声心动图影响分析:
患者的超声心动图的特点可归纳如下:
(1)室壁节段性运动异常,特别是左室下壁、后壁和侧壁基底-中段。从超声的特点来看,其更像是梗死或严重缺血所造成的。左房扩大,右心室和左心室大小仍在正常范围内。同时再结合冠脉回旋支病变,则可以解释患者出现室壁节段性运动异常的现象。
(2)射血分数仍然在40%~45%,显示为轻度射血分数减低的状态。
(3)左心房扩大,但左心室没有显著的重构,二尖瓣环也未见明显的扩张,但可见明显的二尖瓣反流,综合判断,其反流程度为中-重度。考虑二尖瓣反流的原因,从超声上看,未见瓣膜的增厚、脱垂、裂隙或腱索断裂,而是后叶的拴系现象,基本可以排除原发性二尖瓣病变的可能,提示这是一例继发性、FMR。结合患者室壁阶段运动异常部位和回声情况,可能与缺血有关,改善缺血,患者二尖瓣反流有可能得到改善,但需长期随访观察。
肿瘤科分析
该例患者为肺粘液腺癌Ⅳ期多发性骨转移,是ALK的经典突变。ALK突变因发生率较低,预后良好,也称为“钻石突变”。当前患者使用的抗肿瘤药物为第二代ALK抑制剂阿来替尼。临床常采用中位无进展生存期(PFS)作为肿瘤评价中的常用指标,是指从随机化开始,即从用药开始到因肿瘤进展或任何原因导致死亡的时间。结果显示,第一代ALK抑制剂克唑替尼与化疗药物相比,其中位PFS为10.9个月,而化疗药物仅为7个月就出现了PFS。第二代ALK抑制剂的中位PFS通常在16.8~34.8个月之间;洛拉替尼作为第三代ALK抑制剂,其中位PFS已达到60个月。
针对克唑替尼治疗后序贯二代和三代ALK阳性患者的真实案例报道显示,部分患者生存期可达十年,疗效显著。在阿来替尼的临床研究中,对心脏常见的不良反应主要包括窦性心动过缓(30%);2023年发表的一项关于真实世界中接受阿来替尼治疗患者的研究表明,共42%的患者发生了心动过缓,1例患者因严重心动过缓症状而接受了起搏器植入,该药物对心脏EF值的影响不明显,因此心力衰竭的报道较少。但这类药物,水肿的发生率较高(13%),同时有一定比例患者出现肾功能损害乃至肾功能衰竭。
该患者的心力衰竭治疗历程可清晰地划分为三个阶段:
第一阶段起始于药物使用之后,于2024年8月呈现心功能不全症状,同时伴有外周水肿,值得注意的是,其射血分数值与肌酐水平均处于正常范围。此阶段状况可能是由于阿来替尼引发外周水肿,进而致使水钠潴留,最终诱发心力衰竭。
第二阶段发生在用药进程中,至2024年9月,患者相继出现肾衰竭、心力衰竭以及呼吸衰竭。这些病症的产生极有可能与阿来替尼导致的肺部纤维化存在关联。彼时患者肾功能不佳,这种肾功能不良状况进一步引发了心力衰竭与呼吸衰竭,三者之间相互影响,形成复杂的病理生理连锁反应。
第三阶段为停药之后,患者逐渐出现EF值下降以及其他运动异常症状。这些症状的主导因素大概率与心脏自身的病变相关,不过,贫血以及其他一些次要因素或许也在一定程度上参与了病情的进展,对整体症状的出现与发展起到了辅助性的推动作用。
关于该例患者的后续治疗,建议可以使用一代或者三代,其中三代的安全性可能更高,阿来替尼暂时不建议使用。
结构心脏病组意见
该例患者心力衰竭诊断确切,同时合并肾衰竭与肿瘤,在此情形下实施特殊靶向治疗极为复杂。综合患者临床资料分析,其心力衰竭的病因可能是多种因素共同作用所致,其中FMR是最为关键的因素。
FMR可进一步细分为房性FMR和室性FMR,二者的发生机制存在差异。房性FMR通常与房颤密切相关,尤其与左心房结构重塑及扩大相关联;而室性FMR则与诸如缺血性心脏病、心肌疾病等基础疾病以及栓系因素相关。就该例患者而言,依据超声分析结果,存在栓系因素,若患者伴有乳头肌功能障碍,那么后叶栓系现象极易出现,从而引发二尖瓣中度至重度反流。由此可判定该例患者的二尖瓣反流属于室性FMR。
已有研究表明,无论是房性FMR还是室性FMR,经导管缘对缘修复(TEER)治疗的效果均不逊色于外科手术治疗。不过,针对该例患者实施TEER微创治疗时,需着重关注以下三点:其一,反流程度需达中重度且符合相关条件;其二,患者需呈现出相应的临床症状;其三,超声评估显示心脏结构适宜。在此过程中,还需开展外科手术高危风险评估,对于该例患者而言,缺血是需要重点考量的因素,尤其是当CT提示存在闭塞风险且近期可能发病时,对患者进行造影评估以及血运重建意义重大。倘若回旋支或其他血管出现异常,应先改善血运状况,并给予优化药物治疗1个月。
此外,由于该例患者病情过于复杂,在治疗过程中需要同患者家属详细沟通。
总结
(1)患者所患基础冠心病与缺血性心脏病是明确存在的客观事实。若此次未开展肿瘤治疗,其病情大概率可维持在相对平稳的状态。然而,由于肿瘤靶向治疗的实施,病情发生急剧变化,具体表现为肾衰竭、水肿以及水钠潴留等症状,这些变化进一步加重了基础疾病的严重程度。
(2)从治疗策略的角度来看,鉴于患者病情呈现出的复杂性,现阶段应当将心脏治疗设定为首要的考量方向。首先可通过冠脉造影技术精准地评估心肌缺血的实际状况,以此来确切判断血运重建手术对于缓解二尖瓣反流是否能够产生积极有效的作用。若血运重建手术对该患者的病情改善无法起到明显的作用,那么便可以考虑采用经导管缘对缘修复(TEER)技术进行后续的治疗。
(3)在抗肿瘤治疗方面,如果在心脏治疗完成之后适时重启抗肿瘤治疗,并且不再出现因肿瘤药物引发的不良反应,患者的预后相对而言较为乐观。在此种情况下,重新启动抗肿瘤治疗便是值得的。在此过程中,关键的要点在于精准地把握好重新启动抗肿瘤治疗的时机,例如在确保病情稳定、心力衰竭状况以及肾功能均处于稳定状态的情况下,探寻最为恰当适宜的重启节点。需要特别注意的是,抗肿瘤治疗的重新启动并非一定需要以血运重建手术或TEER治疗的完成为必要前提条件,此外重启治疗后的严密观察,随访也非常重要。
撰稿/梁许红 ;审校:Tina
本文为医谱学术原创文章,转载请标注来源
- End -
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。
- End -



发表留言
暂无留言
输入您的留言参与专家互动