突破传统!仁济医院放射科吴连明、周滟团队开创心肌缺血再灌注损伤治疗新模式
近日,上海交通大学医学院附属仁济医院放射科吴连明、周滟团队在美国化学会旗下权威期刊ACS Nano(中科院一区TOP,影响因子IF= 16)上发表最新研究成果。该研究通过对巨噬细胞进行 “升级改造”,设计了能够主动靶向治疗心肌缺血再灌注损伤的工程化同源巨噬细胞体系并阐述该细胞移植后的潜在调控机制。该工作拓宽了当前细胞疗法的开发范式,为心肌缺血再灌注损伤提供了一种具有前景的低免疫原性疗法。

心肌缺血再灌注损伤(MIRI)是心肌梗死血管再通术后的一种严重并发症,严重者可导致死亡。MIRI进一步加剧心肌梗死范围,伴随着持续强烈的免疫激活、氧化损伤和能量代谢异常。尽管已经开发了各种治疗方法,如抗炎药物、抗氧化剂、抗血小板和抗血栓药物,但受限于缺乏靶向和体内免疫反应,疗效仍然有限。针对这一难题,开发具有低免疫原性的靶向免疫疗法,成为非常有前途的 MIRI 治疗策略。
细胞平台被认为是具有转化前景的药物递送途径,具有诸多优势,包括免疫原性低、循环时间长、固有的靶向潜力和受体整合能力等。近年来,在基础研究领域,利用嵌合抗原受体(CAR)技术的T细胞和巨噬细胞疗法已被开发用于心脏损伤。然而,CAR细胞疗法在自体和异体环境中仍存在一些局限性,例如制备过程复杂、实用性和毒性问题、细胞因子释放综合征以及移植物抗宿主病。因此,有必要探索替代细胞疗法。结合MIRI中的免疫病程以及自体巨噬细胞已开始进入临床试验的背景,团队认识到构建基于同源M2巨噬细胞的药物递送平台和协同疗法的潜力。
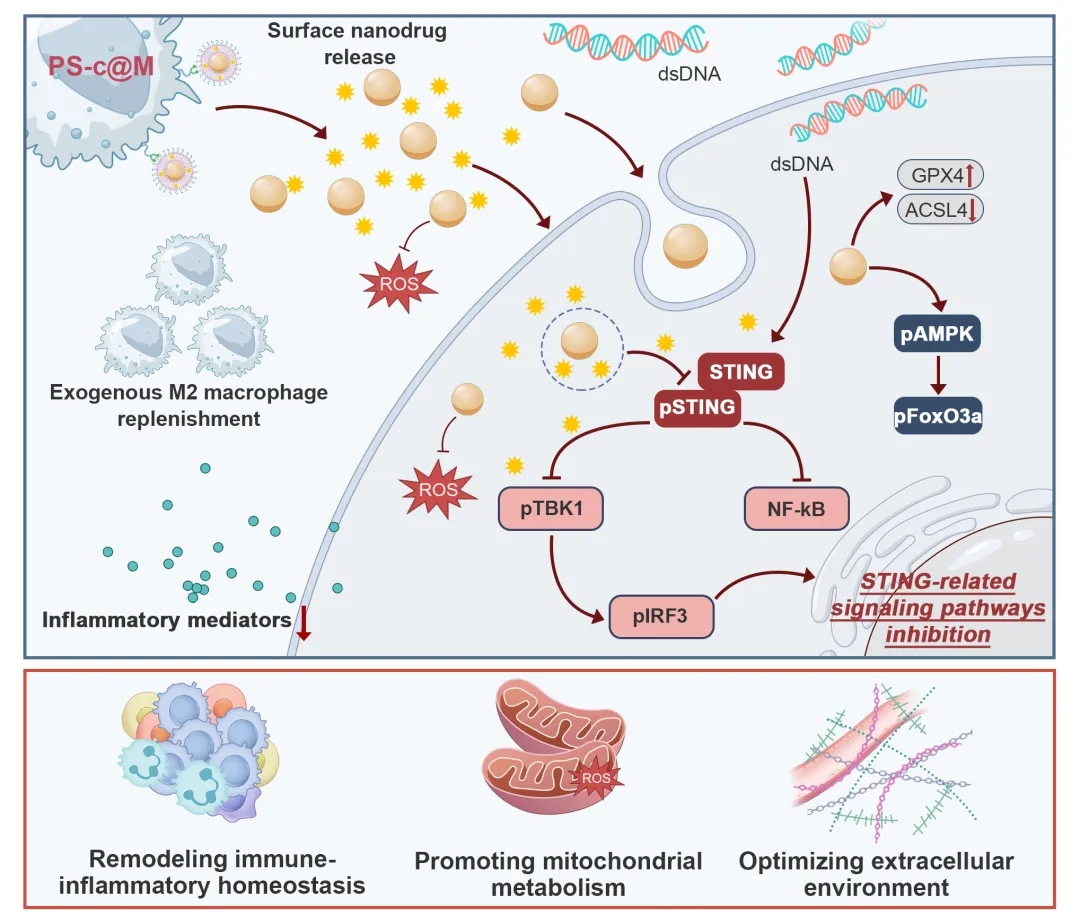
吴连明、周滟团队利用表面修饰技术开发了一种工程化同源巨噬细胞体系(PS-c@M),即在同窝小鼠骨髓源性巨噬细胞诱导的M2巨噬细胞表面负载复合纳米级药物,实现对MIRI的主动靶向治疗。就好比打造了一支超智能的 “快递小队”。普通快递可能送错或低效,但这支小队精准高效。其中,同窝小鼠骨髓诱导的 M2 巨噬细胞是自带定位的“快递员”,熟悉身体环境且具备免疫逃逸;复合纳米级药物是 “特殊包裹”,含硒基和C176免疫调控工具;表面修饰技术则给“快递员” 穿上带口袋的“工作服”,形成PS-c@M体系。当心肌损伤发出“求救信号”,“快递员”就能精准送达“包裹”,完成修复。
该研究表面复合药物为纳米级硒基药物和小分子药物c176(一种脂溶性STING抑制剂)构建的脂质体。PS-c@M 保留了M2巨噬细胞的特性,具有出色的生物相容性,能够有效地被招募到心肌缺血区域,响应性地释放表面负载药物,并维持长期驻留。在体内,PS-c@M移植显著抑制STING相关信号通路和氧化损伤,并激活GPX4和AMPK/FoxO3a信号,从而重塑复杂的免疫炎症和线粒体代谢稳态,并同步优化细胞外环境。最终,PS-c@M 疗法显著挽救心肌细胞,促进心功能恢复,以及避免了不良心室重构。在该体系中,同源巨噬细胞充当高效的药物载体并迅速启动修复过程。这种细胞工程系统为一系列免疫和炎症相关疾病提供了一个开发范例。
上海交通大学医学院附属仁济医院放射科博士研究生程嘉慧、浙大二附院心外科高日峰博士和上海市第五人民医院博士研究生吕杨为第一作者;放射科主任医师吴连明、主治医师李博、上海市第六人民医院实验员张强、助理研究员姜礼贤为该论文的共同通讯作者。该研究得到国家“万人计划”青年拔尖人才项目、国家自然科学基金委、上海市东方英才领军项目、上海市卫生健康领军人才、市科委探索者项目等支持。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c05068
- End -
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动