新型生物可降解封堵器经导管封堵卵圆孔未闭:一项前瞻性、多中心、随机对照临床试验
近期,一项刊登于国际顶级心血管期刊《Circulation》(IF=38.6)的前瞻性、多中心、随机、非劣效性临床试验,首次通过直接比较,证实新型生物可降解PFO封堵器在安全性与有效性方面不劣于传统镍钛合金封堵器。更值得关注的是,超声心动图随访显示,该器械在24个月内可完全降解并“消失”,其有效性与安全性的权威验证,为结构性心脏病介入治疗的无植入时代提供了坚实的临床循证基石。
 文章链接:
文章链接:
https://doi.org/10.1161/CIRCULATIONAHA.125.074609
摘要
背景
新型生物可降解卵圆孔未闭(PFO)封堵器为治疗提供了新的选择。但新型生物可降解封堵器与镍钛合金封堵器相比的疗效和安全性尚未在随机临床试验中得到研究。
方法
这项多中心、随机、非劣性试验旨在探究新型生物可降解的卵圆孔未闭(PFO)封堵器是否能达到与传统镍钛合金封堵器同等的封堵成功率,以及超声心动图上显示的封堵器突出部分是否能够消失。本研究共纳入190例PFO患者,随机分为两组,分别接受生物可降解封堵器(n=96)或镍钛合金封堵器(n=94)治疗。主要疗效终点为术后6个月通过超声心动图显示的PFO封堵成功率。我们还对术后24个月随访期间的器械相关并发症、超声心动图上封堵器降解情况以及封堵成功率进行了持续地评估。
结果
生物可降解封堵器组87例患者(90.63%)和镍钛合金封堵器对照组86例患者(91.49%)成功实现了卵圆孔未闭封堵(ITT)。绝对差异的95%置信区间下限为-8.98%,大于预先设定的非劣效性界值-10%,这表明生物可降解封堵器在封堵成功率方面不劣于镍钛合金封堵器。试验组中有1例患者因术中封堵器未锁定成功而需手术取出封堵器。在整个研究期间,两组均未观察到死亡、栓塞、封堵器上血栓形成或磨损的情况。经胸超声心动图显示,生物可降解封堵器的高回声区在植入后第1年开始缩小,并在植入后24个月时在超声心动图上消失。
结论
这种新型生物可降解卵圆孔未闭封堵器在植入后24个月内可完全降解并在超声心动图上消失,其在有效性和安全性方面均不劣于传统的镍钛合金封堵器。

1 引言
约25%人群卵圆孔终生无法闭合。1,2对于反常栓塞的且复发风险高的患者,PFO介入封堵联合抗血小板治疗可有效预防复发。目前,镍钛合金封堵器在PFO介入封堵中应用广泛,但其可能带来心律失常、血栓及感染等7–10长期并发症,并影响后续经房间隔介入操作。
生物可降解封堵器不但有助于内皮化和天然组织屏障的生成,更能为未来可能的经房间隔穿刺保留通路。但现有可降解封堵器面临两大挑战:首先可降解速率与内皮化不同步,降解过快或者过慢均可能导致残余分流或长期并发症,其次材料弹性及刚性不足,成型及稳定性较差,如借助金属部件增强稳定性,则会增加心脏穿孔和金属部件脱落风险14。
为此,本研究设计了一种新型复合材料的可降解封堵器,通过优化其降解与内皮化速率,并采用成型环和螺纹铆头设计,提升安全性及稳定性。同时引入超声引导经皮介入技术,以解决封堵器在透视下不可见的问题。
本研究旨在通过一项前瞻性、多中心、随机对照临床试验,评估生物可降解封堵器是否能在确保安全降解的同时,达到与镍钛合金封堵器相当的封堵成功率。
2 方法
研究设计与管理
本研究为一项前瞻性、多中心、随机对照临床试验,在以下7家医院开展:云南省阜外心血管病医院、合肥高新心血管病医院、浙江省人民医院、贵州省人民医院、南京医科大学第一附属医院、兰州大学第一医院和兰州大学第二医院。该试验在中国临床试验注册中心(ChiCTR2100042470)注册,并获得各试验点机构审查委员会或伦理委员会的批准。本研究遵循《赫尔辛基宣言》中所阐述的原则。有关试验注册的详细信息已在“中国临床试验注册中心”注册。所有参与者均签署了书面知情同意书。研究的资助方未参与研究设计、数据收集、数据分析、数据解读或论文撰写。通讯作者可全面获取所有研究数据,并对提交论文发表的决定负全责。本研究结果所依据的数据,如有合理需求,可向通讯作者索取。
患者
符合条件的患者年龄在18至65岁,存在卵圆孔未闭(PFO),并同时伴有以下临床指征之一:(1)隐源性卒中或短暂性脑缺血发作,且存在2或3级右向左分流(RLS)15–17;(2)尽管之前接受过抗血小板或抗凝治疗,但仍出现隐源性卒中或短暂性脑缺血发作;(3)隐源性卒中或短暂性脑缺血发作,并伴有确诊的深静脉血栓或肺栓塞;(4)斜卧呼吸直立性低氧血症且存在2或3级右向左分流;(5)难治性或慢性偏头痛且存在2或3级右向左分流;(6)卵圆孔未闭(PFO)合并静脉血栓或下肢静脉曲张/瓣膜功能障碍,静息状态下伴有2或3级的右向左分流;或(7)高危解剖特征,包括房间隔瘤、房间隔摆动幅度大、大型PFO(直径≥4.0mm)或静息状态下右向左分流>1级。
如果患者已知有脑栓塞的病因、感染性心内膜炎、心腔内血栓、导致右向左分流的严重肺动脉高压、或存在抗血小板治疗禁忌证,则予以排除。
样本量与随机化
先前的研究已证实使用各种金属卵圆孔未闭(PFO)封堵器进行经导管PFO封堵的有效性。18根据以往的数据,对照组术后6个月封堵成功率估计为95%。根据以往PFO研究和临床判断结果19–22,设定非劣效性界值为10%,这与以往涉及先天性心脏病新型介入器械的非劣效性试验结果一致。23,24本研究设定双侧显著性水平为0.05,检验效能(1−β)为80%,预计脱落率为20%,每组至少需要94例患者。共计190例患者登记入组,并通过网络随机分组系统以1:1的比例随机分为两组,分别使用新型生物可降解封堵器(试验组)或传统镍钛合金封堵器(对照组)(图1)。
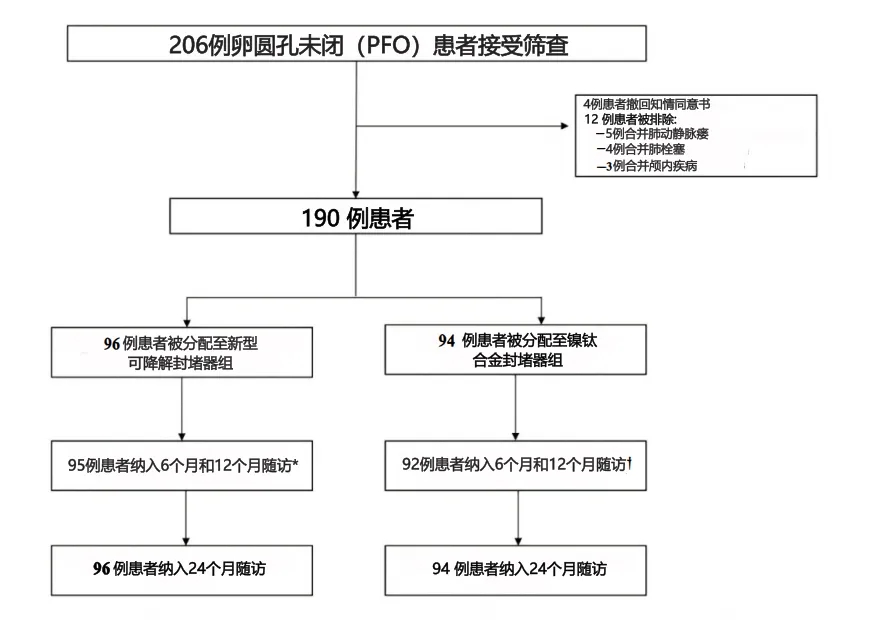
图1.研究流程图
新型生物可降解卵圆孔未闭封堵器
视频S2
这种新型生物可降解封堵器在犬模型中进行了验证,性能已得到评估。在植入后1、3、6、12和24个月时,对房间隔进行了大体解剖和组织病理学评估。详情见补充材料2(图S1)。
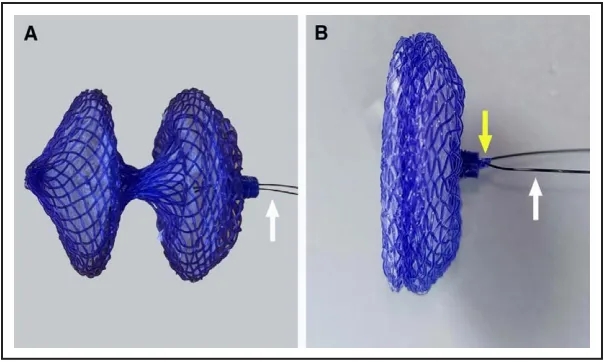
图2.新型生物可降解卵圆孔未闭封堵器
该新型生物可降解封堵器主要由封堵器骨架、阻流膜、成型环(黄色箭头)和成型线(白色箭头)组成。A,未锁定时封堵器形态。B,锁定后封堵器形态。
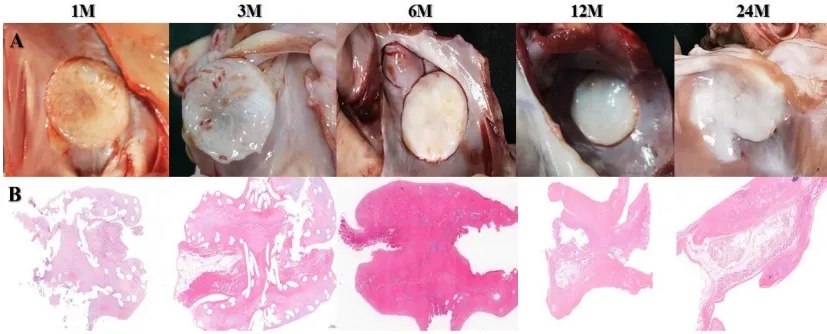
图S1
A,分别展示了植入1、3、6、12和24个月后取出的PFO封堵器的视图。
B,分别展示了在犬类体内植入1、3、6、12和24个月后,取出的封堵器的病理学检查结果。
对照组
对照组患者使用了Cardi-O-fixPFO封堵器。20这种传统的镍钛合金封堵器已在临床实践中广泛应用,其制造材料由Fort Wayne Metals公司提供。
手术过程
在局部麻醉后,试验组在经胸超声(TTE)引导下进行卵圆孔未闭(PFO)封堵术。首先将一根0.035英寸的导丝引入下腔静脉,随后推进至右心房。28在持续的超声引导下,导丝通过PFO进入左心房。接着沿导丝将输送鞘推进至左心房,并在超声引导下通过鞘管释放封堵器。在释放封堵器时,先展开左盘(图3)。若观察到伞盘形态不佳,则轻拉成型线使左盘成型。然后轻轻回撤整个输送系统,使左盘贴合房间隔。接下来,固定钢缆,后撤输送鞘管,展开右盘。为确保右盘成型良好,应在向前抵住输送鞘管的同时向后轻轻牵拉成型线,从而产生相反的力,使封堵器形成“双伞”结构。如果封堵器位置不理想,则将其回收进输送鞘中,并在超声引导下重新展开。一旦封堵器到形态位置良好,进一步牵拉成型线,将成型环锁定在封堵器外部。在超声引导下通过轻轻推拉钢缆进行牵拉试验,以评估封堵器是否锁定。如果封堵器成功锁定,则PFO封堵器整体会随钢缆移动;若封堵器未成功锁定,则右伞盘被牵拉变形,表明需要重新锁定。确认封堵器锁定成功后,剪断并抽出成型线,旋拧钢缆释放封堵器。
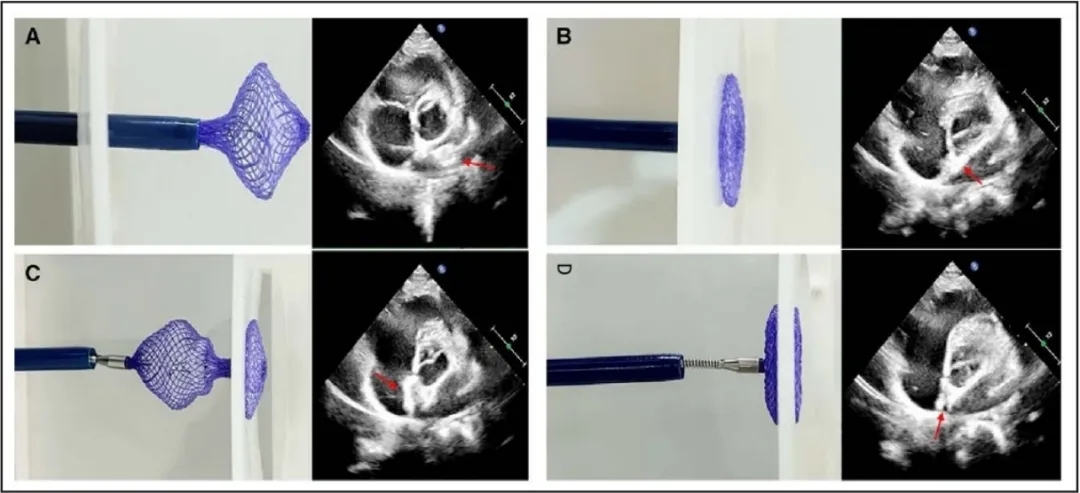
图3.封堵器锁定成型过程示意图
左,器械演示。右,术中TTE影像。A,新型生物可降解封堵器(红色箭头)从输送鞘中展开左盘后呈灯笼状。B,当轻轻牵拉连接在封堵器左盘的成型线时(红色箭头),新型生物可降解封堵器左盘从灯笼状逐渐变化成盘状。C,新型生物可降解封堵器的右盘(红色箭头)从输送鞘中释放后呈灯笼状。D,锁定后整个封堵器形成双伞结构(红色箭头)。
在对照组中,手术在DSA引导下进行,遵循先前所述的镍钛合金卵圆孔未闭封堵器植入标准操作流程。3,29,30
各组患者均在出院前接受经胸右心声学造影检查,以评估封堵器位置稳定性及残余分流情况。术后抗凝治疗为肝素48小时。此外,所有患者均接受了为期6个月的双联抗血小板治疗:阿司匹林(100mg/天)和氯吡格雷(50-75mg/天)。
随访
患者在术前、出院前以及术后1、3、6、12和24个月接受评估。随访评估包括经胸超声(TTE)和12导联心电图。每次随访时,患者均接受全面的临床评估,并详细记录诸如心悸等症状。根据心律学会等组织于2012年发布的专家共识,本研究将心律失常定义为心脏冲动起源、频率、节律、传导速度或激动顺序的任何异常事件。32 术后6个月评估的终点事件包括封堵器移位、死亡率以及其他需要手术或介入治疗的并发症。
根据既定研究方案30,33-35,本研究采用右心声学造影,依据标准化分级系统对右向左分流(RLS)进行半定量评估。分级标准如下:静息状态及Valsalva动作后均分为0级(无微气泡)、1级(1-10个微气泡)、2级(11-30个微气泡)或3级(>30个微气泡)。通过指导患者深吸气后,屏气并用力呼气(闭口捏鼻)完成Valsalva动作。36,37术后6个月和24个月分别对RLS程度进行了评估。
既往研究表明,可降解封堵器的降解过程可通过经胸超声(TTE)上的高回声区进行定量评估。24,25,38在每个时间点(出院前及术后1、3、6、12、24个月),于TTE四腔心切面分别勾勒并计算左、右盘突出部分的高回声区域,采用Philips Medical QLAB定量分析软件对特定区域进行动态分析。降解比例定义为随访各时间点每个盘面(左、右盘分别计算)的高回声面积与其出院前基线测量值的百分比。左、右盘分别进行评估。所有超声检查(包括左、右盘高回声区域的测量)及心电图评估均由中国国家结构性心脏病介入质量控制中心附属核心实验室以盲法独立复核,以支持该新型可降解PFO封堵器的上市审批。
3 研究终点
主要疗效终点
主要有效性终点为术后6个月的封堵成功率,定义为右心声学造影显示右向左分流(RLS)分级为0级或1级。未达到此标准则判定为封堵失败。主要有效性终点采用盲法评估。
安全性终点
安全性终点在术后1、3、6、12及24个月的随访中进行评估。安全性评估包括整个研究期间(含围手术期及随访期)的生命体征监测、心律失常监测、实验室检查结果及不良事件记录。此外,还对封堵器的降解状态进行评估。在24个月随访时,采用相同的预设标准重新评估封堵成功率。
数据分析
本分析遵循意向治疗原则进行。意向治疗人群包括所有随机分组并尝试植入试验封堵器的患者。主要疗效分析使用意向治疗人群和符合方案集进行。连续变量以均值±标准差表示,分类变量以频数和百分比表示。组间差异使用Student t检验分析正态分布的连续变量,使用χ2检验或Fisher确切概率法分析分类变量,使用Wilcoxon秩和检验分析有序分类变量。对于主要疗效分析,使用Cochran-Mantel-Haenszel χ2检验计算组间差异的95%置信区间,并对中心效应进行校正。如果试验组和对照组闭合成功率差异的95%置信区间下限超过-10%,则认为非劣效性成立。所有统计分析均使用SAS9.4版软件进行。双侧P值<0.05被认为具有统计学意义。
4 研究结果
参与者
2021年2月至7月期间,共有190例患者参与了本研究,其中96例被分配至试验组,94例被分配至对照组(图1)。由于新冠疫情,有3例患者(试验组1例,对照组2例)未能参加12个月的随访。我们通过电话与他们取得了联系。在24个月的随访中,所有入组患者均成功完成了住院评估。基线患者特征见表1。两组在人口统计学数据、先天性心脏病家族史、既往病史或金属过敏史方面均无显著差异。试验组在年龄上相对更年轻,中风和糖尿病例数少于对照组,但差异无统计学意义。关于卵圆孔未闭(PFO)特征,试验组中有3例患者(3.13%)存在房间隔膨出瘤,对照组中有4例患者(4.26%)存在房间隔膨出瘤。试验组中分别有0、27和69例患者被归类为RLS1级、2级和3级,对照组中分别有3、28和63例患者被归类为RLS1级、2级和3级。
主要疗效终点
试验组95例患者和对照组94例患者均成功进行了卵圆孔未闭封堵术。试验组中有1例患者在封堵器植入后即刻出现封堵器变形,原因是封堵器未锁定成功。随即手术取出封堵器后发现其成型环未被拉出并固定在封堵器外,这可能是由于操作者经验不足所致。
术后6个月,试验组96例患者中的87例(90.63%)和对照组94例患者中的86例(91.49%)通过右心声学造影确认卵圆孔封堵成功。123例患者(64.7%)的RLS评分为0级;50例患者(28.9%)的RLS评分为1级。9例试验组患者(9.37%)和8例对照组患者(8.51%)卵圆孔封堵未成功。采用意向性治疗人群进行分析,试验组和对照组的封堵成功率绝对值差异为-0.86%(95%置信区间为-8.98%至7.25%)。95%置信区间的下限(-8.98%)大于非劣效性界值-10%,从而证实了非劣效性(表2)。
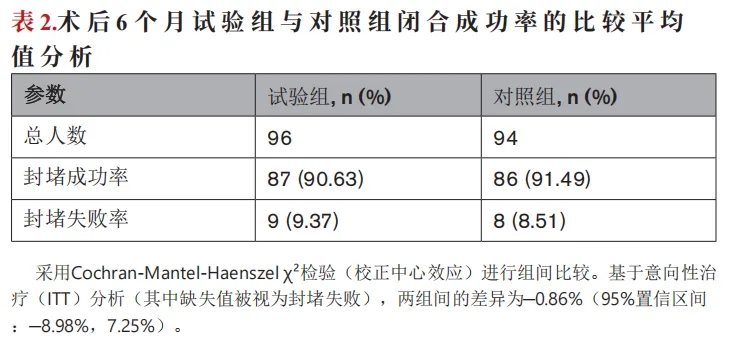
所有患者均在术后24个月接受了随访。24个月时对右向左分流(RLS)进行重新评估,发现试验组中有91例患者(94.79%),对照组中有86例患者(91.49%)的RLS等级为0或1级,两组之间无统计学显著差异(P=0.810)。试验组中RLS等级为0或1级的患者数量从术后6个月的87例增加到了术后24个月的91例。
安全性终点
试验组中有1例患者因术中器械变形而需手术移除。在整个研究期间,包括围手术期和24个月的随访期内,两组均未出现死亡、栓塞、血栓形成、磨蚀或其他严重并发症。对照组中有1例患者出现股静脉穿刺部位出血。1个月随访时,试验组心律失常发生率为5.21%(5/96),对照组为6.38%(6/94)(P=0.766)。24个月随访时,试验组和对照组的心律失常发生率分别为3.13%(3/96)和4.26%(4/94)(P=0.719)。所有术后心律失常的综合总结见表3。两组在24个月内器械相关并发症的发生率无显著差异。
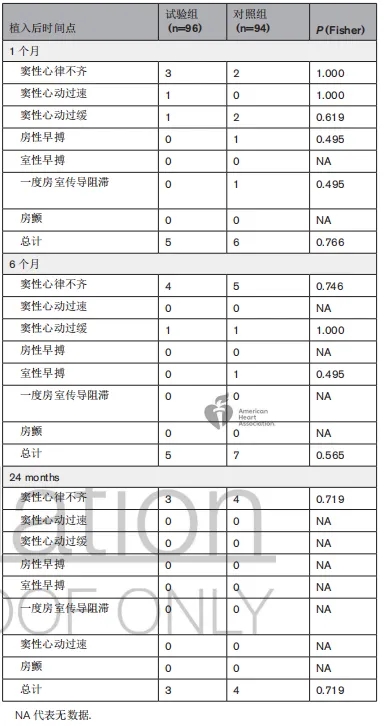
表3.试验组和对照组术后心律失常情况
新型生物可降解封堵器的降解情况
植入6个月后,超声心动图显示新型可降解卵圆孔未闭封堵器表现为自周围心内膜突出的高回声区。至24个月随访时,该封堵器与周围心内膜处于同一水平(图4;视频S3)。在1、3、6、12和24个月随访时,左盘在经胸超声心动图测量的高回声区降解比例分别为92.59%、83.41%、64.62%、16.41%和0%,而右盘分别为92.43%、83.44%、66.26%、17.37%和0%。在每个随访时间点,左、右盘突出的高回声区的降解比例具有可比性,两侧之间未观察到统计学显著差异。至植入后24个月,所有患者经胸超声心动图(TTE)下均未再观察到代表新型可降解封堵器的高回声区,提示封堵器已完全降解(视频S3)。
视频S3
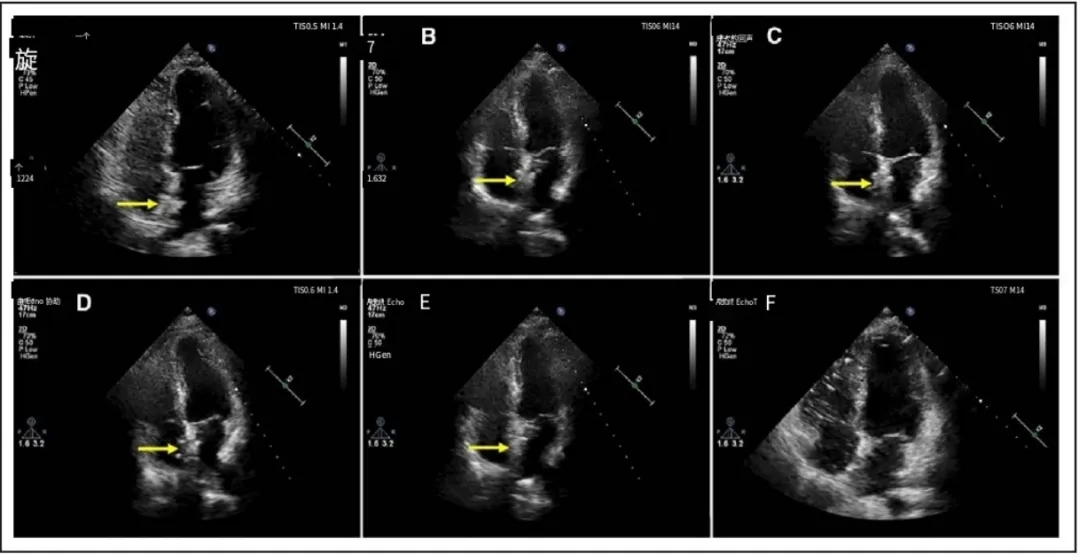
图4. TTE下生物可降解封堵器在术后24个月随访期间的形态学特征变化
黄色箭头所示为生物可降解封堵器。出院前(A)、术后1个月(B)、3个月(C)、6个月(D)、12个月(E)及24个月(F)随访时均进行了经胸超声心动图四腔心切面检查。术后24个月时,封堵器已完全降解。
5 讨论
在这项多中心随机临床试验中,证实了新型生物可降解PFO封堵器的封堵成功率不劣于传统的镍钛合金封堵器,且能安全降解,不会出现再通现象。生物可降解封堵器在6个月和24个月时右向左分流率更低,分别为9.37%和5.1%。这一数据与既往报道(6个月时8.7%至17.7%和24个月时3.5%至13%)结果相符39-41。据我们所知,这是迄今为止唯一直接比较了可降解卵圆孔未闭封堵器与传统金属封堵器安全性和有效性的基于人群研究。
传统封堵器存在的长期并发症风险42-45,并可能妨碍未来房间隔路径介入操作。而面对现有可降解封堵器降解速率与内皮化速率不匹配、封堵器弹性欠佳及透视下不可见等挑战,我们研发了一种新型生物可降解PFO封堵器,25,46采用降解速率快的聚对二氧环己酮(PDO)作为封堵器骨架提供初始力学支撑、降解速率慢的聚乳酸(PLLA)作为阻流膜持续促进内皮化。新型生物可降解封堵器在植入后3个月内完成内皮化,并在约2年内完全降解。这种复合材料设计,在确保封堵器植入期间安全稳定的同时,防止过早再通,同时避免了植入物所引发的慢性炎症和长期并发症风险。
新型生物可降解封堵器创新采用成型环和成型线设计,以促进并强化其释放后形态,使封堵器有足够的结构支撑并防止移位。此前CLOSE、PC和RESPECT47,48研究结果表明,盘状封堵器的封堵疗效优于非盘状封堵器,且失败率、房颤发生率也更低。基于这些结果,双盘式卵圆孔未闭封堵器对于广大患者人群是更合适的选择。
这种生物可降解封堵器在超声引导下植入可实现全程可视化(图3),手术过程中操作者可评估确认左盘是否贴靠房间隔,右盘释放是否恰当。此外,超声心动图还能帮助操作者在封堵器最终锁定前确认其是否对称贴靠在房间隔两侧。成型环就位后,超声下进行牵拉测试,以评估右盘变形情况。若右盘被牵拉变形则表明封堵器未锁定成功,需要重新锁定。与金属封堵器一样,可降解卵圆孔未闭封堵器的直径大于肺动脉瓣环和主动脉瓣环,即使封堵器移位,也会留在心腔内。在超声引导下,可使用圈套器捕获并回收封堵器。可降解封堵器的植入存在学习曲线,但对于有金属封堵器植入经验的操作者来说,通过适当且充分的培训,能够克服学习曲线,达到良好的操作效果。
通过超声心动图可监测到生物可降解封堵器的降解过程,24,25本研究显示,生物可降解PFO封堵器在植入后6个月内能保持完整结构以实现封堵缺损,其主要降解过程发生在12个月内。到24个月时,封堵器的高回声区域已消失,封堵器逐步被房间隔组织替代。25左右盘的降解速率无显著差异。此前关于室间隔缺损封堵器的研究显示左盘的高回声区域下降速度快于右盘。这种差异归因于左心室的压力和血流速度高于右心室。14,24,49,50本研究可降解PFO封堵器左右盘具有相似的降解速率,与既往发现一致,进一步支持左、右心房压力相当促进均匀降解这一假设。
6 局限性
卵圆孔未闭封堵术的适应证仍存在争议。本研究主要评估可降解卵圆孔未闭封堵器与传统金属封堵器在有效封堵PFO所致右向左分流方面的非劣效性。未来需要更大规模的随机对照试验来进一步明确卵圆孔未闭封堵的临床适应症。由于无法获取人体组织学样本,因此无法通过病理学金标准直接验证封堵器的完全降解。因此,超声心动图上观察到的高回声区域的变化间接反映了降解过程。本研究的随访时间相对较短且样本量有限,因此需要更多的大规模研究来全面评估生物可降解封堵器的长期安全性。该生物可降解封堵器在血管造影或计算机断层扫描中不可见,但在超声心动图中清晰可见。因此,尽管本研究未使用计算机断层扫描和血管造影,但超声心动图成像为生物可可降解封堵器的安全有效植入提供了足够的指导。在24个月的随访中,尽管两组间残余RLS没有观察到统计学意义上的显著差异,但试验组中RLS呈现下降趋势,需要进一步的研究来阐明导致这一趋势的潜在机制。
总结
这种新型生物可降解PFO封堵器在植入后24个月内于超声心动图上消失,其在有效性和安全性方面均表现出色,不劣于传统镍钛合金封堵器。
参考文献
1. Meissner I, Whisnant JP, Khandheria BK, Spittell PC, O’ Fallon WM, Pascoe RD, Enriquez-Sarano M, Seward JB, Covalt JL, Sicks JD, et al. Preva-lence of potential risk factors for stroke assessed by transesophageal echocardiography and carotid ultrasonography: the SPARC study: Stroke Prevention: Assessment of Risk in a Community. Mayo Clin Proc. 1999;74: 862– 869. doi: 10.4065/74.9.862
2. Yuan K, Kasner SE. Patent foramen ovale and cryptogenic stroke: diagnosis and updates in secondary stroke prevention. Stroke Vasc Neurol. 2018;3:84– 91. doi: 10.1136/svn-2018-000173
3. Lee PH, Song JK, Kim JS, Heo R, Lee S, Kim DH, Song JM, Kang DH, Kwon SU, Kang DW, et al. Cryptogenic stroke and high-risk patent foramen ovale: the DEFENSE-PFO trial. J Am Coll Cardiol. 2018;71: 2335– 2342. doi: 10.1016/j.jacc.2018.02.046
4. Mas JL, Derumeaux G, Guillon B, Massardier E, Hosseini H, Mechtouff L, Arquizan C, Bé jot Y, Vuillier F, Detante O, et al; CLOSE Investigators. Patent foramen ovale closure or anticoagulation vs. antiplatelets after stroke. N Engl J Med. 2017;377:1011– 1021. doi: 10.1056/ NEJMoa1705915
5. Sø ndergaard L, Kasner SE, Rhodes JF, Andersen G, Iversen HK, NielsenKudsk JE, Settergren M, Sjö strand C, Roine RO, Hildick-Smith D, et al; Gore REDUCE Clinical Study Investigators. Patent foramen ova-le closure or antiplatelet therapy for cryptogenic stroke. N Engl J Med. 2017;377:1033– 1042. doi:10.1056/NEJMoa1707404
6. Apostolos A, Gregoriou S, Drakopoulou M, Trantalis G, Tsiogka A, Ktenopoulos N, Aggeli K, Stratigos A, Tsioufis K, Toutouzas K. Patent foramen ovale closure in patients with and without nickel hypersensitivity: a randomized trial. Circ Cardiovasc Interv. 2025;18:e015228. doi: 10.1161/CIRCINTERVENTIONS.125.015228
7. Lakkireddy D, Thaler D, Ellis CR, Swarup V, Sondergaard L, Carroll J, Gold MR, Hermiller J, Diener HC, Schmidt B, et al. Amplatzer Amulet left atrial appendage occluder versus Watchman device for stroke prophylaxis (Amulet IDE): a randomized, controlled trial. Circulation. 2021;144:1543– 1552. doi: 10.1161/CIRCULATIONAHA.121.057063
8. Krumsdorf U, Ostermayer S, Billinger K, Trepels T, Zadan E, Horvath K, Sievert H. Incidence and clinical course of thrombus formation on atrial septal defect and patient foramen ovale closure devices in 1,000 consecutive patients. J Am Coll Cardiol. 2004;43:302– 309. doi: 10.1016/j. jacc.2003.10.030
9. Kim YJ, Park SJ, Shin SY, Hong J. Removed 5-year-old amulet de-vice: triplet of peridevice leakage, poor endothelialization, and device-related thrombus. JACC Cardiovasc Interv. 2021;14:2405– 2406. doi: 10.1016/j. jcin.2021.07.007
10. Wang Y, Li G, Yang L, Luo R, Guo G. Development of innovative biomateri-als and devices for the treatment of cardiovascular diseases. Adv Mater. 2022;34:e2201971. doi: 10.1002/adma.202201971
11. Li YF, Chen ZW, Xie ZF, Wang SS, Xie YM, Zhang ZW. Recent development of biodegradable occlusion devices for intra-atrial shunts. Rev Cardiovasc Med. 2024;25:159. doi: 10.31083/j.rcm2505159
12. Xu Q, Fa H, Yang P, Wang Q, Xing Q. Progress of biodegradable polymer application in cardiac occluders. J Biomed Mater Res B Appl Biomater. 2024;112:e35351. doi: 10.1002/jbm.b.35351
13. Matsuzaki Y, Berman DP, Kurobe H, Kelly JM, Iwaki R, Blum K, Toshihiro S, Harrison A, Cheatham JP, Shinoka T. Pre-clinical evolution of a novel transcatheter bioabsorbable ASD/PFO occluder device. Pediatr Cardiol. 2022;43:986– 994. doi: 10.1007/s00246-021-02809-5
14. Baspinar O, Kervancioglu M, Kilinc M, Irdem A. Bioabsorbable atrial septal occluder for percutaneous closure of atrial septal defect in children. Tex Heart Inst J. 2012;39:184– 189.
15. Hou S, Wang P, Long Y, Li M, Zhang Y, Zhang L, Zhang X, Zhou D, Pan W, Ge J. A novel patent foramen ovale occluder with left clamp arms. JACC Basic Transl Sci. 2025;10:422– 433. doi: 10.1016/j.jacbts.2024.11. 012
16. Maffè S, Dellavesa P, Zenone F, Paino AM, Paffoni P, Perucca A, Kozel D, Signorotti F, Bielli M, Parravicini U, et al. Transthoracic second harmonic two-and three-dimensional echocardiography for detection of patent foramen ovale. Eur J Echocardiogr. 2010;11:57– 63. doi: 10.1093/ ejechocard/jep165
17. Zhu Y, Zhang J, Huang B, Liu Y, Deng Y, Weng Y, Sun R. Impact of patent foramen ovale anatomic features on right-to-left shunt in patients with cryptogenic stroke. Ultrasound Med Biol. 2021;47:1289– 1298. doi: 10. 1016/j.ultrasmedbio.2021.01.004
18. Gevorgyan Fleming R, Kumar P, West B, Noureddin N, Rusheen J, Aboulhosn J, Tobis JM. Comparison of residual shunt rate and complications across 6 different closure devices for patent foramen ovale. Catheter Cardiovasc Interv. 2020;95:365– 372. doi: 10.1002/ccd.28527
19. Han Y, Zhang X, Zhang F. Patent foramen ovale closure by using transesophageal echocardiography for cryptogenic stroke: single centerexperience in 132 consecutive patients. J Cardiothorac Surg. 2020;15:11. doi: 10.1186/s13019-020-1042-4
20. Zhao E, Liu W, Zhang Y, Cheng G, Du Y, He L, Wang X, He X. Safety and efficacy of Cardi-O-fix occluder for percutaneous closure of a patent foramen ovale: a single-center prospective study. Medicine (Baltimore). 2017;96:e6572. doi: 10.1097/MD.0000000000006572
21. He L, Cheng GS, Du YJ, Zhang YS. Multidisciplinary assessment of PFO with substantial right-to-left shunting and medium-term follow-up after PFO device closure: a single-center experience. J Interv Cardiol. 2017;30: 362– 367. doi: 10.1111/joic.12396
22. Carroll JD, Saver JL, Thaler DE, Smalling RW, Berry S, MacDonald LA, Marks DS, Tirschwell DL; RESPECT Investigators. Closure of patent fora-men ovale versus medical therapy after cryptogenic stroke. N Engl J Med. 2013;368:1092– 1100. doi: 10.1056/NEJMoa1301440
23. Kenny D, Eicken A, Dahnert I, Boudjemline Y, Sievert H, Schneider MB, Gori T, Hijazi ZM; Investigators. A randomized, controlled, multi-center trial of the efficacy and safety of the Occlutech Figulla Flex-II Occluder compared with the Amplatzer Septal Occluder for transcatheter closure of secundum atrial septal defects. Catheter Cardiovasc Interv. 2019;93: 316– 321. doi: 10.1002/ccd.27899
24. Wang S, Li Z, Wang Y, Zhao T, Mo X, Fan T, Li J, You T, Deng R, Ouyang W, et al. Transcatheter closure of perimembranous ventricular septal defect using a novel fully bioabsorbable occluder: multicenter randomized controlled trial. Sci Bull (Beijing). 2023;68:1051– 1059. doi: 10.1016/j.scib.2023.04.027
25. Li Z, Kong P, Liu X, Feng S, Ouyang W, Wang S, Hu X, Xie Y, Zhang F, Zhang Y, et al. A fully biodegradable polydioxanone occluder for ventricle septal defect closure. Bioact Mater. 2023;24:252– 262. doi: 10.1016/ j.bioactmat.2022.12.018
26. Middleton JC, Tipton AJ. Synthetic biodegradable polymers as orthopedic devices. Biomaterials. 2000;21:2335– 2346. doi: 10.1016/s0142- 9612(00)00101-0
27. Oberhauser JP, Hossainy S, Rapoza RJ. Design principles and performance of bioresorbable polymeric vascular scaffolds. EuroIntervention. 2009;5(Suppl F):F15– F22. doi: 10.4244/EIJV5IFA3 28. Yang T, Butera G, Ou-Yang WB, Zhao GZ, Zhang FW, Pan XB. Percutaneous closure of patent foramen ovale under transthoracic echocardiography guidance: midterm results. J Thorac Dis. 2019;11:2297– 2304. doi: 10.21037/jtd.2019.06.17
29. Tobis JM, Charles A, Silberstein SD, Sorensen S, Maini B, Horwitz PA, Gurley JC. Percutaneous closure of patent foramen ovale in patients with migraine: the PREMIUM trial. J Am Coll Cardiol. 2017;70:2766– 2774. doi: 10.1016/j.jacc.2017.09.1105
30. Saver JL, Carroll JD, Thaler DE, Smalling RW, MacDonald LA, Marks DS, Tirschwell DL; RESPECT Investigators. Long-term outcomes of patent foramen ovale closure or medical therapy after stroke. N Engl J Med. 2017;377:1022– 1032. doi: 10.1056/NEJMoa1610057 31. Harb SC, Huded CP. Structural interventions and procedural imaging. JACCCardiovasc Interv. 2020;13:2121– 2123. doi: 10.1016/j.jcin.2020.06.063
32. Calkins H, Kuck KH, Cappato R, Brugada J, Camm AJ, Chen SA, Crijns HJ, Damiano RJ Jr, Davies DW, DiMarco J, et al. 2012 HRS/EHRA/ ECAS ex-pert consensus statement on catheter and surgical ablation of atrial fibrilla-tion: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, end points, and research trial design. Europace. 2012;14:528– 606. doi: 10.1093/ europace/eus027
33. Derbes VJ, Kerr A Jr. Valsalva’ s maneuver and Weber’ s experiment. N Engl J Med. 1955;253:822– 823. doi: 10.1056/NEJM19551110253190 7
34. Rodrigues AC, Picard MH, Carbone A, Arruda AL, Flores T, Klohn J, Furtado M, Lira-Filho EB, Cerri GG, Andrade JL. Importance of adequately performed Valsalva maneuver to detect patent foramen ovale during transesophageal echocardiography. J Am Soc Echocardiogr. 2013; 26:1337– 1343. doi: 10.1016/j.echo.2013.07.016
35. Shah AH, Osten M, Benson L, Alnasser S, Bach Y, Vishwanath R, Van De Bruaene A, Shulman H, Navaranjan J, Khan R, et al. Incidence and outcomes of positive bubble contrast study results after transcatheter closure of a patent foramen ovale. JACC Cardiovasc Interv. 2018;11:1095– 1104. doi: 10.1016/j.jcin.2018.03.008
36. Gaspardone A, Sgueglia GA, De Santis A, D’ Ascoli E, Iamele M, Piccioni F, Giannico B, D’ Errico F, Gioffrè G, Summaria F, et al. Predictors of re-sidual right-to-left shunt after percutaneous suturemediated patent fossa ovalis closure. JACC Cardiovasc Interv. 2020;13: 2112– 2120. doi: 10.1016/j.jcin.2020.06.004
37. Mullen MJ, Hildick-Smith D, De Giovanni JV, Duke C, Hillis WS, Morrison WL, Jux C. BioSTAR Evaluation Study (BEST): a prospective, mul-ticenter, phase I clinical trial to evaluate the feasibility, efficacy, and safety of the BioSTAR bioabsorbable septal repair implant for the closure of atrial-level shunts. Circulation. 2006;114:1962– 1967. doi: 10. 1161/CIRCULATIONAHA.106.664672
38. Chen L, Hu S, Luo Z, Butera G, Cao Q, Zhang F, Lu M, Wang S, Wang W, Pan X. First-in-human experience with a novel fully bioabsorbable occluder for ventricular septal defect. JACC Cardiovasc Interv. 2020;13: 1139– 1141. doi: 10.1016/j.jcin.2019.09.057
39. Witte LS, El Bouziani A, Beijk MAM, Robbers-Visser D, Coutinho JM, Tijssen JGP, Straver B, Bouma BJ, de Winter RJ. Persistence of residual shunt at 6 and 12 months after transoesophageal echocardiographyguided percu-taneous closure of a patent foramen ovale for cryptogenic stroke. Heart. 2024;110:1172– 1179. doi: 10.1136/heartjnl-2024-323905
40. Caputi L, Butera G, Anzola GP, Carminati M, Carriero MR, Chessa M, Onorato E, Rigatelli G, Sangiorgi G, Santoro G, et al; Italian Patent Foramen Ovale Survey investigators. Residual shunt after patent fora-men ovale closure: preliminary results from Italian patent foramen ovale survey. J Stroke Cerebrovasc Dis. 2013;22:e219– e226. doi: 10.1016/j. jstrokecerebrovasdis.2012.12.002
41. Hammerstingl C, Bauriedel B, Stü sser C, Momcilovic D, Tuleta I, Nickenig G, Skowasch D. Risk and fate of residual interatrial shunting after transcath-eter closure of patent foramen ovale: a long term follow up study. Eur J Med Res. 2011;16:13– 19. doi: 10.1186/2047-783x-16-1-13
42. Lin C, Liu L, Liu Y, Leng J. Recent developments in next-generation occlusion devices. Acta Biomater. 2021;128:100– 119. doi: 10.1016/j. actbio.2021.04.050Bridges ND, Hellenbrand W, Latson L, Filiano J, Newburger JW,Lock JE. Transcatheter closure of patent foramen ovale after pre-sumed paradoxical embolism. Circulation. 1992;86:1902– 1908. doi: 10.1161/01. cir.86.6.1902
44. Meier B. Patent foramen ovale and closure technique with the amplatzer oc-cluder. Scientifica (Cairo). 2014;2014:129196. doi: 10.1155/2014/ 129196
45. Collado FMS, Poulin MF, Murphy JJ, Jneid H, Kavinsky CJ. Patent foramen ovale closure for stroke prevention and other disorders. J Am Heart Assoc. 2018;7:e007146. doi: 10.1161/JAHA.117.007146
46. Lu W, Ouyang W, Wang S, Liu Y, Zhang F, Wang W, Pan X. A novel totally bio-degradable device for effective atrial septal defect closure: a 2- year study in sheep. J Interv Cardiol. 2018;31:841– 848. doi: 10.1111/joic. 12550
47. Stortecky S, da Costa BR, Mattle HP, Carroll J, Hornung M, Sievert H, Trelle S, Windecker S, Meier B, Jü ni P. Percutaneous closure of patent foramen ovale in patients with cryptogenic embolism: a network metaanalysis. Eur Heart J. 2015;36:120– 128. doi: 10.1093/eurheartj/ehu292
48. Hornung M, Bertog SC, Franke J, Id D, Taaffe M, Wunderlich N, Vaskelyte L, Hofmann I, Sievert H. Long-term results of a random-ized trial comparing three different devices for percutaneous closureof a patent foramen ovale. Eur Heart J. 2013;34:3362– 3369. doi: 10.1093/ eurheartj/eht283
49. Sievert K, Bertog S, Sö derberg B, Gafoor S, Hofmann I, Grunwald I, Schnelle N, Sievert H. Transcatheter closure of atrial septal defect and patent fora-men ovale with Carag bioresorbable septal occluder: first-inman experi-ence with 24-month follow-up. EuroIntervention. 2022;17: 1536– 1537. doi: 10.4244/EIJ-D-21-00740
50. Pavcnik D, Tekulve K, Uchida BT, Luo ZH, Jeromel M, Van Alstine WG, Keller FS, Rö sch J. Double BioDisk: a new bioprosthetic device for transcatheter closure of atrial septal defects: a feasibility study in adult sheep. Radiol On-col. 2012;46:89– 96. doi: 10.2478/v10019-012-0029-8
51. Saver JL, Carroll JD, Thaler DE, Smalling RW, MacDonald LA, Marks DS, Tirschwell DL; RESPECT Investigators. Long-term outcomes of patent foramen ovale closure or medical therapy after stroke. N Engl J Med. 2017;377:1022– 1032. doi: 10.1056/NEJMoa1610057
52. Lopez L, Saurers DL, Barker PCA, Cohen MS, Colan SD, Dwyer J, Forsha D, Friedberg MK, Lai WW, Printz BF, et al. Guidelines for performing a comprehensive pediatric transthoracic echocardiogram: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2024;37:119– 170. doi: 10.1016/j.echo.2023.11.015
53. Marriott K, Manins V, Forshaw A, Wright J, Pascoe R. Detection of rightto-left atrial communication using agitated saline contrast imaging: experience with 1162 patients and recommendations for echocardiography. J Am Soc Echocardiogr. 2013;26:96– 102. doi: 10. 1016/j.echo.2012.09.007

扫描二维码即可下载PDF原文
-End-
荆志成教授:可降解ASD封堵器成功封堵房间隔缺损伴房间隔膨出瘤
成功封堵17mm房缺:介入引导导丝联合可降解封堵器实施介入封堵

扫码观看可降解学苑精彩内容
-END-
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系

发表留言
暂无留言
输入您的留言参与专家互动