中国原创技术登顶《JAMA》|生物可降解房间隔缺损封堵器与传统金属封堵器的多中心随机对照临床试验
近日,国际顶尖医学期刊《JAMA》(美国医学会杂志,IF:55.0)在线发表了一项具有里程碑意义的临床研究成果:由云南省阜外心血管病医院潘湘斌教授团队、四川大学王云兵教授团队与乐普心泰医疗共同研发的生物可降解房间隔缺损封堵器,在全球首个大规模、多中心随机对照临床试验中证实,其疗效与安全性不劣于传统金属封堵器,并在植入后两年内实现近乎完全降解。这是JAMA创刊近150年来发表首个中国原创医疗器械研究,标志着我国在结构性心脏病介入创新器械领域取得重大突破。

文献链接:Ouyang W, Jiang H, Yan X, et al. Bioresorbable vs Metallic Occluders for Transcatheter Atrial Septal Defect Closure: A Randomized Clinical Trial. JAMA. Published online October 23, 2025. doi:10.1001/jama.2025.17639
摘要
重要性
用于房间隔缺损封堵的永久性金属封堵器存在晚期并发症风险,并可能影响左心房通路。生物可降解封堵器有望解决这些局限性,但尚未在随机临床试验中得到验证。
目的
评估生物可降解封堵器在经导管房间隔缺损封堵的疗效和安全性方面是否不劣于金属封堵器。
试验设计与参与者
这项多中心、非劣效性、开放标签的随机临床试验纳入了继发孔型房间隔缺损患者。研究于2021年5月8日至2022年8月3日在中国境内10家医院开展,于2024年9月结束为期两年的随访。
干预措施
参与者按1:1比例随机分配接受生物可降解封堵器(116例)或金属封堵器(114例)。
主要结局指标
6个月时房间隔缺损封堵成功率(封堵成功定义为手术成功且通过经胸超声心动图评估后残余分流直径≤2mm)。在两年随访时,比较两组封堵成功率及器械相关不良事件,并评估生物可降解封堵器的降解情况。
结果
在随机分配的230例受试者中,生物可降解封堵器组有1例因股静脉细小未尝试植入,最终纳入分析229例(中位年龄14.1岁[IQR 7.0-37.3岁],女性占68%)。6个月时,生物可降解封堵器组房间隔缺损封堵成功率为96.5%(111/115),金属封堵器组为97.4%(111/114)(组间差异-0.8% [95%CI -5.0至3.7],非劣效性P<0.001)。至2年时,两组间房间隔缺损封堵成功率(生物可降解组94.8%[109/115] vs 金属组96.5%[110/114];P=0.75)及器械相关不良事件发生率(分别为2.6%[3/115] vs 3.5%[4/114];P=0.72)均无统计学显著差异。生物可降解封堵器2年降解率约为99.8%。
结论与意义
生物可降解封堵器在房间隔缺损封堵中不劣于金属封堵器,且在两年内近乎完全降解。这些发现表明,生物可降解封堵器可为经导管房间隔缺损封堵提供一种有价值的创新选择。
引言
房间隔缺损(ASD)在新生儿中发生率约为1‰,占先天性心脏病的10%,其中75%为继发孔型[1,2];ASD临床表现可从无症状到劳力性呼吸困难,心律失常等,对存在显著分流、相关临床症状或潜在矛盾栓塞风险的患者需进行干预。对于解剖结构合适的继发孔型ASD(直径≤38mm且边缘≥5mm[主动脉缘除外])首选经皮介入封堵避免开胸[1-3],临床常用镍钛合金封堵器,但可能引发心律失常[5]、血栓形成[6]及心脏侵蚀等并发症[8,9],且永久留存体内并影响后续房间隔介入通路[10,11]。
生物可降解封堵器作为极具前景的替代方案,除了能有效封堵ASD并促进内皮化,并能逐步降解并完成自体组织重塑[10,12]。但其应用仍面临两大挑战[13]:首先封堵器需在内皮化完成前保持结构稳定性,并在1-2年内完全降解[10,12]——降解过快可能导致ASD再通,过慢影响组织正常重塑;其次材料弹性不足[14],双盘结构释放后复原受限,增加变形或移位风险。[15]
本研究研发了一种由复合材料制成的可降解封堵器,旨在平衡降解速率与内皮化进程,同时保持封堵器弹性恢复能力[17],通过成型环与成型线设计确保封堵器结构稳定性,并在超声心动图引导下精准植入以弥补其透视不可见性[18,19]。临床前研究显示该创新技术应用前景良好[17]。本随机临床试验系统评估了可降解封堵器与金属封堵器在ASD封堵术后6个月及2年的安全性、有效性及降解特性。
关键点
问题:生物可降解封堵器在经导管房间隔缺损封堵术中是否不劣于金属封堵器,并能表现出降解的证据?
发现:这项纳入了230例继发孔型房间隔缺损患者的多中心随机非劣效性试验显示,生物可降解封堵器在6个月时实现了与金属封堵器相当的封堵成功率(96.5% vs 97.4%),并在2年内几乎完全降解(约99.8%)。
意义:生物可降解封堵器在房间隔缺损封堵术中不劣于金属封堵器,且能在2年内基本完全降解,为经导管介入治疗提供了有价值的新选择。
方法
研究设计与管理
这项多中心、开放标签、非劣效性的随机临床试验在中国境内10家医院开展。试验方案及其修订版详见补充材料1-3,由研究者制定并经各医院的独立伦理委员会或机构审查委员会批准。所有参与者或其法定代理人均签署了知情同意书。
统计分析计划及其修订版详见补充材料4-6。试验由指导委员会监督医院选址和研究者遴选,评估患者资格,并支持受试者招募与保留工作。独立的数据与安全监察委员会定期进行安全性审查以保障参与者权益。所有超声心动图评估均由隶属于国家结构性心脏病质量控制中心的核心实验室独立复核。本研究采用临床试验报告统一标准(CONSORT)进行报告规范。
患者
符合以下经胸超声心动图解剖学标准的2至65岁继发孔型房间隔缺损患者可入选:(1)缺损直径≥5mm且存在右心容量负荷增加,或缺损直径≤28mm伴左向右分流;(2)缺损边缘距关键心内结构(上腔静脉、下腔静脉、心房后缘)最短距离≥5mm,距房室瓣最短距离≥7mm;(3)无需要外科治疗的其他心脏畸形。排除标准包括:感染性心内膜炎、心腔内血栓、重度肺动脉高压及抗血小板治疗禁忌证。
试验流程
受试者按1:1比例随机分配至生物可降解封堵器组或金属封堵器组。随机化方案通过中心化网络系统实施,按临床中心分层,采用固定区组大小为4的分层随机方法,所有试验数据均采用电子化管理(图1)。由于通过检查可辨别分组情况,且研究结局指标均为客观指标,故未对受试者设盲。但临床评估、随访检查及数据分析均采用盲法进行。
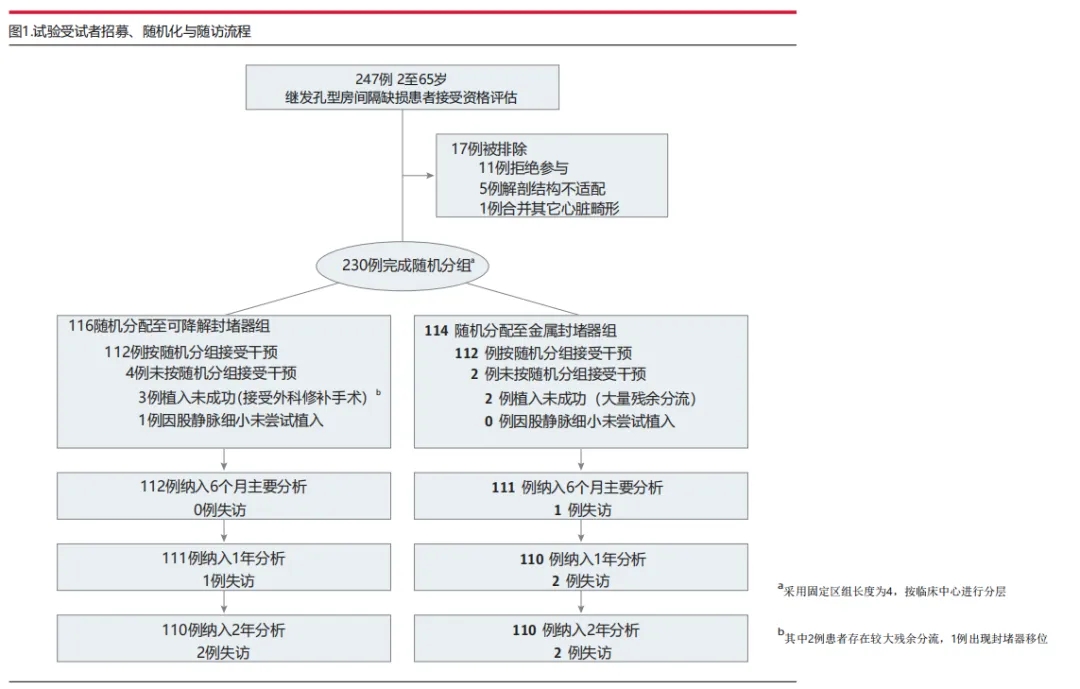
图1:试验受试者招募、随机化与随访流程
试验器械
可降解封堵器
生物可降解封堵器(上海形状记忆合金材料有限公司)由支撑骨架、阻流膜、成型环与成型线组成(图2及e图1 [A1、A2])。该封堵器采用复合材料的创新设计,以优化各组分的特性。其聚对二氧环己酮单丝骨架在形成结构性左右封堵盘的同时,兼具快速降解的特性与维持结构所需的刚性及弹性;而降解速度较慢的聚乳酸则作为阻流膜——当聚对二氧环己酮逐渐降解时,存留的聚乳酸不仅能促进内皮化进程,更能有效防止房间隔缺损再通,直至最终代谢为二氧化碳与水。
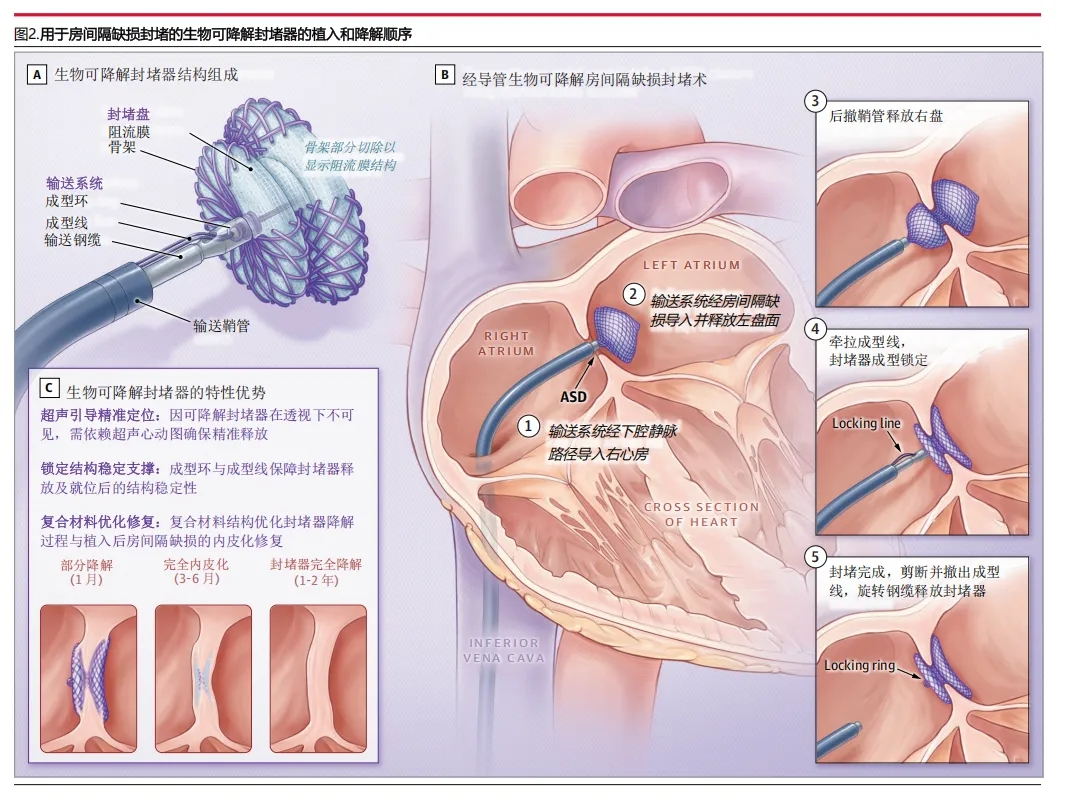
图2:用于房间隔缺损封堵的生物可降解封堵器的植入和降解顺序
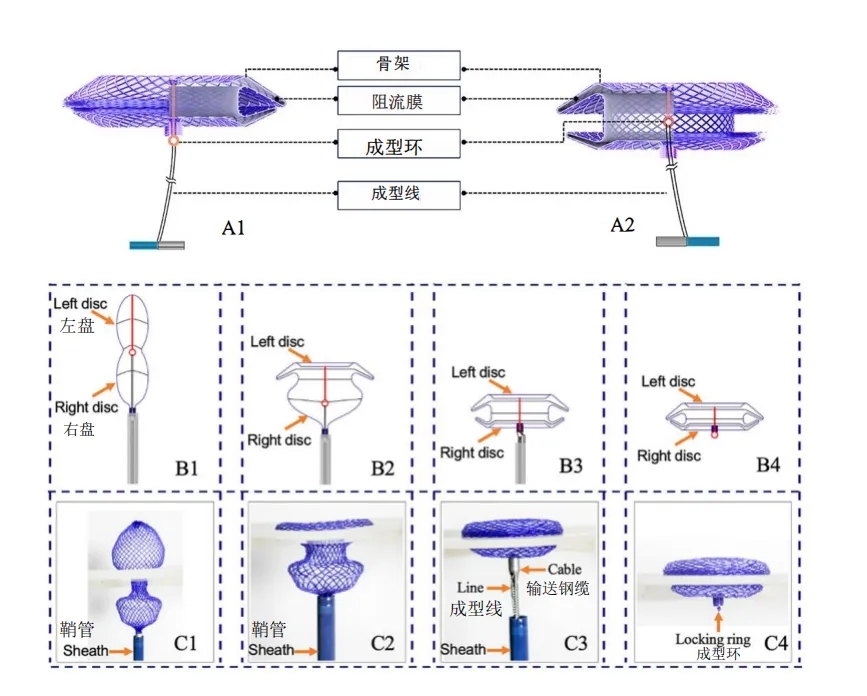
e图1. 生物可降解封堵器结构示意图(A1、A2)与成型过程(B1-B4、C1-C4)
A1. 封堵器处于锁定状态,成型环位于外部。
A2. 封堵器处于自然未锁定状态,成型环位于内部。
B1、C1. 从输送鞘管释放后,封堵器呈灯笼形状。
B2、C2. 通过牵拉成型线,封堵器左盘面从球形转变为盘状。
B3、C3. 通过牵拉成型线并推送输送钢缆,封堵器形成"双盘"结构。此时成型环移至外部,确保封堵器牢固锁定。
B4、C4. 移除成型线与钢缆后,封堵器完成锁定,双盘结构稳固附着于房间隔。
该封堵器的锁定系统由聚对二氧环己酮制成的成型环与尼龙制成的成型线构成。该成型环位于封堵器腰部,连接左盘面并与成型线连接,可通过输送鞘管进行外部操控。从鞘管释放后,封堵器初始呈哑铃形态(e图1的B1、C1);牵拉锁定线可拉出成型环,带动双盘对合形成稳定结构(e图1的B3、C3)。回撤锁定系统即可使封堵器恢复初始形态。该封堵器提供腰部直径6-32mm规格尺寸,适配9-16 Fr输送鞘管(e图2)。
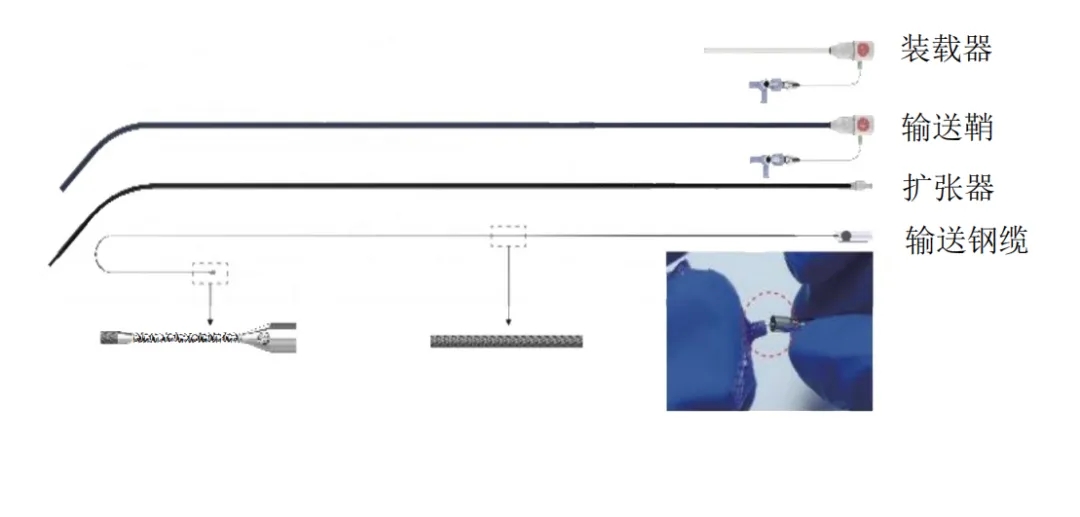
e图2 生物可降解房间隔缺损封堵器输送系统
该输送系统由装载器、输送鞘、扩张器及输送钢缆四个核心组件构成。其关键创新在于钢缆头端采用侧孔设计,使成型线可贯穿该侧孔。此项设计同时实现两大功能:在维持钢缆头端内螺纹与封堵器连接的同时,避免成型线与钢缆的缠绕。
金属封堵器
作为对照的金属封堵器(上海形状记忆合金材料有限公司)是一种自对位装置,由镍钛合金丝编织的双盘结构及腰部组成(e图3)。本研究使用的传统镍钛合金封堵器已通过欧洲CE认证(证书号650110),并在临床广泛应用,其具体结构特征已有文献详述[20]。

e图3. 金属房间隔缺损封堵器实物图
该自膨胀式金属封堵器采用双盘镍钛合金网状结构并配有可调节腰部,提供30种规格选择(腰部直径6-50mm,以1mm或2mm递增),整套系统适配7-14 Fr输送鞘管。
手术要点
所有手术均经股静脉路径实施。生物可降解封堵器及其操作技术的演示视频已在线发布。该封堵器在经胸超声心动图引导下完成释放。儿童患者接受丙泊酚镇静,青少年及成人患者则在股静脉穿刺部位注射1%利多卡因进行局部麻醉。经股静脉送入6Fr多功能导管与加硬导丝至右心房,通过房间隔缺损后撤出导管,将导丝留置在左肺静脉。随后置入9-16 Fr输送鞘管(根据封堵器直径选择规格)。
生物可降解封堵器的规格选择需比经胸超声心动图测量的房间隔缺损最长直径大8mm。在撤出导丝和扩张器后,通过输送鞘管释放封堵器。相较于金属封堵器常规的大6mm选择,可降解封堵器通常需要比ASD最长直径大8mm,这是由于其材料更柔软且弹性回缩较弱的特性——通过增加径向支撑力可确保封堵器稳定性、实现有效封堵,并维持封堵器形态完整性。操作时通过牵拉成型线将左盘从球形转变为盘状,随后回撤整个输送系统使伞盘贴靠房间隔。
随后,固定钢缆的同时回撤鞘管以释放右盘,形成双盘结构。术中使用经胸超声心动图评估封堵器位置并检测是否存在潜在的心脏压迫。确认封堵器位置理想后,通过牵拉成型线将成型环从封堵器内拉出完成锁定。随后进行推拉测试:回撤输送鞘管约3cm,若左盘未发生形变而右盘发生形变则提示未锁定成功;若封堵器保持双盘形态,随间隔同步运动则确认锁定成功。锁定完成后,固定钢缆并前抵鞘管,剪断并抽出成型线,最后逆时针旋转钢缆释放封堵器。
金属封堵器植入流程与此类似,但无需锁定步骤。其规格通常选择比经胸超声测量的缺损最长直径大约6mm。术中未采用球囊测量缺损直径,详细操作步骤已另文报道。[20]
两组患者术后均口服阿司匹林6个月。在基线期、术后1、3、6个月及1、2年时,按计划进行临床评估、实验室检查、12导联心电图和经胸超声心动图检查。此外,生物可降解组在2年时接受经食道超声心动图检查,以确认通过经胸超声发现的残余分流。
主要及次要结局指标
主要结局指标为6个月房间隔缺损封堵成功率(封堵成功标准:手术成功且经胸超声心动图评估残余分流直径≤2 mm)[21]。次要结局指标包括器械成功率(指封堵器成功输送并精准释放至目标位置后完整撤出输送系统)及手术成功率(指在实现器械成功的基础上未发生主要不良事件)。
主要不良事件包括死亡、大出血、心脏压塞、血栓栓塞、需永久起搏器植入或介入治疗的心律失常,以及因封堵器栓塞或较大残余分流等并发症需外科干预的情况。
心电图异常(包括右束支传导阻滞及电轴偏离)定义为通过12导联心电图检测发现的任何传导或节律障碍[22]。当受试者出现心悸、头晕或气短等症状时,需完整记录症状并及时接受心电图检查。瓣膜反流程度经胸超声心动图评估,分为0级(无/微量)、1级(轻度)、2级(中度)和3级(重度);残余分流同样通过经胸超声心动图评估,按分流直径分为:微量(<1mm)、小型(1-2mm)、中型(2-4mm)及大型(≥4mm)[23]。
封堵器降解程度评估
如既往研究所述[18,19,24],本研究采用QLAB软件(飞利浦医疗)结合经胸超声心动图对封堵器降解情况进行定量分析。生物可降解封堵器在超声影像中呈现为自周围心内膜突出的高回声区域,其降解进程通过双盘结构中该高回声区域的缩减程度进行量化评估。
统计学分析
本研究对主要结局指标采用非劣效性检验,设定6个月房间隔缺损封堵成功率的非劣效界值为10%。该界值选择与既往房间隔缺损封堵器对比研究采用的安全有效性标准一致[25,26],也是心血管新型器械评估的常用界值[27]。在预期封堵成功率94%的前提下,此界值确保临床可接受的最低成功率不低于84%——该阈值相较于早期研究报道的71.2%-98.5%成功率范围[4,25,26,28]属于中等水平。考虑20%脱落率后,计算得出224例样本量可在单侧α=0.025检验水准下达到80%统计效能。统计分析计划及其修订详见补充材料4-6。
所有统计分析均遵循意向性治疗原则。全分析集包含所有接受封堵尝试的随机化受试者,敏感性分析和心电图异常评估则采用符合方案集。数值变量以均数(标准差)或中位数(四分位距)表示,分类变量以频数(百分比)描述。组间比较分别采用:正态分布数值变量使用t检验,分类变量使用χ²检验或Fisher精确检验,等级资料或非正态分布数据使用Wilcoxon秩和检验。
主要结局采用全分析集和符合方案集进行同时分析。对主要结局缺失数据采用最差情况结转法进行填补,敏感性分析应用临界点法。组间比较采用Cochran-Mantel-Haenszel χ²检验,敏感性分析中额外调整医院中心、性别和肺动脉高压等协变量。计算率差的双侧95%置信区间,非劣效检验基于渐近z评分。所有分析使用SAS 9.4版(SAS Institute Inc)完成,定义P<0.05为具有统计学意义。
研究结果
受试者人群特征
共230例受试者完成随机分组(生物可降解封堵器组116例 vs 金属封堵器组114例),其中生物可降解组1例因股静脉细小未尝试植入,最终纳入分析229例(中位年龄14.1岁[IQR 7.0-37.3岁],女性占比68%)。生物可降解组3例植入未完成(2例因残余分流过大,1例在锁定过程中封堵器被拉入右心房后经皮取出);金属封堵器组2例因残余分流过大未植入,1例失访6个月随访。研究入组时间为2021年5月8日至2022年8月3日,于2024年9月结束2年的随访期。
全分析集包含接受封堵尝试的受试者(生物可降解组115例 vs 金属封堵器组114例),符合方案集包含成功植入封堵器且完成6个月主要结局分析的受试者(分别为112例 vs 111例)。至2年随访时,每组各有2例受试者未发生临床事件,且未完成经胸超声心动图或12导联心电图评估,最终每组各110例纳入2年随访分析(图1)。
基线特征详见表1及e表1。生物可降解组男性比例较高(38.3%[44/115] vs 25.4%[29/114],P=0.04),肺动脉高压发生率较低(1.7%[2/115] vs 7.9%[9/114],P=0.03)(表1)。两组在人口学特征、既往病史、用药情况及超声心动图参数等方面均未观察到显著差异(表1及补充材料e表2)。
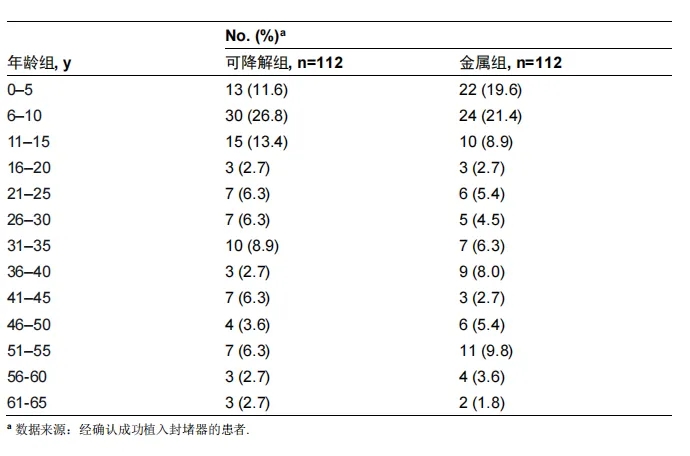
e表1. 生物可降解封堵器组与金属封堵器组受试者年龄分布
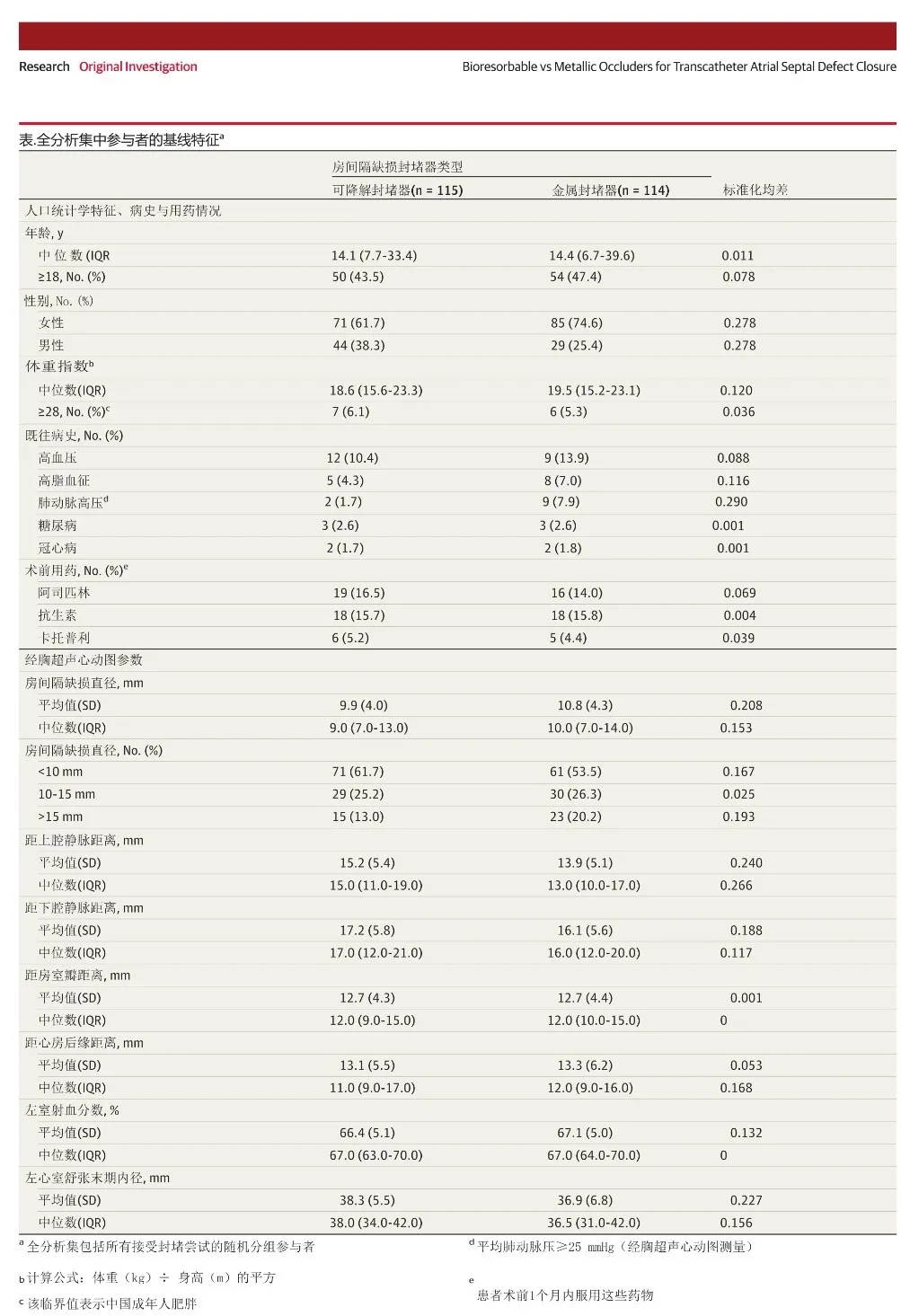
表1.全分析集中参考者的基线特征
e表2. 全分析集患者术前用药情况(术前1个月)
围手术期结果
手术特征详见补充材料e表3。两组各有112例受试者成功植入单个封堵器(生物可降解/金属),所有器械均成功植入且输送系统撤出过程中未发生不良事件。生物可降解封堵器组术中房间隔缺损封堵成功率与手术成功率均为97.4%(112/115),金属封堵器组均为98.2%(112/114)(两组率比较P=0.67)。生物可降解组植入封堵器中位尺寸为18.0mm(IQR 14.0-20.0mm),金属组为18.0mm(IQR 14.0-22.0mm)(P=0.42);中位手术时间分别为46.0分钟(IQR 37.0-51.0分钟)与42.0分钟(IQR 36.0-49.0分钟)(P=0.14)。值得注意的是,生物可降解封堵器组需使用更大规格的输送鞘管(14.0 Fr vs 金属组10.0 Fr,P<0.001)。
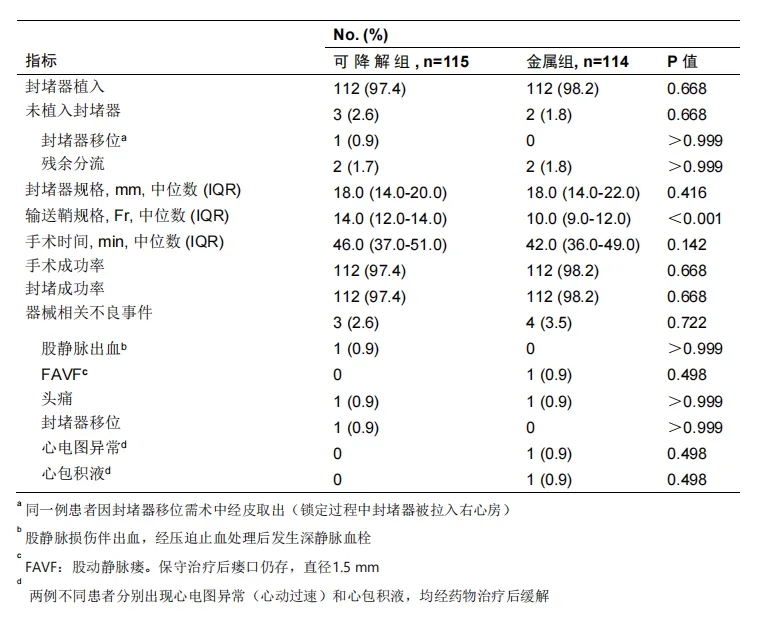
e表3. 全分析集患者围术期结果
主要结局指标
随访期间,生物可降解封堵器组1例受试者在6个月、1年及2年随访时均持续存在稳定的6mm残余分流。金属封堵器组1例受试者缺失6个月经胸超声心动图评估数据,但其余评估时点未发现残余分流。主要结局分析显示:生物可降解封堵器组6个月房间隔缺损封堵成功率为96.5%(111/115),金属封堵器组为97.4%(111/114)(组间差异-0.8%[95%CI -5.0至3.7],非劣效性检验P<0.001)(图3)。采用符合方案集的敏感性分析(调整医院中心、性别及肺动脉高压因素)显示,生物可降解组封堵成功率为99.1%(111/112),金属组为100%(111/111)(组间差异-1.1%[95%CI -3.1至1.0],P<0.001)。所有95%置信区间下限(-5.5至-2.6)均高于-10%的非劣效界值,证实了非劣效性成立,验证了试验设定的非劣效界值合理性。
随访结果
随访期间症状详情见补充材料e表4,用药情况详见e表5。在2年随访期间,两组均未发生主要不良事件(如封堵器移位、栓塞或死亡)。全分析集分析显示,2年时两组房间隔缺损封堵成功率无显著差异(生物可降解组94.8%[109/115] vs 金属组96.5%[110/114];P=0.75)(图3)。
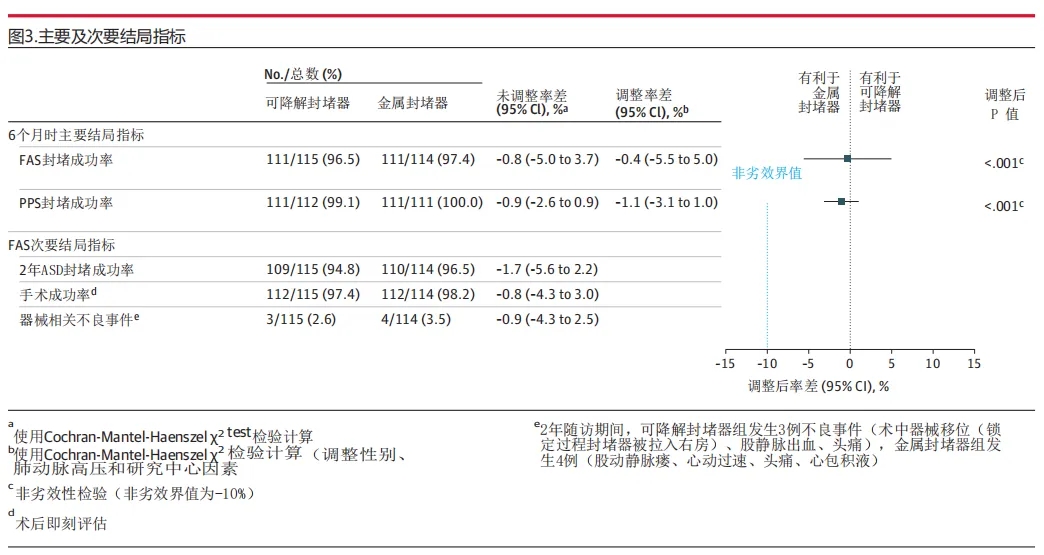
图3:主要及次要结局指标
至2年1个月时,生物可降解组中1例持续存在6mm残余分流的受试者(曾在6个月、1年及2年随访时均显示稳定分流)接受了外科手术。术中发现封堵器已完全降解并完成内皮化,但降解区域外存在一个额外的房间隔缺损从而导致分流。免疫组织化学显示降解区域出现气泡样改变,这与动物实验中观察到的实体组织替代模式不同(e图4)。
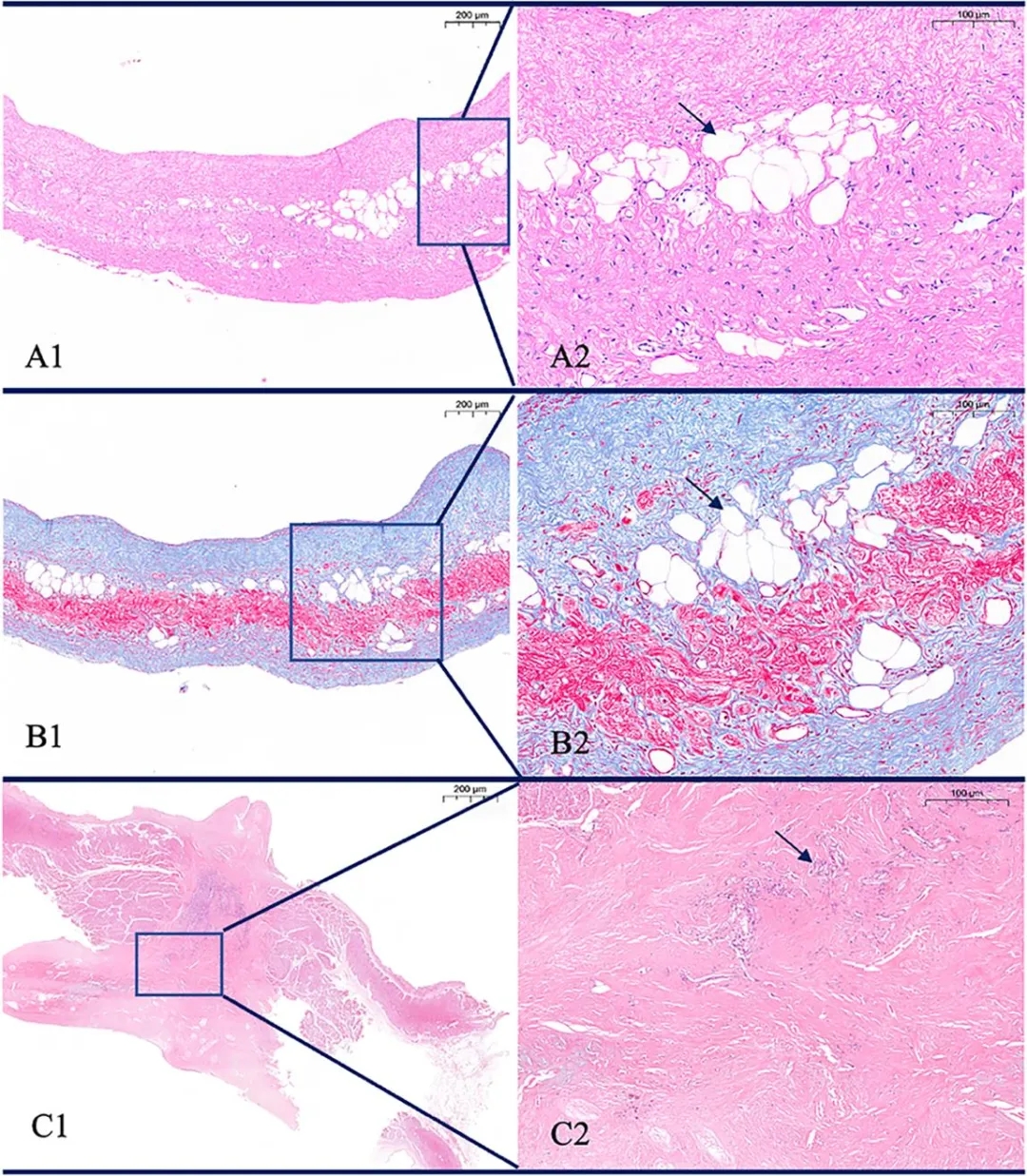
e图4. 封堵器植入两年后人体(A1、A2、B1、B2)与动物(C1、C2)组织标本染色
HE染色(A1、A2)与Masson染色(B1、B2)显示,随着封堵器降解,其覆盖区域逐渐被纤维细胞和内皮细胞替代。封堵器降解后,人体内的封堵器骨架呈现气泡样改变(箭头所示),未被实体组织所替代。与之相反,动物封堵器(C1、C2)被纤维细胞完全替代,未见气泡样改变(箭头所示)
器械相关不良事件(均发生于围手术期)在生物可降解组发生率为2.6%(3/115),金属组为3.5%(4/114)(P=0.72)(图3)。两组在三尖瓣反流改善方面无显著差异(e图5),但心电图异常和二尖瓣反流的组间差异在2年时具有统计学意义。
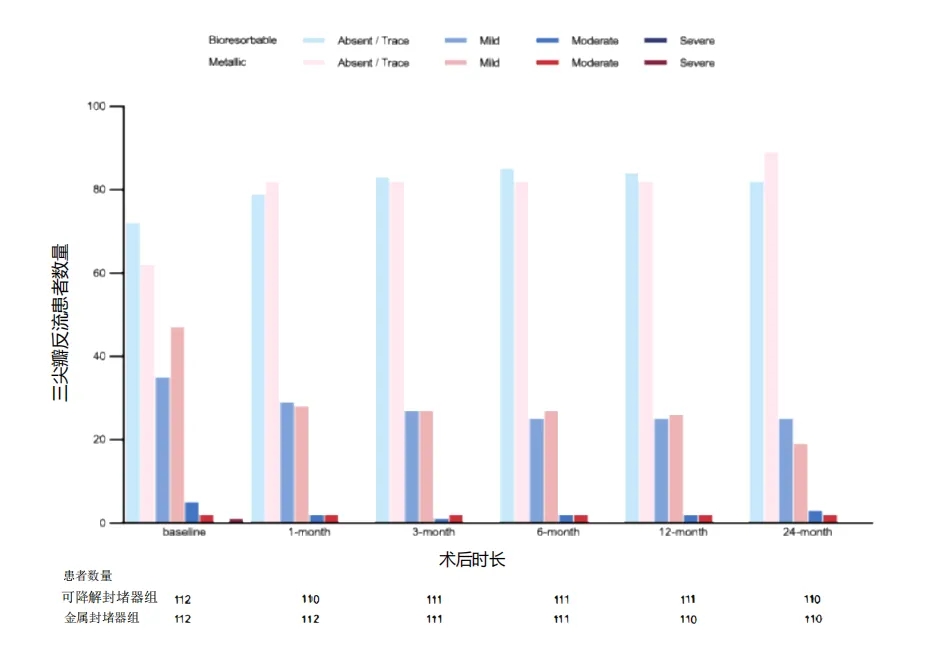
e图5. 两组术后三尖瓣反流严重程度随时间变化趋势
房间隔缺损封堵术后,两组患者的三尖瓣反流程度均有所改善,但组间差异无统计学意义。
研究期间观察到的主要心电图异常包括不完全性或完全性右束支传导阻滞及电轴偏离,未发现房颤或房扑病例)。2年随访时,生物可降解封堵器组出现心电图异常的受试者比例显著低于金属封堵器组(62/109 [56.9%] vs 80/111 [72.1%],P=0.02)。亚组分析显示,在术前无心电图异常的受试者中,生物可降解组新发心电图异常的比例在2年时持续低于金属组(23/69 [33.3%] vs 32/62 [51.6%],P=0.03)。
所有病例均未出现需外科干预的瓣膜反流。生物可降解组二尖瓣反流程度保持稳定,而金属组则观察到进展性改变,包括3例新发中度二尖瓣反流。2年时二尖瓣反流严重程度评估显示,生物可降解组中位分级为0级(IQR 0-1),金属组为0级(IQR 0-2),Wilcoxon秩和检验显示组间差异具有统计学意义(P=0.007)(e图6)。
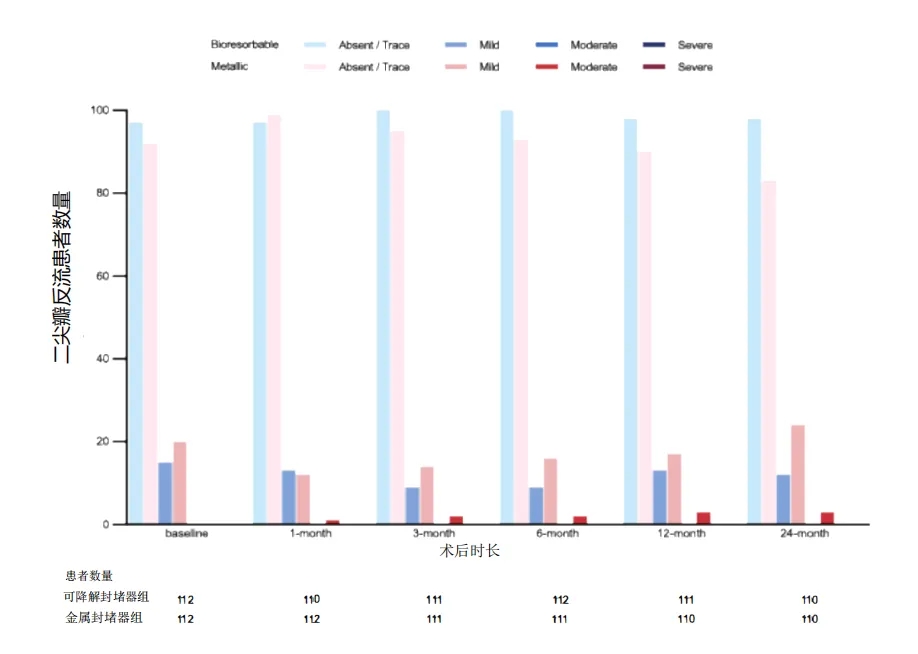
e图6. 两组术后二尖瓣反流严重程度随时间变化
生物可降解组二尖瓣反流程度保持稳定,而金属组则出现进展性加重,组间差异在24个月时具有统计学意义。
生物可降解封堵器的降解特征
生物可降解封堵器降解率约为99.8%。从出院至2年期间,经胸超声心动图心尖四腔心切面评估显示:左盘中位面积从210.0mm²(IQR 160.0-250.0 mm²)减少至0mm²(IQR 0-0mm²),右盘中位面积从200.0mm²(IQR 150.0-237.5mm²)减少至0mm²(IQR 0-0mm²)(图4A及补充材料e图7)。左伞盘的中位降解保留率随时间变化为:1个月95.6%(IQR 92.4%-100%),3个月78.9%(IQR 72.3%-84.5%),6个月40.0%(IQR 29.1%-48.0%),1年18.2%(IQR 13.3%-24.0%),2年时降至0%(IQR 0%-0%)。右盘降解模式相似:1个月95.1%(IQR 91.7%-100%),3个月79.0%(IQR 69.2%-85.2%),6个月37.5%(IQR 31.1%-46.5%),1年18.8%(IQR 13.6%-23.9%),2年时同样降至0%(IQR 0%-0%)。左右伞盘在各时间点的降解速率基本一致(图4B)。
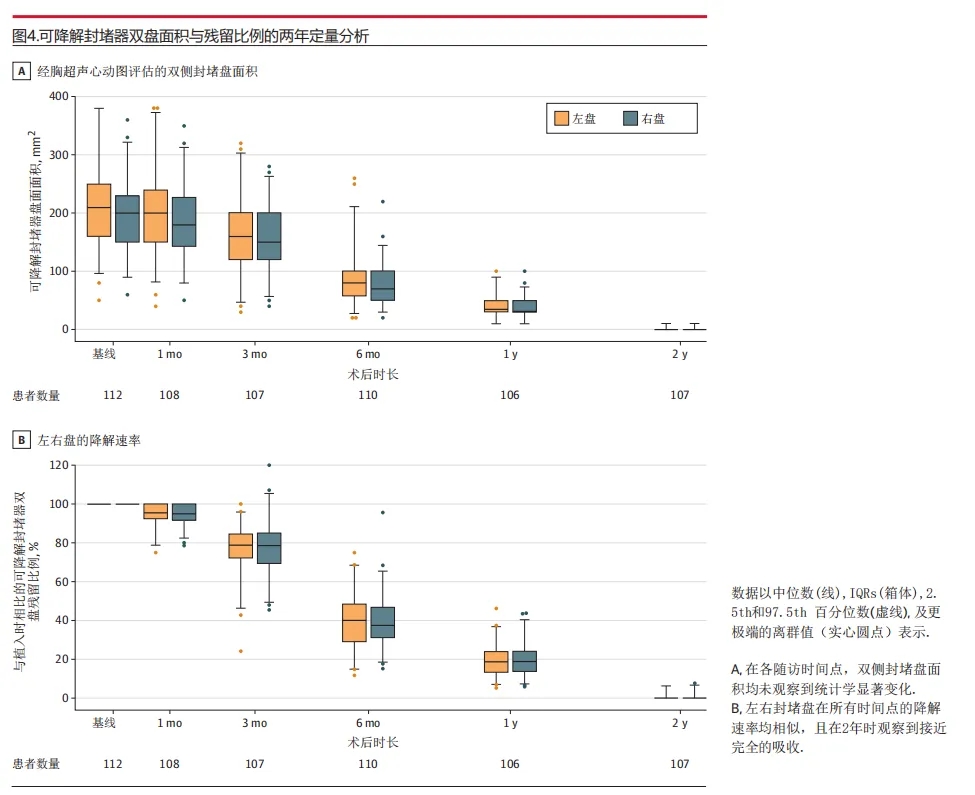
图4:可降解封堵器双盘面积与残留比例的两年定量分析
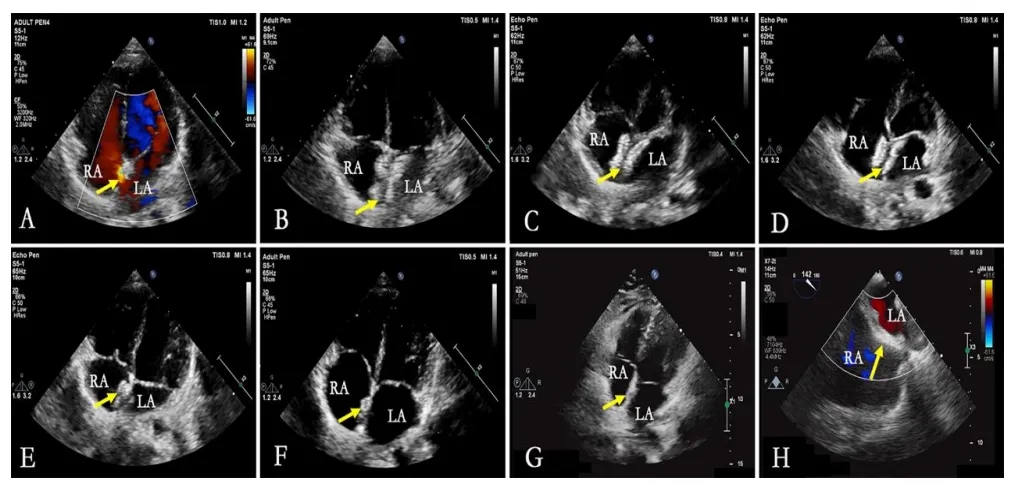
e图7. 生物可降解封堵器24个月随访期间形态变化的超声心动图评估 (RA-右心房,LA-左心房)
A. 术前评估显示房间隔缺损(箭头指示)
B-G. 分别为出院前及术后1、3、6、12、24个月时的经胸超声心动图四腔心切面,显示封堵器形态(箭头指示)
H. 24个月时经食道超声心动图显示封堵器降解后房间隔形态(箭头指示)
讨论
本研究证实,新型生物可降解房间隔缺损封堵器术后6个月及2年随访的安全性与有效性均不劣于传统金属封堵器,且在2年内实现近乎完全降解,受试者心电图异常发生率更低、二尖瓣反流进展更少。基于此,中国国家药品监督管理局已批准该生物可降解封堵器用于临床房间隔缺损封堵治疗。
生物可降解封堵器的降解特性对其临床封堵效果具有关键影响。既往研究[21,29]显示金属封堵器及部分可降解封堵器在6个月时残余分流率为3%-4%,而全可降解封堵器(Absnow)在2年时可达60%[30]。本研究中,生物可降解封堵器早期分流率仅为0.9%,且2年内无迟发性残余分流。其降解过程为:1个月内降解约5%,3个月达25%,1年超过80%,2年基本完全降解。该降解轨迹既保证了组织愈合初期的结构支撑,又在此后加速降解。2年1个月时,封堵器区域逐渐被纤维细胞和内皮细胞替代。然而,人体中的气泡样降解模式与动物模型存在差异,组织替代可能滞后于器械降解。尽管本研究未发现降解周期不匹配导致缺损再通,但仍需警惕降解过快可能增加的再通风险。
由于生物可降解封堵器的射线可透性,超声心动图引导下的实时影像能确保在释放右盘前,左盘与房间隔精准对齐,并有助于确认锁定牢固。既往使用可降解室间隔缺损封堵器的经验[18]已证实,超声引导(特别是在锁定过程中)可有效避免封堵器被拉入右心房事件的发生。
房间隔缺损封堵术后有高达25%的患者在3年4个月内发生房性心律失常[27],可能与术后房间隔几何结构改变有关[5]。本研究中,生物可降解封堵器组在2年时总体及新发心电图异常均少于金属封堵器组。此优势可能源于其逐渐降解与组织重塑减轻了心脏结构改变与异物刺激。组织学显示,生物可降解封堵器能减轻炎症浸润并提高修复型M2巨噬细胞比例[19,28],该组织修复特性可能是心电图异常差异的内在机制。
房间隔缺损封堵术后二尖瓣反流加重见于10%-37%的患者[31],常与封堵器引发的结构重构[32]或房间隔硬度增加[7]相关。本试验中,生物可降解封堵器组二尖瓣反流保持稳定,而金属封堵器组则出现进展。早期术后TTE评估显示两组植入部位均存在房间隔运动受限,但至2年时,生物可降解封堵器组受试者的房间隔可与心动周期同步运动(参见视频),且二尖瓣附近未见残留异物,提示封堵器降解及及组织重塑有助于维持生理性的间隔运动,可能对保护二尖瓣功能具有积极意义。
研究局限性
本研究存在若干局限性。首先,尽管样本量足以检测主要结局的组间差异,但可能不足以识别罕见不良事件或次要结局的细微差别。其次,虽然2年随访期已覆盖封堵器完整降解周期,但评估迟发性并发症(特别是与降解过程相关的并发症)仍需更长的观察时间。第三,在临床应用层面,尽管生物可降解封堵器的设计理论上有利于未来实施房间隔穿刺(如房颤消融手术),但本研究未评估这一潜在优势。第四,残余分流和器械降解程度评估均采用经胸超声心动图,虽符合临床实践规范,但经食道超声可能提供更高的诊断确定性。第五,对观察到的心电图异常和二尖瓣反流需审慎解读:研究通过标准心电图评估异常情况,但未纳入连续心律失常监测或与临床确诊心律失常的系统关联分析;此外,大多数二尖瓣反流病例程度轻微且不具备临床显著性。未来研究需要通过延长随访时间、扩大队列规模、采用更全面的影像学与监测方案来验证这些发现。
结论
生物可降解封堵器在房间隔缺损封堵术中,其疗效和安全性均不劣于金属封堵器,且能在2年内实现近乎完全降解。这些发现表明,生物可降解封堵器有望成为经导管房间隔缺损封堵术重要的新选择。
参考文献
1. Baumgartner H, De Backer J, Babu-Narayan SV, et al; ESC Scientific Document Group. 2020 ESC guidelines for the management of adult congenital heart disease. Eur Heart J. 2021;42(6):563-645. doi:10.1093/eurheartj/ehaa554
2. Geva T, Martins JD, Wald RM. Atrial septal defects. Lancet. 2014;383(9932):1921-1932. doi:10. 1016/S0140-6736(13)62145-5
3. Ooi YK, Kelleman M, Ehrlich A, et al. Transcatheter versus surgical closure of atrial septal defects in children: a value comparison.JACC Cardiovasc Interv. 2016;9(1):79-86. doi:10.1016/j. jcin.2015.09.028
4. Turner DR, Owada CY, Sang CJ Jr, Khan M, Lim DS. Closure of secundum atrial septal defects with the Amplatzer septal occluder: a prospective, multicenter, post-approval study. Circ Cardiovasc Interv. 2017;10(8):e004212. doi:10.1161/ CIRCINTERVENTIONS.116.004212
5. Duong P, Ferguson LP, Lord S, et al. Atrial arrhythmia after transcatheter closure of secundum atrial septal defects in patients 40 years of age. Europace. 2017;19(8):1322-1326. doi:10.1093/ europace/euw186
6. Krumsdorf U, Ostermayer S, Billinger K, et al. Incidence and clinical course of thrombus formation on atrial septal defect and patient foramen ovale closure devices in 1,000 consecutive patients.J Am Coll Cardiol. 2004;43(2):302-309. doi:10.1016/j. jacc.2003.10.030
7. Takaya Y, Kijima Y, Akagi T, et al. Fate of mitral regurgitation after transcatheter closure of atrial septal defect in adults. Am J Cardiol. 2015;116(3): 458-462. doi:10.1016/j.amjcard.2015.04.042
8. McElhinney DB, Quartermain MD, Kenny D, Alboliras E, Amin Z. Relative risk factors for cardiac erosion following transcatheter closure of atrial septal defects: a case-control study. Circulation. 2016;133(18):1738-1746. doi:10.1161/ CIRCULATIONAHA.115.019987
9. Divekar A, Gaamangwe T, Shaikh N, Raabe M, Ducas J. Cardiac perforation after device closure of atrial septal defects with the Amplatzer septal occluder.J Am Coll Cardiol. 2005;45(8):1213-1218. doi:10.1016/j.jacc.2004.12.072
10. Shi D, Kang Y, Zhang G, et al. Biodegradable atrial septal defect occluders: a current review. Acta Biomater. 2019;96:68-80. doi:10.1016/j.actbio. 2019.05.073
11. Li BN, Xie YM, Xie ZF, et al. Study of biodegradable occluder of atrial septal defect in a porcine model. Catheter Cardiovasc Interv. 2019;93 (1):E38-E45.
12. Li YF, Chen ZW, Xie ZF, Wang SS, Xie YM, Zhang ZW. Recent development of biodegradable occlusion devices for intra-atrial shunts. Rev Cardiovasc Med. 2024;25(5):159. doi:10.31083/j. rcm2505159
13. Huang Y, Wong YS, Ng HCA, Boey FYC, Venkatraman S. Translation in cardiovascular stents and occluders: from biostable to fully degradable. Bioeng Transl Med. 2017;2(2):156-169. doi:10.1002/ btm2.10066
14. Sharma U, Concagh D, Core L, et al. The development of bioresorbable composite polymeric implants with high mechanical strength. Nat Mater. 2018;17(1):96-103. doi:10.1038/nmat5016
15. Pino PG, Pergolini A, Zampi G. Embolization of a Biostar device in the pulmonary artery. In Portuguese. Rev Port Cardiol. 2012;31(10):685-686. doi:10.1016/j.repc.2012.04.011
16. Cikirikcioglu M, Cherian S, Lerch R, et al. Late tamponade secondary to aortic root perforation by
Biostar septal closure device. Ann Thorac Surg. 2011;91(2):604-606. doi:10.1016/j.athoracsur.2010. 07.089
17. Kong P, Liu X, Li Z, et al. Biodegradable cardiac occluder with surface modification by gelatin-peptide conjugate to promote endogenous tissue regeneration. Adv Sci (Weinh). 2024;11(2): e2305967. doi:10.1002/advs.202305967
18. Wang S, Li Z, Wang Y, et al. Transcatheter closure of perimembranous ventricular septal
defect using a novel fully bioabsorbable occluder: multicenter randomized controlled trial. Sci Bull (Beijing). 2023;68(10):1051-1059. doi:10.1016/j.scib. 2023.04.027
19. Li Z, Kong P, Liu X, et al. A fully biodegradable polydioxanone occluder for ventricle septal defect closure. Bioact Mater. 2022;24:252-262. doi:10. 1016/j.bioactmat.2022.12.018
20. Baykan A, Bilici M, Narin N, et al. Percutaneous closure of atrial septal defects with the memopart atrial septal occluder: the early-term results of a multicenter study. Pediatr Cardiol. 2022;43(1):39- 44. doi:10.1007/s00246-021-02688-w
21. Mullen MJ, Hildick-Smith D, De Giovanni JV, et al. Biostar Evaluation STudy (BEST): a prospective, multicenter, phase I clinical trial to evaluate the feasibility, efficacy, and safety of the BioSTAR bioabsorbable septal repair implant for the closure of atrial-level shunts. Circulation. 2006;114 (18):1962-1967. doi:10.1161/CIRCULATIONAHA.106. 664672
22. Komar M, Przewlocki T, Olszowska M, et al. Conduction abnormality and arrhythmia after transcatheter closure of atrial septal defect. Circ J. 2014;78(10):2415-2421.
23. Boutin C, Musewe NN, Smallhorn JF, Dyck JD, Kobayashi T, Benson LN. Echocardiographic follow-up of atrial septal defect after catheter closure by double-umbrella device. Circulation. 1993;88(2):621-627. doi:10.1161/01.CIR.88.2.621
24. Chen L, Hu S, Luo Z, et al. First-in-human experience with a novel fully bioabsorbable occluder for ventricular septal defect.JACC Cardiovasc Interv. 2020;13(9):1139-1141. doi:10. 1016/j.jcin.2019.09.057
25. Kenny D, Eicken A, Dahnert I, et al. A randomized, controlled, multi-center trial of the efficacy and safety of the Occlutech Figulla Flex-II occluder compared to the Amplatzer septal occluder for transcatheter closure of secundum atrial septal defects. Catheter Cardiovasc Interv. 2019;93(2):316-321. doi:10.1002/ccd.27899
26. Jones TK, Latson LA, Zahn E, et al; Multicenter Pivotal Study of the HELEX Septal Occluder Investigators. Results of the US multicenter pivotal study of the HELEX septal occluder for percutaneous closure of secundum atrial septal defects.J Am Coll Cardiol. 2007;49(22):2215-2221. doi:10.1016/j.jacc.2006.11.053
27. Zahr F, Smith RL, Gillam LD, et al; CLASP IID Pivotal Trial Investigators. One-year outcomes from
the CLASP IID randomized trial for degenerative mitral regurgitation.JACC Cardiovasc Interv. 2023;
16(23):2803-2816. doi:10.1016/j.jcin.2023.10.002
28. Qureshi AM, Sommer RJ, Morgan G, et al; GORE ASSURED Clinical Trial Investigators. Long-term results of the atrial septal defect occluder ASSURED trial for combined pivotal/continued access cohorts.JACC Cardio Interv. 2024;17(19):2274-2283. doi:10.1016/j.jcin. 2024.07.013
29. Du ZD, Hijazi ZM, Kleinman CS, Silverman NH, Larntz K; Amplatzer Investigators. Comparison between transcatheter and surgical closure of secundum atrial septal defect in children and adults: results of a multicenter nonrandomized trial. J Am Coll Cardiol. 2002;39(11):1836-1844. doi:10. 1016/S0735-1097(02)01862-4
30. Li Y, Xie Y, Li B, et al. Initial clinical experience with the biodegradable Absnow device for percutaneous closure of atrial septal defect: a 3-year follow-up.J Interv Cardiol. 2021;2021: 6369493. doi:10.1155/2021/6369493
31. Hiraishi M, Tanaka H, Motoji Y, et al. Impact of right ventricular geometry on mitral regurgitation after transcatheter closure of atrial septal defect. Int Heart J. 2015;56(5):516-521. doi:10.1536/ihj.15- 073
32. Veldtman GR, Razack V, Siu S, et al. Right ventricular form and function after percutaneous atrial septal defect device closure.J Am Coll Cardiol. 2001;37(8):2108-2113. doi:10.1016/S0735-1097(01) 01305-5

扫码下载文献PDF原文
-End-
新型生物可降解封堵器经导管封堵卵圆孔未闭:一项前瞻性、多中心、随机对照临床试验

扫码观看可降解学苑精彩内容
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系

发表留言
暂无留言
输入您的留言参与专家互动