心血管疾病或将迎来新的治疗策略!葛均波院士团队综述缺氧诱导因子和心血管诊疗关联
氧气在不同的组织和器官中被精细调控而维持机体的稳态。在不同的生理或病理条件下,不同组织的基本氧张力不同,细胞对于氧反应也不尽相同。在缺氧条件下,缺氧诱导因子(hypoxia inducible factors, HIFs)是氧平衡时空调节的关键分子。病程中,HIFs也呈现一定的时空特异性,是潜在的临床靶标,就心血管疾病而言,或将迎来一种新的治疗策略。
2020年2月,葛均波院士/李华研究员课题组正式发表综述文章于《Nature Reviews Cardiology》,初步论述了HIF-1α在心血管疾病中参与表观遗传修饰的关键作用。如赖氨酸乙酰化酶(KATs)和赖氨酸去乙酰化酶(KDACs)可调控HIF-1α/VEGF分子通路诱导血管新生,缺氧可诱导KDACs (如HDAC4和HDAC6)通过去乙酰化稳定HIF-1α,缺氧条件下的KATs诱导组蛋白乙酰化可增加HIF-1α依赖性的Edn1表达而导致肺动脉高压的病程进展等。

2021年4月,课题组又以eLetters的形式在《Science》上发表“Lung and HIF-1/2 switch”,提及了HIF-1/2α之间的转换对于肺脏的响应模式与心脏有所不同,因为肺脏处在一个不断感知外界氧气波动的环境中。与肺脏相比较,其他器官中的HIF-1α更容易被缺氧触发;而在肺脏中,当氧浓度降为6%时将优先激活HIF-2α,此时HIF-1α尚未表现出明显的丰度增强。
2022年10月,课题组再在Cell Press旗下的《Trends in Molecular Medicine》正式发表题为“Molecular basis and clinical implications of HIFs in cardiovascular diseases”的封面综述。该文章深度解析了以HIFs为核心的时空调控网络,详尽归纳了心血管疾病中HIF-1α/2α/3α时空特异性的临床意义,并提及基于HIFs动态平衡和转换的心血管治疗新策略。

在病理过程的不同阶段,HIF-α异构体之间存在角色“转换”,并发挥着不同的作用(图4)。随着缺氧程度的增加,HIF-1α呈现一个先激活后被抑制的趋势;在急性缺氧早期,HIF-1α陡然上升、变化剧烈,在缺氧后24小时内起着主导作用。而HIF-2α则因其与缺氧反应基因的启动子高亲和力,导致对缺氧反应更持久;即使在病理性缺氧2-3天后,HIF-2α仍保持活性。在血管重建方面,HIF-1α在缺氧早期的血管新生过程中起主要作用,而在血管重塑和稳定的后期阶段则主要由HIF-2α驱动。此外,HIF-1α在所有有核细胞中都有表达,组织特异性表达的HIF-2α可以在心脏实质细胞和非实质细胞中表达,HIF-3α的转录物在心脏中也有高表达。
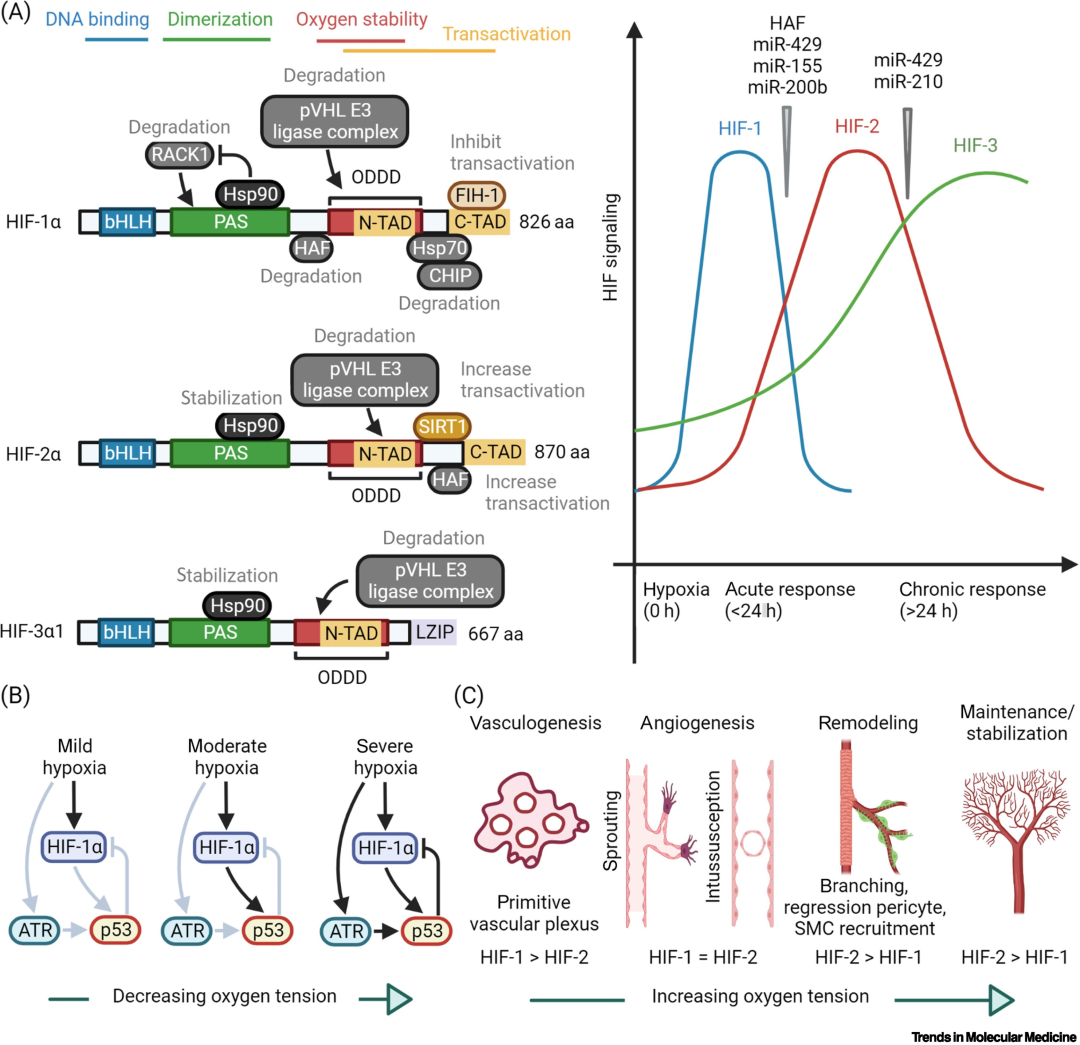
HIF-α的时空特异性
通过AP-1松动控制心肌再生的致密染色体区域,HIF-1α与YAP/TAZ协同促进心肌修复(图5)。YAP/TAZ有助于AP-1的转录,两者共同调控细胞生长和器官大小。在缺氧条件下,JNK/SPAK激活AP-1,后者与HIF-1α又共作用于靶基因促进其转录。AP-1还可以促进RRE染色质的可及性而使细胞再生。在Hippo信号通路中,缺氧抑制LATS1/LATS2,增强YAP/TAZ转位至细胞核内并与TEAD结合以激活细胞增殖。此外,HIF-1α和YAP/TAZ协同还可以促进心肌细胞的糖酵解来增加心肌损伤修复需要的能量。
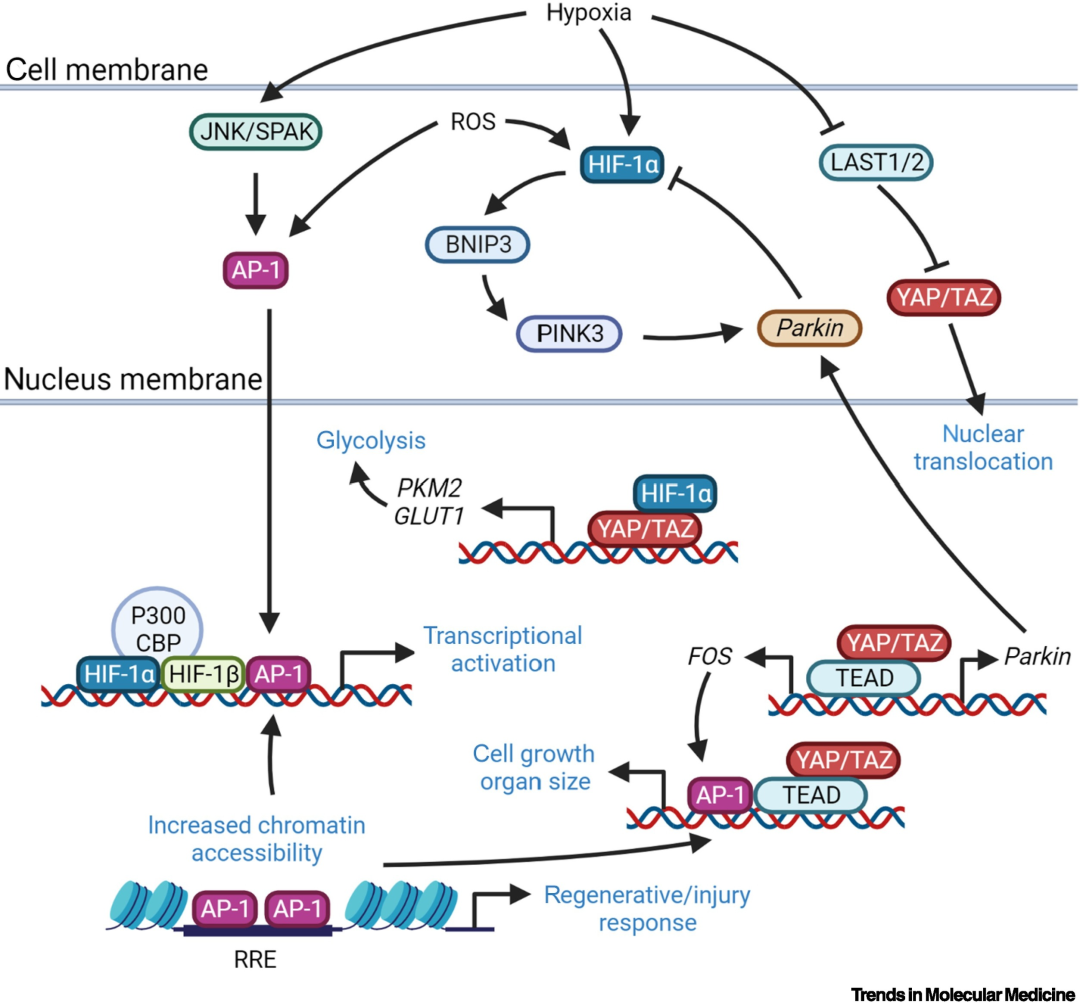
HIF-α在心肌再生中的作用
干预HIF的治疗有时间和空间特异性(图6)。远端缺血预处理(RIPC)是解释其时间特异性的典型例子:只有在RIPC后期从头合成的HIF-1α才能起到心脏保护作用。在临床手术前启动RIPC也可更多的激活HIF-1α以降低术后的主要不良事件:如在急诊髋部骨折手术后,RIPC就已被证明可将心肌损伤和梗死的风险降至最低。此外,RIPC结合远端缺血后处理(RIPostC)可以减少原位心脏移植患者在主动脉减压后6小时的心肌损伤从而保护心脏,HIF-1α-AMPK信号通路的参与是其分子机制之一。

急性心肌损伤中HIF-α的作用
在生理环境下,激活HIFs可以改善心脏功能、减少ROS堆积、减缓身体衰老。正常区间内HIF的激活还可以促进EPO和VEGF的表达从而保持更健康的机体代谢和心血管表征(改善葡萄糖耐量,降低总胆固醇和血压水平,减少有毒代谢物,降低炎症负荷等),同时防止微血管的稀化、增强老年人保护性的血管再生。然而,在病理条件下,如慢性肾病导致机体微环境变化引起体内HIFs对缺氧反应的改变。精准区分HIFs异构体的时空特异性和深入研究它们在细胞、组织以及疾病不同时期的作用、分子互作具有非常现实的临床意义。由此而设计出的药物和其他干预措施将会成为心血管疾病中富有前景的一种新治疗手段。

复旦大学附属中山医院心内科博士研究生胡亦清、副主任医师陆浩是本文的共同第一作者,李华研究员、葛均波院士为本文共同通讯作者。

原文链接:
https://www.cell.com/trends/molecular-medicine/fulltext/S1471-4914(22)00235-0
参考文献:
1. Li P, Ge J, Li H. Lysine acetyltransferases and lysine deacetylases as targets for cardiovascular disease. Nat Rev Cardiol. 2020 Feb;17(2):96-115. doi: 10.1038/s41569-019-0235-9.
2. Yiqing Hu, Hua Li, Junbo Ge. RE: Lung and HIF-1/2 switch. Science (2021). https://www.science.org/do/10.1126/comment.759211/full/, the last access date: Sep 18, 2022
3. Hu Y, Lu H, Li H, Ge J. Molecular basis and clinical implications of HIFs in cardiovascular diseases. Trends Mol Med. 2022 Oct 5: S1471-4914(22)00235-0. doi: 10.1016/j.molmed.2022.09.004.

发表留言
暂无留言
输入您的留言参与专家互动