“无用”之耳——左心耳再认识
左心耳通常被认为是无用之组织,然而Mayo Clinic的Mohamad Alkhouli教授等通过对文献复习,让我们审视这一无用之耳。

Mohamad Alkhouli教授
左心耳 (left atrial appendage,LAA) 被广泛认为是心房颤动 (atrial fibrillation,AF) 患者血栓栓塞(thromboembolism)的主要来源。该假设产生消除体循环中左心耳的理念以降低房颤患者卒中风险。在过去的 20 年中,多项研究记录了经导管和外科左心耳闭合 (left atrial appendage closure,LAAC) 在降低血栓栓塞风险方面的疗效, 并确立将左心耳闭合作为选定房颤患者的有效卒中预防策略。快速进展的左心耳闭合领域增加人们理解左心耳在神经激素调节(neurohormonal regulation)、致心律失常(arrhythmogenesis)和左房功能中可能发挥作用的兴趣。然而在学术文献和临床实践中,左心耳仍主要在其血栓形成作用背景下进行讨论。本文对已提出的左心耳血栓形成以外的功能进行综述,并讨论其对治疗的潜在意义。
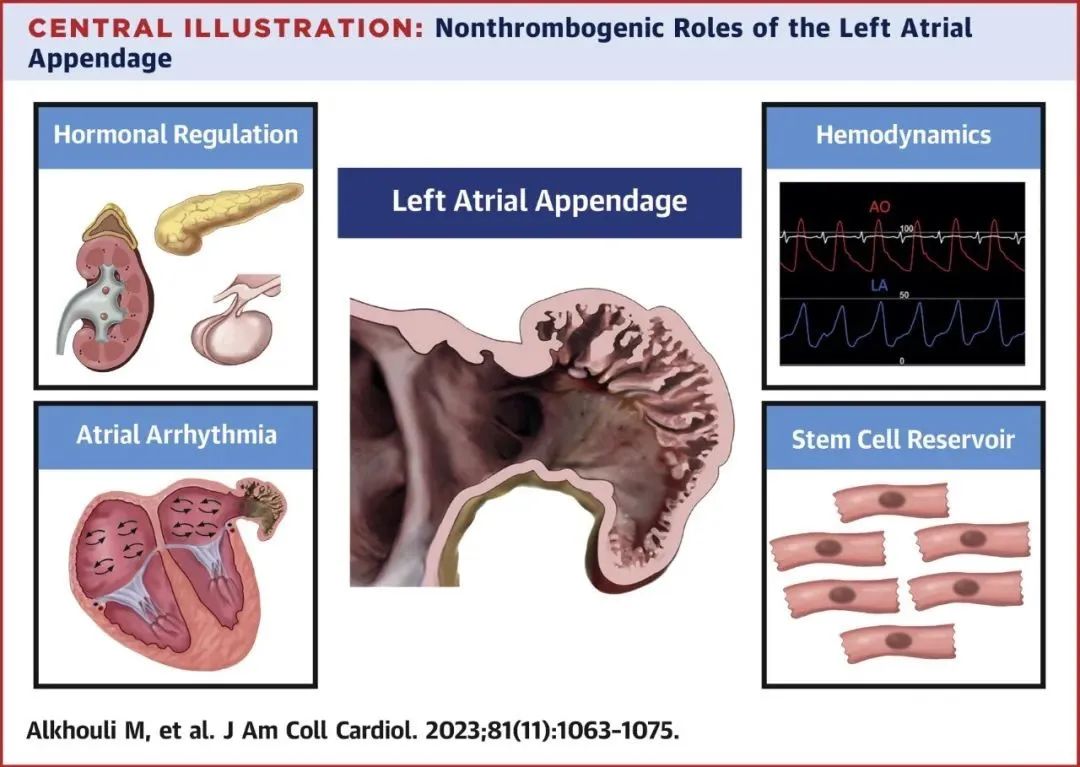
核心插图 左心耳的非血栓形成作用
此图图示左心耳的4个重要非血栓形成功能
在研究有关左心耳各种功能数据前,需对其胚胎发育、组织学和解剖学进行简要概述。
胚胎发生
原始左房(primordial left atrium)发生于胚胎发育第4周心管(heart tube)的成袢(looping)。随后发生的细胞突起阶段(cellular protrusion phase)可致梳状肌(pectinate muscles)形成,使原始左房具有粗糙心内膜的特征。在胚胎第6周,大多数原始左房发育成构成左心耳的粗糙小梁组织(trabeculated tissue)。固有左房(LA proper)主要是由肺静脉芽基(pulmonary vein buds)通过套叠与原始左房融合而成。视频1展示了左心耳的胚胎发生过程。
组织学
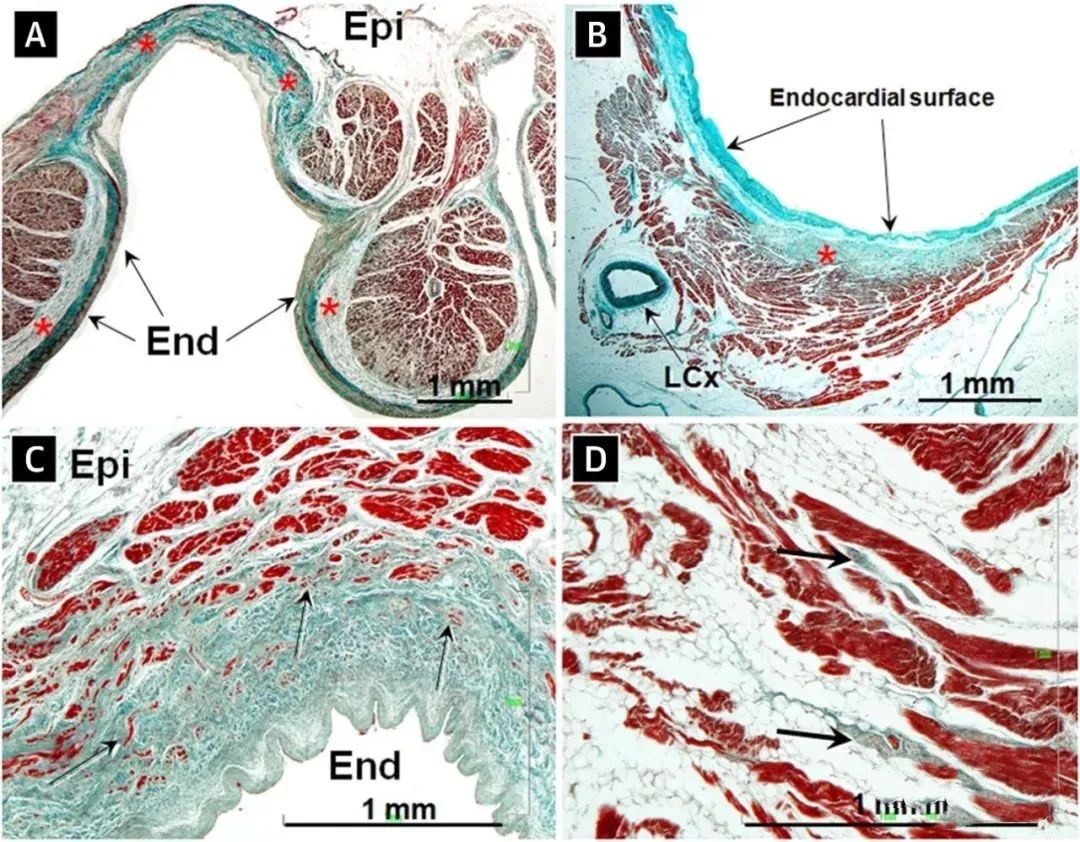
图1. 心房颤动患者左心耳的组织学切片
(A和B)左心耳(LAA)显示心内膜(End)增厚(箭头),存在纤维和弹性组织(心内膜弹力纤维增生)(星号)。(C) 心内膜-心肌交界处显示心肌细胞变性,有脂肪细胞浸润和纤维化(箭头)。(D)显示心内膜胶原和弹性纤维的增加延伸到心外膜(Epi)并影响到自主神经(箭头)。
左心耳由三层构成:心内膜、心肌和心外膜。心内膜层指由心内膜下结缔组织支持的单层内皮细胞。心肌层由螺旋状排列的肌束构成。由于肌束厚度不同,且肌束间的心耳壁非常之薄(<1毫米),使左心耳的内膜面呈现出高度不规则形态(图1)。连接左右房壁的外膜肌带——Bachmann束(Bachmann bundle)在左心耳颈部分叉,促进双房的协同一致。左心耳中具有自触发活性的DeBakker细胞,常连同左心耳中的瘢痕组织,或在致心律失常中发挥重要作用(图2)。慢性心房颤动患者左心耳形态学和组织学改变包括心肌细胞增厚、紊乱和功能不全及细胞核增大、细胞间纤维化和左心耳扩张。左心耳尚富含内源性心脏祖细胞(cardiac progenitor cells,CPCs),占其细胞总数>20%。此外左心耳是心房利钠肽(atrial natriuretic peptide,ANP)分泌的主要来源,据报道左心耳中的ANP浓度较左房游离壁高 40 倍。
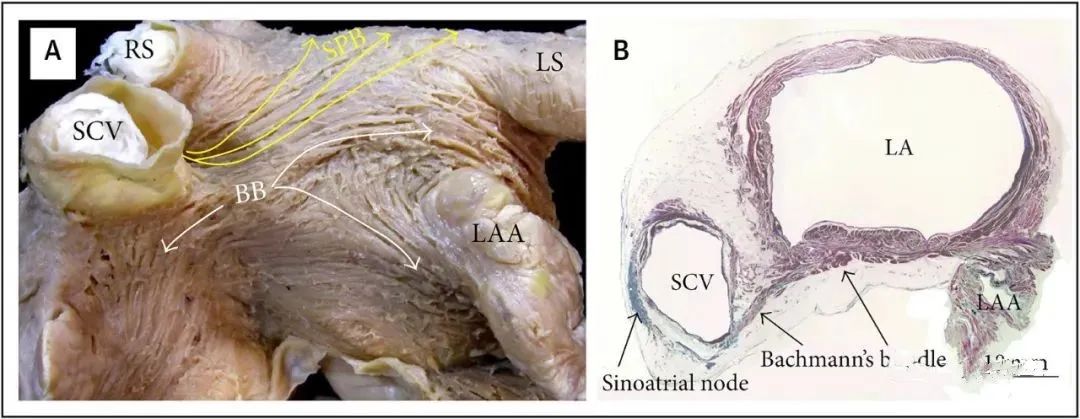
图2. Bachmann束的解剖
(A) Bachmann束(BB)(白色箭头)和隔肺束(SPB)(黄色箭头)的解剖图。(B)断层组织学切片(Masson三色染色)显示Bachmann束及其向右延伸至窦房结。
解剖学
左心耳形态高度变异。尽管左心耳的某些形状与形成血栓的倾向较高相关(如,non–chicken wing),但对这种不同形态演变及其是否与心脏病理适应过程相关知之甚少。在大多数人中,左膈神经血管束在左心耳上方的纤维心包层中穿过(图3)。左心耳由大量交感神经和副交感神经纤维支配,可能是肾素血管紧张素激活系统(renin angiotensin activation system,RAAS)的重要组成部分。左心耳位于房室沟上方,并覆盖左回旋支动脉。在一些患者中,窦房结支起源于近端左回旋支动脉,在其向横窦心包窦行进途中,在左心耳颈部形成S形。5-10%的人存在副左心耳,且其与更高的房颤和缺血事件发生率相关。但副左心耳的非血栓形成作用尚未得到研究。
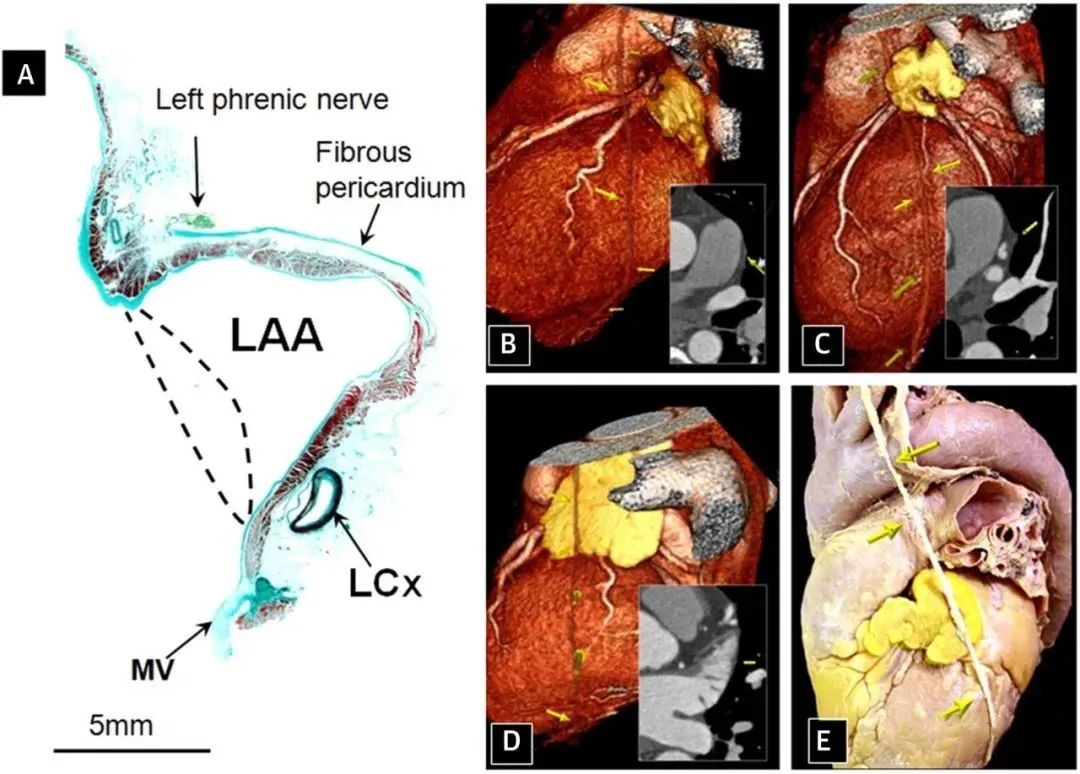
图3. 回旋支动脉、膈神经与左心房的关系
(A) 采用Masson三色染色的左心耳(LAA)的矢状切面,显示回旋支动脉在左心耳颈部下方的排列。(B至D)3例左膈神经血管束(黄色箭头)与左心耳有关的解剖走行变化。(E) 尸检标本。在此情况下,左膈神经(箭头)或神经血管束通常被视为左心耳体部前房或其上方的单一主干。
基于左心耳壁内高浓度心房利钠肽(ANP)的存在,长期以来一直有“关于左心耳在神经内分泌调节中的潜在作用”的假说。心房利钠肽(ANP)是一种强效利尿、利钠激素,对电解质-体液平衡起重要作用,影响RAAS,并改变脂质和葡萄糖代谢。ANP和RAAS之间的相互作用可引起β细胞上调,导致胰岛素水平增加和血糖水平降低。多种因素可促进ANP的分泌,包括左房高压、缺血、梗死、容量状态、房颤、心房扩大及左心耳扩张,其中后者是最重要的因素。
外科手术切除左心耳可能影响对液体摄入的渴求和心房利钠肽水平。在1981年,Zimmerman等表明切除左心耳消除了绵羊在失血状态下的渴觉及紧随其后的饮水行为。Garcia等发现在容量扩充后,切除左心耳的大鼠血浆心房利钠肽水平显著降低,而保留左心耳的大鼠则未见显著下降。随着左心耳闭合干预的出现,人类左心耳的内分泌作用也开始被研究。多项研究记录了左心耳闭合(LAAC)对ANP和BNP水平的早期影响,尽管大多数研究显示这些激素在手术后几个月内恢复至基线水平,这可能表明了机体其他部位的代偿调节。
对于左心耳闭合(LAAC)对神经内分泌影响研究最详细系统者系LAA HOMEOSTASIS(Left Atrial Appendage Closure and Systemic Homeostasis)研究。在这项研究中,使用心内膜或心外膜装置进行左心耳闭合的77名患者,同时前瞻性地进行了肾上腺素能系统功能(肾上腺素、去甲肾上腺素)、RAAS激活(醛固酮、肾素)、利尿作用(ANP、BNP)和代谢(脂联素、胰岛素、脂肪酸、β-羟基丁酸和游离甘油酯)的血清标志物检查。该研究记录了一些新的见解:1)ANP和BNP在心内膜和心外膜左心耳闭合后立即增加和降低,但在任一手术3个月后均恢复正常;2)心外膜(而非心内膜)左心耳闭合与RAAS系统的下调有关,并伴随着收缩压和舒张压的下降;3)心外膜左心耳闭合导致代谢激素的增加,而心内膜左心耳闭合则无此效应(图4)。
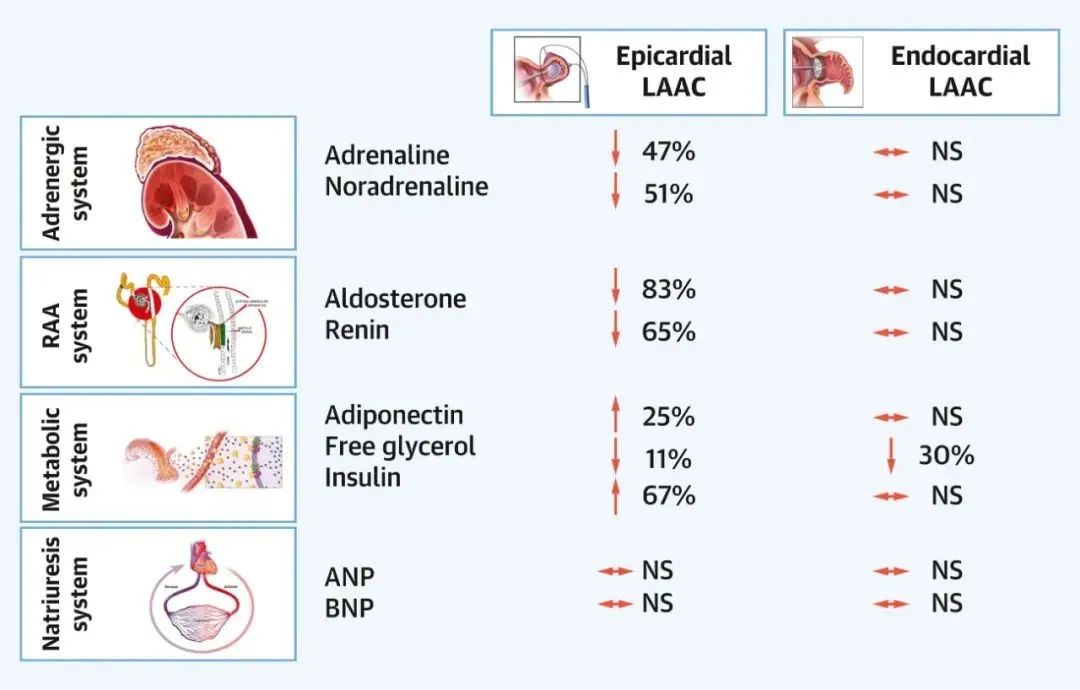
图4. 心外膜与心内膜左心耳闭合诱导的激素变化摘要
该图说明了肾上腺素能、肾素-血管紧张素-醛固酮(RAA)、代谢和利尿系统在心内膜和心外膜左心耳闭合时的变化。
一个重要的发现是ANP和肾素/醛固酮水平的不一致变化,表明左心耳的神经调节作用与ANP或BNP的分泌无关。这是有道理的,因为上述两种肽的其他心脏来源(如右心耳)可代偿左心耳提供ANP的损失。
左心耳的神经调节功能可能通过两种不同的机制介导:激素短期机制(hormonal short-term mechanism,ANP和BNP分泌的改变)和神经长期机制(neural long-term mechanism,心外膜左心耳闭合术中左心耳传入神经或左心耳周神经节丛损伤导致的自主神经系统改变)。但该假说尚需进一步研究。LAA HOMEOSTASIS II研究发现,用Lariat装置对左心耳进行心外膜结扎后的12个月和24个月,肾上腺素、去甲肾上腺素、醛固酮、肾素和血管加压素水平持续降低。最近关于减重手术对心房重塑影响的观察结果提供了另一种研究左心耳神经内分泌功能确切机制的途径。
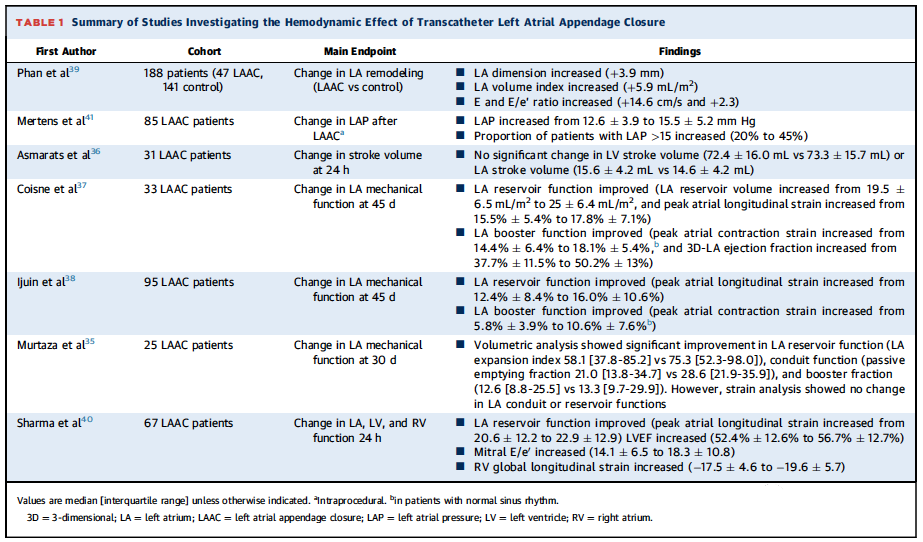
尽管左心耳的形状和大小变化很大,但其特点为呈波纹管样(bellows-like)扁平形、方向相对的平行心房肌壁,使其能够放大左心耳腔内压对心耳壁的应力。此外,左心耳独特地配置许多心肌伸展感受器(myocardial stretch receptors),结合其增强壁应力的形态(wall-stress amplifying morphology),使其成为对左房压力变化极其敏感的传感器。上世纪90年代的动物生理学研究表明,左心耳比正常的左心房具有2到3倍的顺应性,通过在急性左房压力升高时充当减压腔(decompression chamber),增强左房的储备功能(reservoir function)。手术切除左心耳会损害容量或压力负荷的血液动力学反应,并增加左房舒张压-容积关系的动态刚度常数(dynamic stiffness constant)。但与动物数据相反,一系列观察性研究的人体数据表明,左房的功能实际上可能会在左心耳封堵术后改善。对接受心外膜或心内膜左心耳闭合的患者进行的LAFIT(Impact of left atrial appendage occlusion on left atrial function)系列研究表明,术后左房容积指数、收缩力和储备功能均得到改善,提示纤颤的左心耳对血液动力学的负面影响。随着全球左心耳闭合术数量的快速增加,出现了两个重要问题:1)消除左心耳腔是否影响心脏机械性能?2)左心耳闭合术是否与不良临床事件(例如加重心力衰竭)相关,因为心脏血液动力学发生改变?
研究左心耳闭合术对血流动力学的影响被该手术潜在的神经内分泌效应所混淆。但由于经皮封堵器产生的神经内分泌效应很小(甚或没有),使用塞式(plug type)装置进行心内膜左心耳闭合术效果应该主要由于消除左心耳作为容积腔的作用。文献综述表明,心内膜封堵器进行左心耳闭合术可能具有相对矛盾的血流动力学效应:改善左房机械功能和增加充盈压(表1)。然而,由于下述原因,这些数据应谨慎解读:1)左心耳闭合术的血流动力学变化机制尚不明确;2)基线心房和心室肌病、左心耳闭合术的完整性及由医源性间隔缺损导致的房间分流(通常与急性左向右分流相关)对心脏血流动力学的影响尚不清楚;3)大多数研究在急性/亚急性情况下测量了左心耳闭合术对心脏力学和血流动力学的影响。这些变化是否长期存在还有待阐明。
最近的一些研究表明左心耳闭合术与新发或恶化的心力衰竭(heart failure,HF)有关。Kim等研究显示,与匹配队列相比,左心耳闭合术患者出现心力衰竭再入院的发生率更高(HR:3.76;95% CI:1.19-11.88;P = 0.024)。作者还发现,心衰病史、更高的E/e’值和基线时更低的左房应变是左心耳闭合术后心衰再住院的独立预测因子。在National-Readmission-Database中,15%的术后30天内患者被诊断为“新发”心衰。在冠状动脉旁路手术时进行的外科左心耳闭合术被证明是30天再入院的独立预测因子(OR:1.64;95% CI:1.60-1.68;P < 0.0001),可能是由于更多的心衰事件。在LAAOS-II(The Left Atrial Appendage Occlusion Study)中,外科左心耳闭合术在平均随访时间为3.8年期间与更多的心衰住院治疗有关(7.7% vs 6.8%;HR:1.13;95% CI:0.92-1.40)。这些研究结果是假设性的,突显了需要更多研究探讨左心耳闭合术对临床心衰的影响。
需进一步研究的一个重要问题是左心耳在各种心衰表型中的作用。房颤和射血分数保留的心力衰竭之间存在高度相互依赖关系,这两种情况似乎都起源于共同的房室心肌病变。事实上,房颤的发展和随后的心房收缩功能丧失对于射血分数保留的心力衰竭患者的不良影响比对于射血分数减低的心力衰竭更为严重。尽管是推测性的,但是在左心耳闭合术后失去心耳容积功能可能与射血分数保留的心力衰竭患者产生不成比例的不良血液动力学效应有关。
传统房颤导管消融术以肺静脉作为主要手术目标。但由于其复发率高,学者们探索了各种非肺静脉消融靶点(左房后壁、Marshall韧带、冠状静脉窦)以提高消融手术的耐久性。在2010年,Di Biase等报道在接受房颤再次导管消融手术的患者中,27%的患者在左心耳发现一致性的房性期前收缩,或源自左心耳的心房颤动或心房扑动。在这些患者中,完全消融左心耳(在左心耳出口处使用循环消融导管,circulation ablation catheter)与局部或未行左心耳消融相比,1年的房颤复发率更低(15% vs 68% vs 74%,P < 0.001)。富神经支配的Marshall韧带与左心耳的密切联系及Bachmann束和左心耳基底间的连接支持了胚胎解剖学方面的解释。这一假说得到了其他研究的支持。在一项关于35例房颤患者左心耳切除标本的病理解剖学研究中,发现心耳部分间质胶原纤维束的厚度与电活动时间相关,提示左心耳存在心房折返的致心律失常基质。在另一项临床前研究中,在快速心房起搏的犬模型中观察到左心耳优先释放神经生长因子,这表明左心耳为心房颤动的易感基质。
由于认识到左心耳可能是触发房颤的潜在因素,BELIEF(Left Atrial Appendage Isolation in Patients With Longstanding Persistent AF Undergoing Catheter Ablation)试验对经验性左心耳电隔离(left atrial appendage electrical isolation,LAAEI)进行了研究。该试验将173名长期持续性房颤患者随机分为标准广泛消融联合LAAEI组和单纯标准广泛消融组。在1年随访中,未进行LAAEI的患者房颤复发率是进行LAAEI的患者的两倍(56% vs 28%; adjusted HR : 2.22; 95% CI:1.29-3.81; P = 0.004)。LAALA-AF(Left Atrial Appendage Ligation and Ablation for Persistent Atrial Fibrillation)注册研究表明,选择性的心外膜左心耳结扎与单纯射频消融相比,心律控制改善了25%。在另一项前瞻性登记研究中,LAAEI + 标准消融组与单纯标准消融组相比,抗心律失常药物停用时免于房性心律失常复发的几率更高(68.9% vs 50.2%; P < 0.001)。这些结果在包括1,037名患者的Meta分析中得到了证实,其中LAAEI与更低的复发房性心动过速或心房颤动的几率有关(OR: 0.38; 95% CI: 0.16-0.90; P = 0.02)。一项包括2,336名患者的最新荟萃分析得出类似的结果(图5)。然而,关于LAAEI的几个问题仍需要进一步讨论。
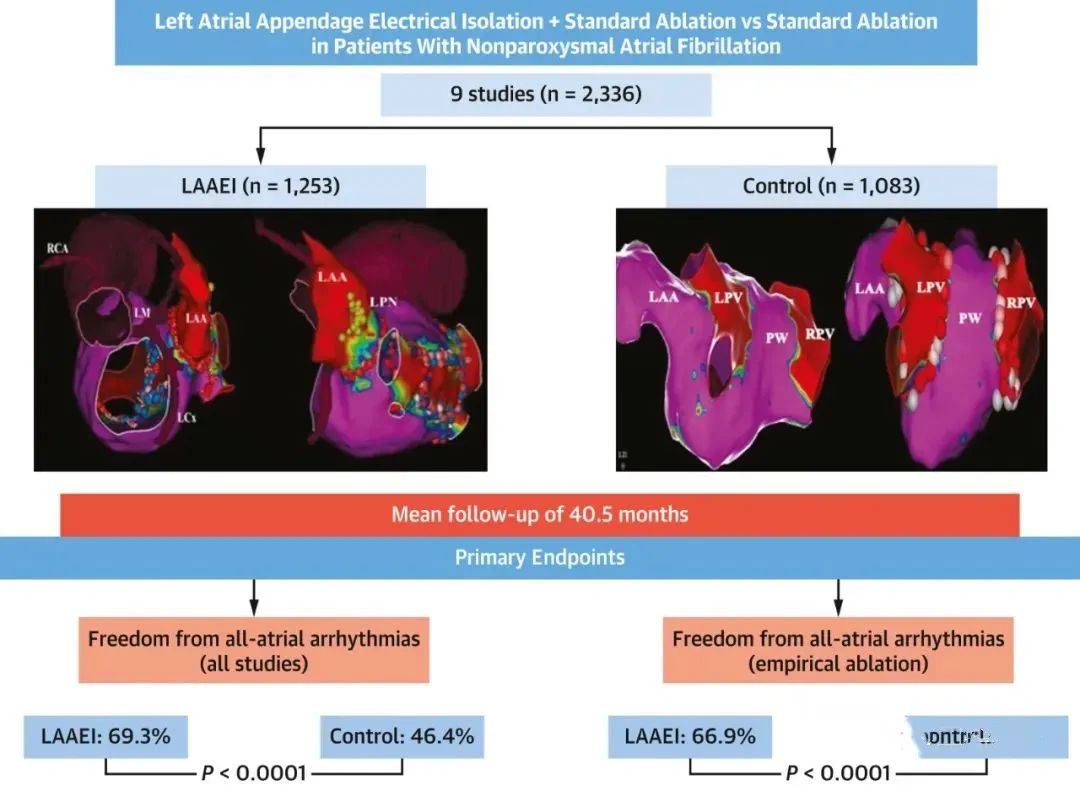
图5. 左心耳电隔离对免于房性心律失常的影响
在心房颤动消融期间对左心耳进行电隔离的增量价值。在肺静脉消融术的基础上进行标准的心耳隔离的患者,在随访期间实现了更高的免于心房颤动发生率。
首先,在文献中经皮或外科途径左心耳心外膜消除被认为是与经导管冷冻或射频消融左心耳相当的左心耳电隔离方法。但研究已经记录了这些手术的相关细微差别,显现出它们并非均等。如认为外科左心耳消除通过沿结扎线或夹闭线造成的致密纤维化诱导左心耳坏死来诱发完全的左心耳电隔离。但使用这些技术不完全隔离左心耳的情况并不少见。此外,外科左心耳消除可能无法解决邻近的触发组织(如Marshall韧带),这些触发组织可能在基于LAAEI的消融同时进行处理。另一个例子是使用Lariat进行经皮心外膜左心耳结扎术。观察性研究一直显示Lariat在实现左心耳电隔离方面的疗效。然而在aMAZE(LAA Ligation Adjunctive to PVI for Persistent or Longstanding Persistent Atrial Fibrillation)随机试验中,上述有希望的结果并未转化为左心耳电隔离的预期优势。在aMAZE中,与肺静脉消融相比,使用Lariat装置进行左心耳闭合并未改善复发性房性心律失常的比率(64.3% vs 59.9%),尽管在左房扩大(LA > 130 mL)的患者中观察到潜在的益处。最后,优化左心耳电隔离结果的消融技术仍然未知。在BELIEF中,13%的患者在初次手术中未达到完全的左心耳电隔离,37%的患者在再次手术时发现左心耳的电重联(electrical reconnection)。
其次,关于通过导管消融或经皮心外膜左心耳闭合术的操作风险,已经引发担忧。在通过射频消融进行左心耳电隔离的最初描述中,需要进行心包穿刺术的心包填塞发生率为1.8%。同样,在最早使用Lariat进行的经验中,11%的患者出现了主要围术期并发症。但这些并发症似乎与学习曲线有关,因为随后的研究显示手术不良事件显著下降。
第三,基于消融的左心耳电隔离的一个主要问题是术后血栓栓塞风险的增加。虽然Di Biase等显示左心耳电隔离术后卒风的风险可以通过不间断口服抗凝药或同时进行左心耳闭合术有效地缓解,但操作者的担忧仍然存在,可能导致常规左心耳电隔离术的普及受到限制。
干细胞治疗作为改善心肌梗死后心室功能的一种潜在策略已被广泛研究。然而,有关骨髓间充质干细胞经冠状动脉或心肌内移植的文献大多令人沮丧。一个可能的解释是骨髓干细胞分化成心肌细胞的能力有限。因此,心脏祖细胞(CPCs)作为更有效的干细胞治疗基质引起了越来越多的关注。但是,心脏祖细胞非常稀缺,成年小鼠心脏中每104个心肌细胞仅有1个心脏祖细胞。因此,多项研究着手探索心脏祖细胞的丰富来源。这些研究一致表明,左心耳是多种祖细胞的关键储备库。考虑到左心耳独特的胚胎发育和胎儿基因表达,这是可以理解的。因此,左心耳中丰富的心脏祖细胞成为不断发展的干细胞治疗领域的基础:自体左心耳移植(autologous atrial appendage transplantation)。
临床前研究已显示,使用细胞外基质贴片将心耳微移植物(atrial appendage micrografts ,AAMs)固定在心肌梗死心脏表面上是可行的。这些研究还表明,心耳微移植物(AAMs)激活多种心肌发生(cardiogenic)和心脏保护(cardioprotective)途径,引起心肌细胞收缩和修复能力增强,氧化应激减少。
基于上述结果,Atrial Appendage-Derived Cells Consortium进行了一项开放标签研究,以评估心耳微移植物(AAMs)移植在冠状动脉旁路移植手术中的作用。在这项研究中,招募12名进行冠状动脉旁路移植手术的患者。其中6名(50%)接受了定向输送到心肌梗死区域的心耳微移植物(AAMs),该区域系通过心脏磁共振确定的。两组患者都接受了相同的随访方案,包括临床评估和心脏磁共振成像。所有患者的心耳微移植物(AAMs)制备和输送都非常顺利和成功。接受心耳微移植物(AAMs)治疗的患者左心室壁厚度和心肌瘢痕质量的变化趋势良好,而对照组则无(图6)。虽然仍需要进行更大规模的随机研究,但这些研究为未来左心耳在心肌细胞再生和心肌挽救(myocardial salvage)中的潜在作用提供了有前途的概念性证据。
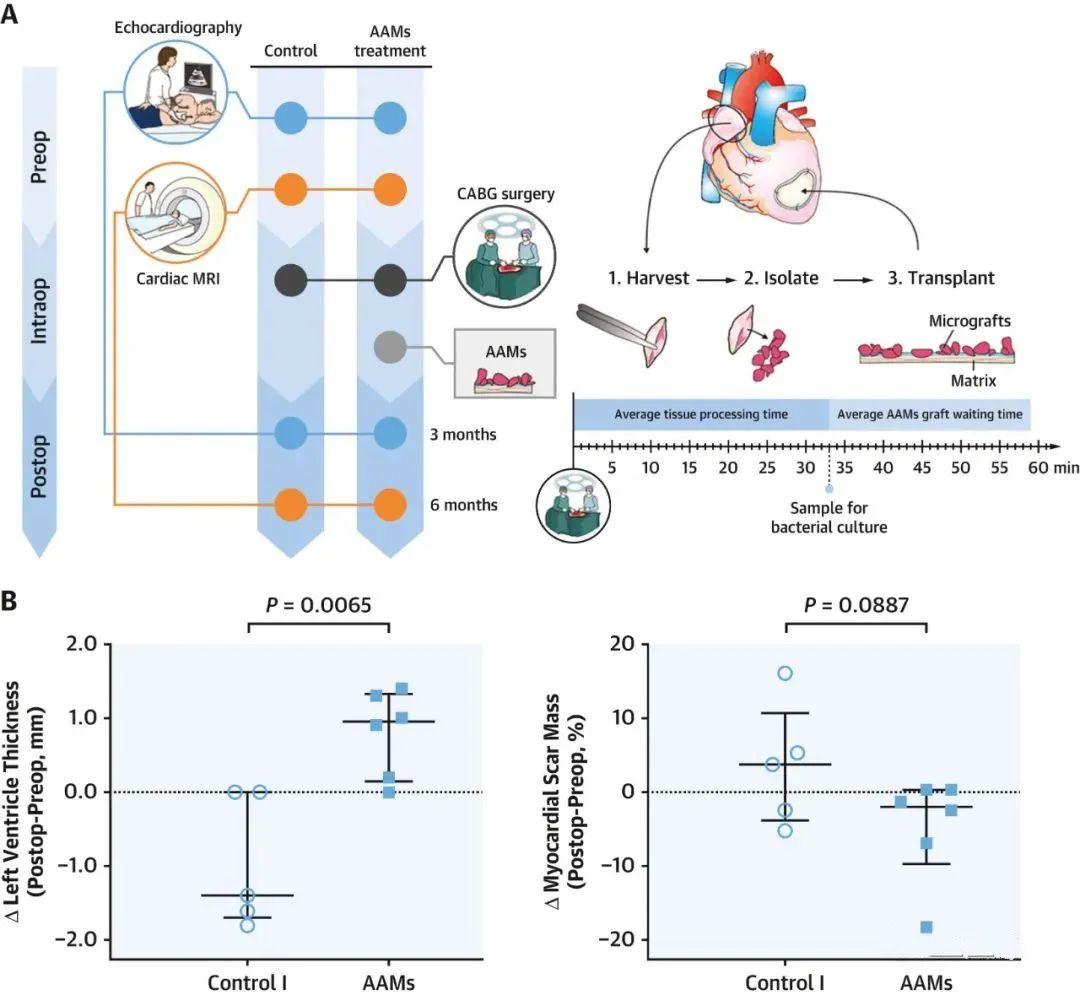
图6. CABG期间自体心脏微移植物的心外膜移植
心外膜移植自体微移植物在首次概念验证研究中证明了可行性和可能的疗效。(A)分离、自体移植心耳微移植物(AAMs)和后续成像的方案。(B) 术后与术前相比,梗死瘢痕部位的存活左心室心肌厚度和心肌疤痕质量的单参数变化。
左心耳覆盖在左冠状动脉及其近端分支之上。这种解剖学上的接近关系通常在 左心耳电隔离或 左心耳闭合过程中对冠状动脉损伤的警告报道中被强调。然而,与通过分支附着于心外膜的中段和远段冠状动脉相比,位于主动脉和心外膜表面之间“悬挂”的近段冠状动脉在左室底部高度动态运动时较少受到保护。考虑到左心耳覆盖近端左冠状动脉,已经提出了左心耳保护“缓冲”作用的假说,尽管该假说尚未得到研究。
理解LAA错综复杂的非血栓形成作用需要不同利益相关者之间的跨学科合作。该领域潜在研究方向包括以下几个方面:
1.评估左心耳在健康和疾病状态下的生理功能。目前的研究主要利用LAAC或房颤消融术的增长趋势来窥见LAA的有机功能。但直觉告诉我们,如果我们扩大研究范围,包括生理和病理条件,那么这些功能可能会更好地得到认识。
2.左心耳的比较病理解剖学研究。不同种族和性别的左心耳大小和形状的差异已经有很好的文献记载。甚至在不同的物种间有更大的差异也有报道。研究LAA的演化、其大小和构型的丰富多样性的原因,及LAA重构过程与毗邻心脏结构的关系,可以提供更有意义的见解。
3.对左心耳功能的整体研究方法。虽然我们在本综述中人为地将左心耳的拟议功能分为不同的类别,但这些作用高度相互关联。将左心耳的血液动力学、神经激素和电生理特性,甚至其在血栓栓塞中的作用整合起来的研究,将产生对左心耳更全面的理解。
4.转化医学应用。了解左心耳功能的基本原理需要与寻求实际治疗应用的努力同时进行。解剖学家、血流动力学专家、电生理专家、介入心脏病专家、外科医生和生物医学工程师之间的合作可能会产生各种新颖的基于左心耳的治疗方法。

发表留言
暂无留言
输入您的留言参与专家互动