随着心血管医疗技术的不断进步和发展,急性心肌梗死患者得到了更及时有效的治疗。然而心肌梗死后再发血管事件的风险仍然极高,而且这种风险可能在心肌梗死后持续数年。心肌梗死、下肢缺血或脑卒中等缺血性损伤后,由动脉粥样硬化为病理表现的二次动脉狭窄的发生率急剧上升。既往研究指出,调节单核细胞可以预防动脉粥样硬化及其临床并发症。实验研究表明,小鼠心肌梗死后会加速动脉粥样硬化的进展,其中交感神经刺激骨髓肾上腺素能受体动员单核细胞进入血液,从而促进了动脉粥样硬化的发生。然而,由于单核细胞在血液中的寿命短暂,而临床观察到心梗后再发动脉粥样硬化的风险会持续数年乃至数十年,这其中的机制目前尚未完全清楚。
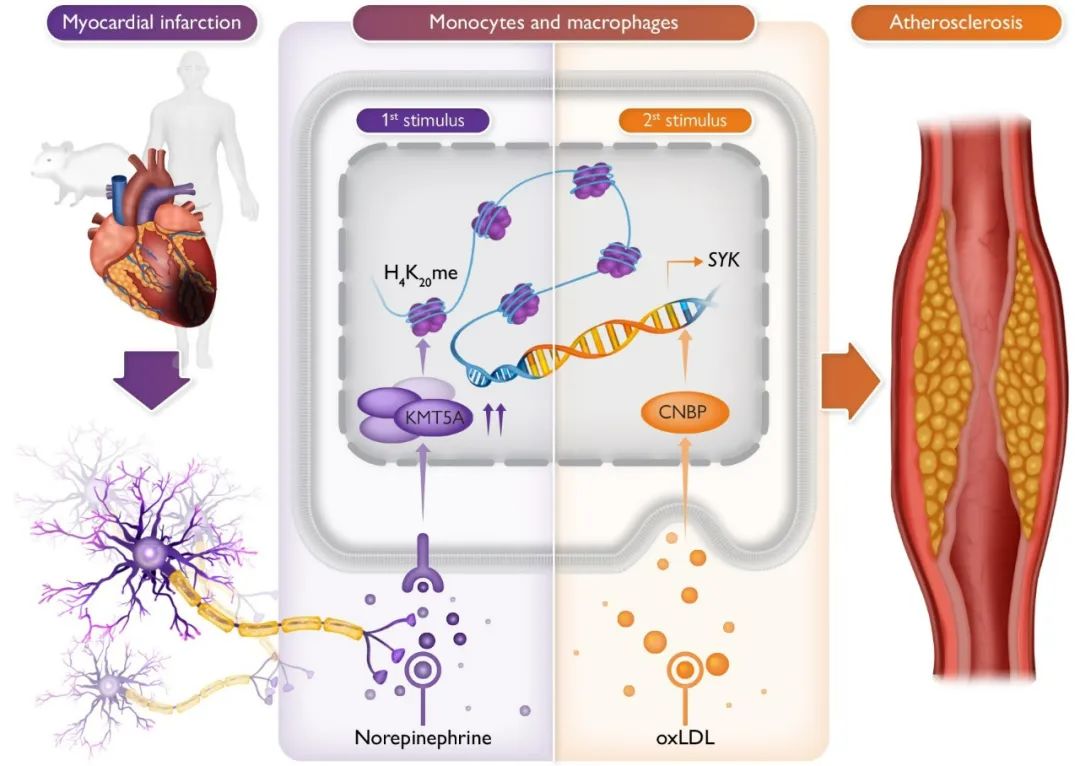
2023年12月12日,复旦大学附属中山医院葛均波院士团队在European Heart Journal期刊在线发表了题为“Myocardial infarction drives trained immunity of monocytes, accelerating atherosclerosis”的研究论文,研究结果显示在人和小鼠中,心肌梗死触发了单核细胞中的一种免疫训练状态,随后由于交感神经系统激活期间去甲肾上腺素释放引起的KMT5A表达增加,加速了动脉粥样硬化的进展。高脂饮食进一步增加了CNBP的表达,诱导了SYK的产生,并促进了血管炎症和动脉粥样硬化的发展。
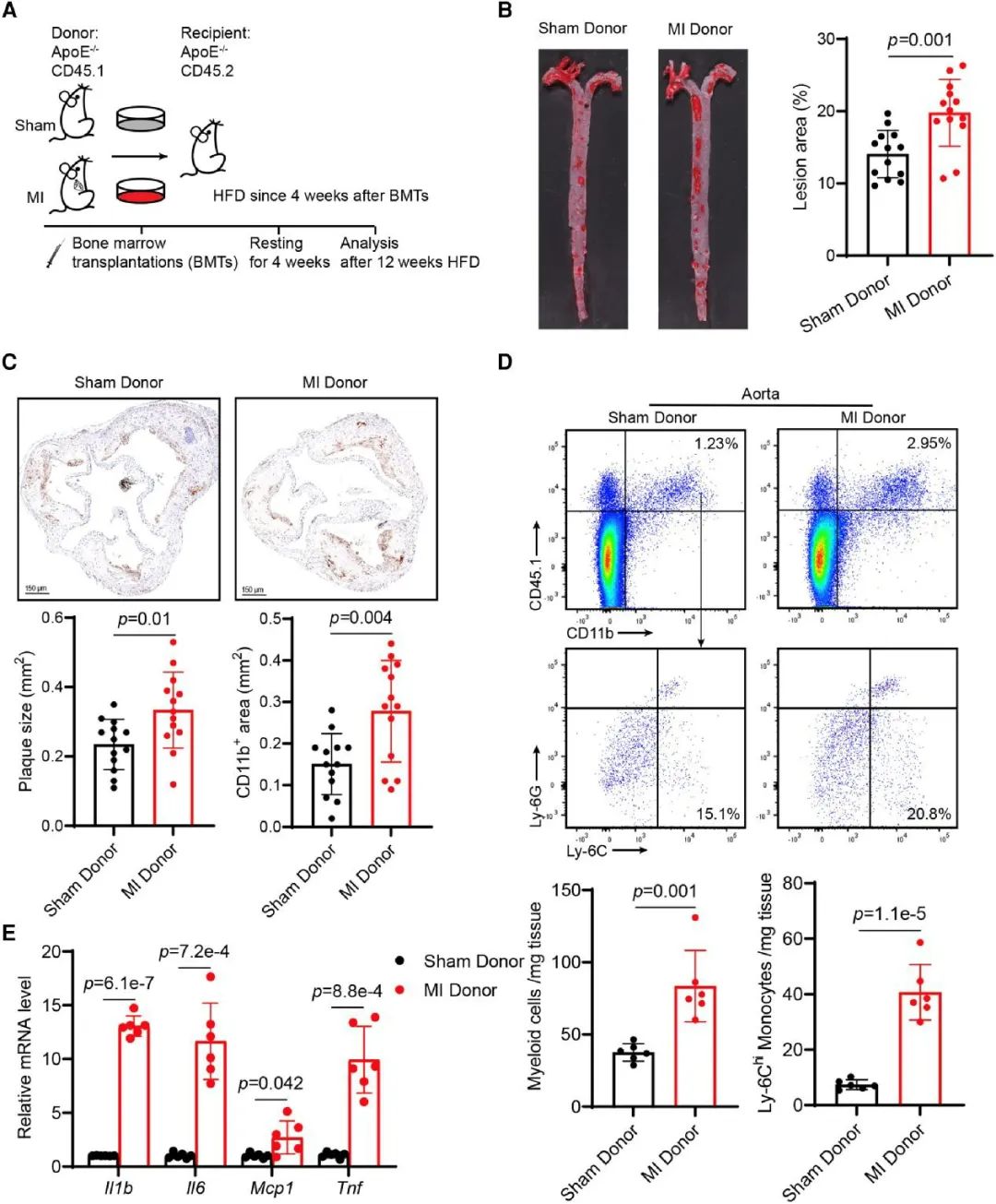
首先,研究人员发现与假手术组相比,心肌梗死组和缺血再灌注手术组显著加重高脂饮食诱导的动脉粥样斑块负担(详见在线补充数据)。为进一步研究髓样细胞在心肌梗死加速动脉粥样硬化过程中的重要性,研究者将假手术或心肌梗死小鼠的骨髓移植到未经处理的小鼠体内,随后进行12周高脂饮食。接受心肌梗死骨髓移植的小鼠显示明显增加的动脉粥样病变和斑块中更多的CD11b+髓样细胞,来自心肌梗死小鼠的骨髓激活了系统性炎症并加速了接受者小鼠中的动脉粥样硬化。
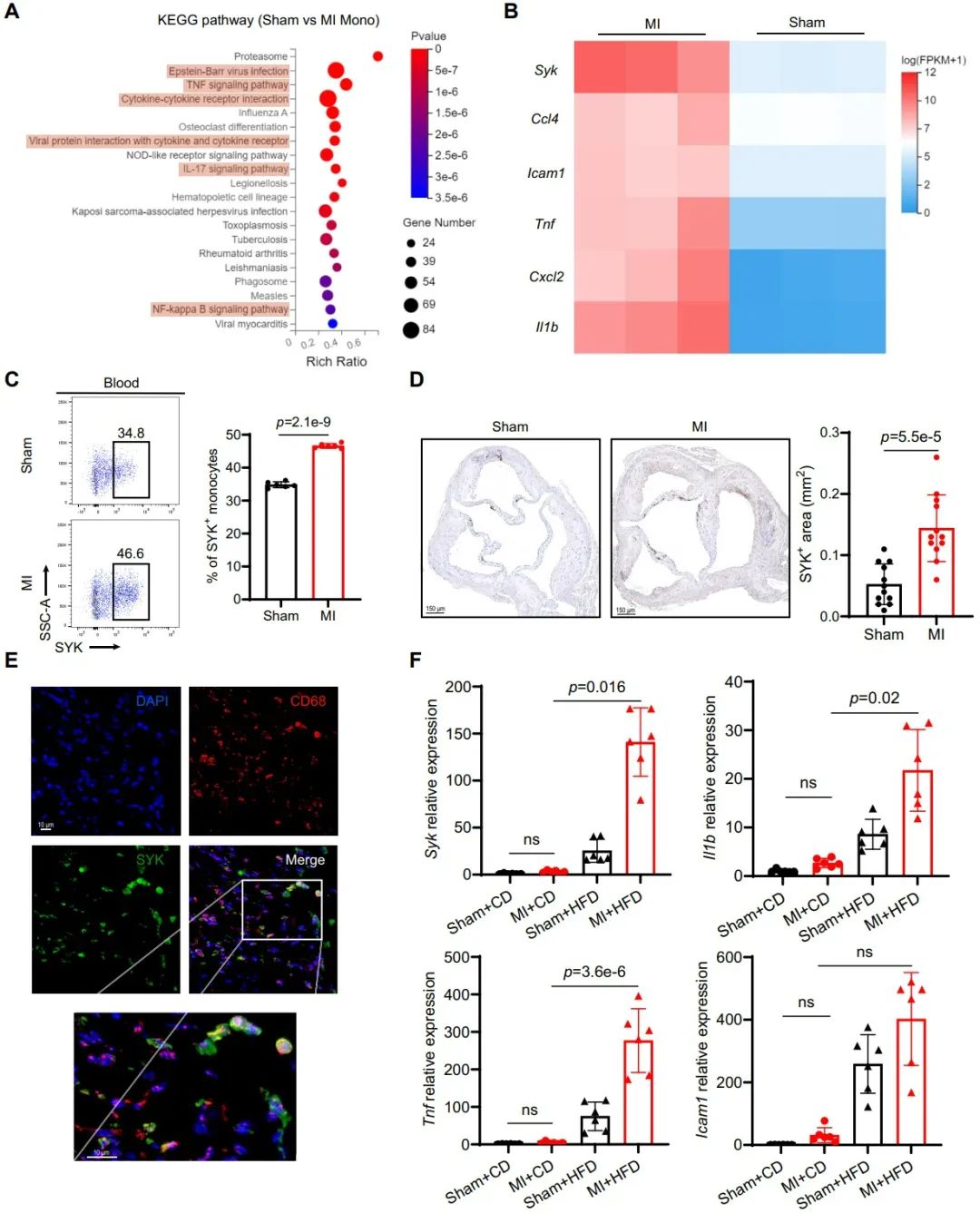
为了进一步探索其中的机制,研究人员通过对心肌梗死和假手术小鼠进行RNA测序,KEGG通路富集分析发现20个通路与炎症相关,大多数差异表达基因上调,提示心肌梗死后这些通路激活。特别是,SYK在心肌梗死后显著上调,可能成为单核细胞激活的标志物。SYK是一个关键的调节器,在心肌梗死后通过Dectin1等免疫受体介导多个促炎基因(如Il1b、Tnf和Icam1)的表达。这一发现强化了心肌梗死后单核细胞的促动脉硬化表型,为了解其机制提供了重要线索。
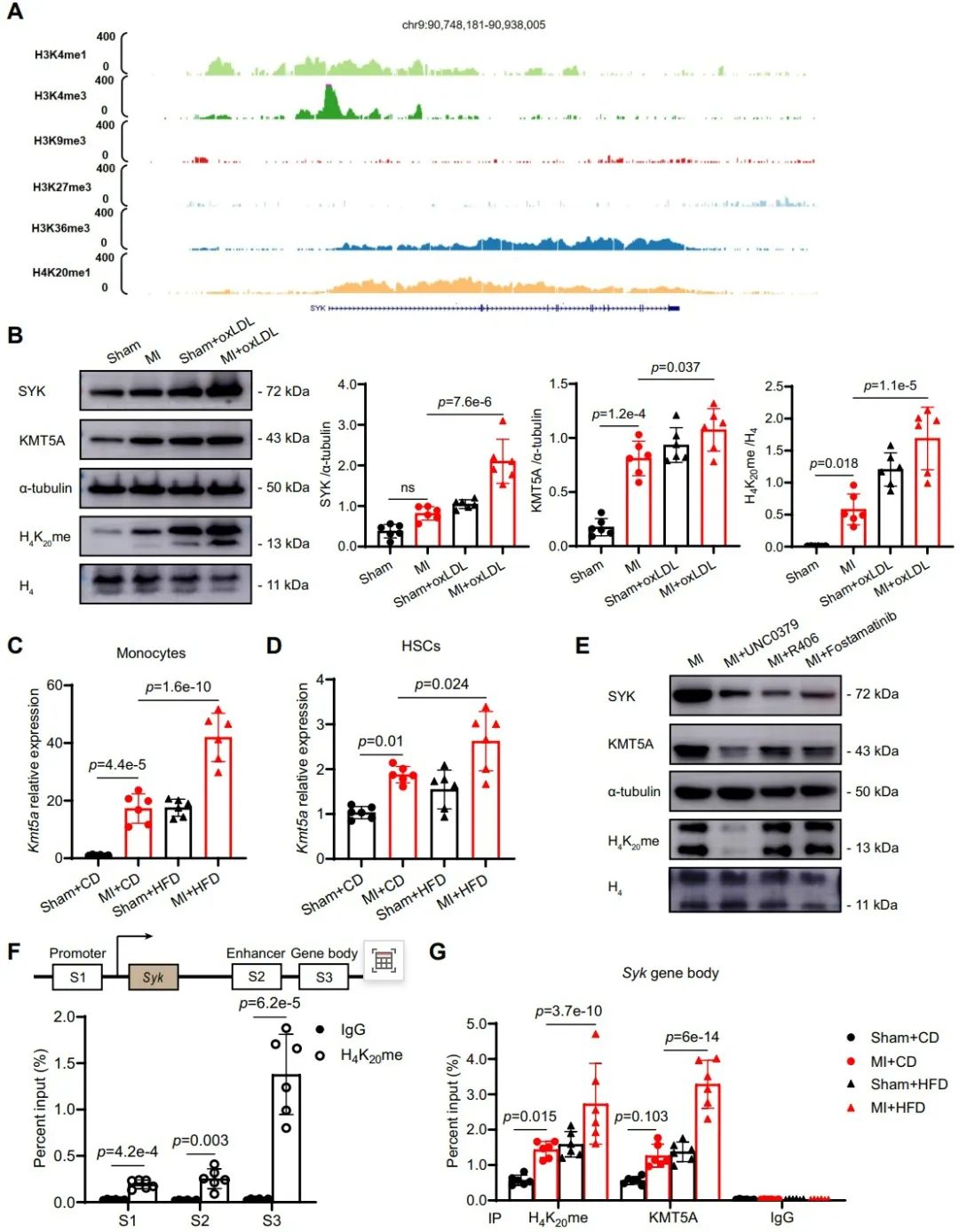
根据心肌梗死小鼠骨髓促进动脉粥样硬化的表型和单核细胞中促炎基因SYK的持续表达,研究人员假设这一现象是源自骨髓细胞的训练免疫。对心肌梗死小鼠进行MTA处理的BMDMs显示出SYK蛋白和mRNA水平显著的剂量依赖性抑制,表明组蛋白甲基转移酶可能调控SYK的表达。研究还发现,在心肌梗死后,H4K20me甲基化酶KMT5A在血液单核细胞中显著上调,推测H4K20me可能在心肌梗死后引起单核细胞中SYK的转录激活中发挥作用。进一步的实验表明,心肌梗死后的小鼠源BMDMs在oxLDL刺激下增强了SYK表达,并揭示了KMT5A和H4K20me的协同调控。这些结果表明,心肌梗死诱导的BM表观遗传重编程可能使单核细胞对高脂血症产生过度响应。KMT5A抑制剂和SYK抑制剂的治疗结果进一步支持了这一结论。
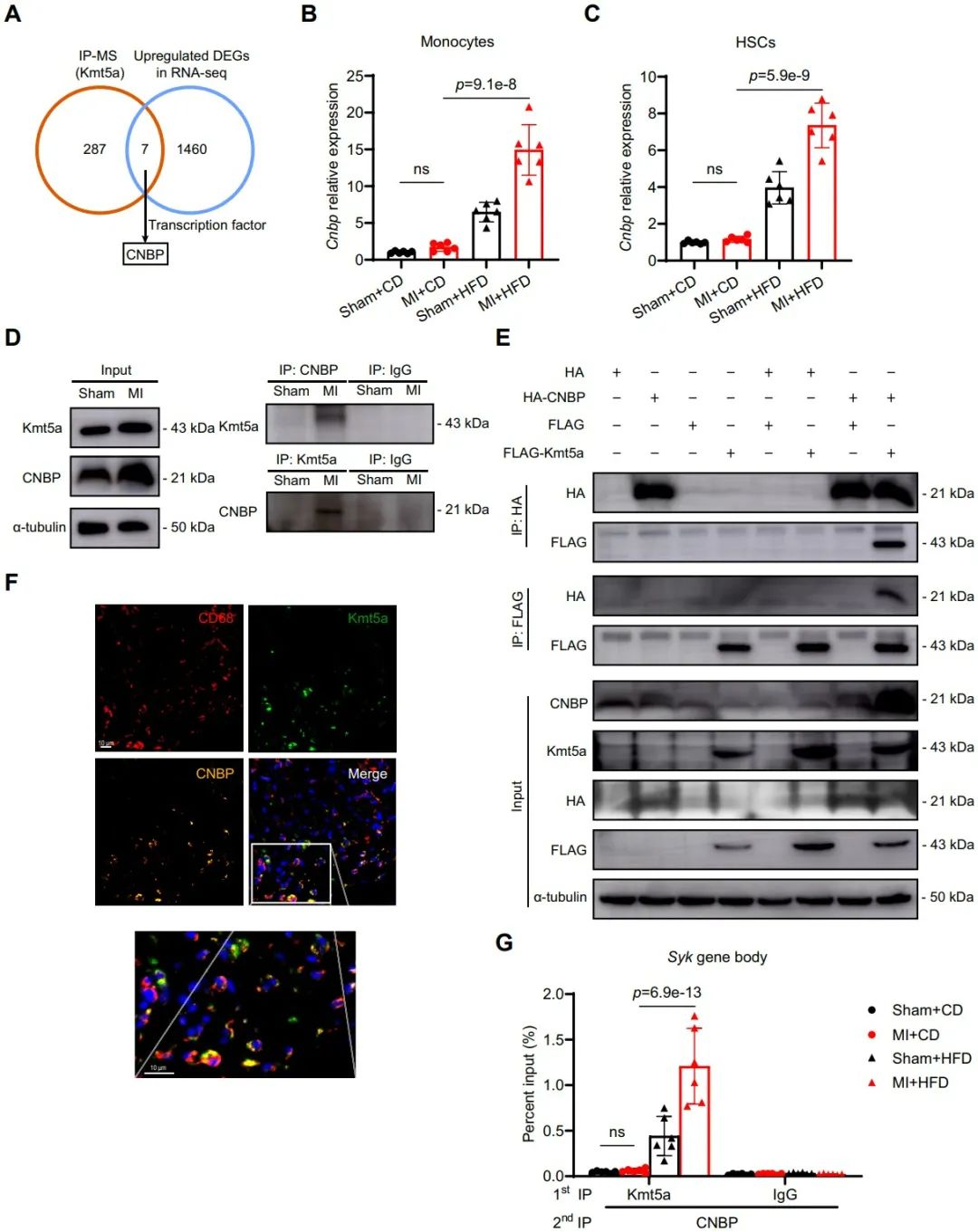
单核细胞表观遗传改变过程中转录因子的关键作用,决定了细胞命运或表型。为了确定在单核细胞中MI诱导的训练免疫中涉及的特定转录因子,研究采用免疫沉淀和质谱分析策略,鉴定出CNBP是与KMT5A结合的转录因子。研究还发现,MI手术结合高脂饮食显著增加了CNBP的表达。实验证实,MI手术增强了BMDMs中CNBP与KMT5A的相互作用,这种相互作用进一步在细胞中验证。这一研究结果表明,CNBP可能与KMT5A结合,促进单核细胞的训练免疫。
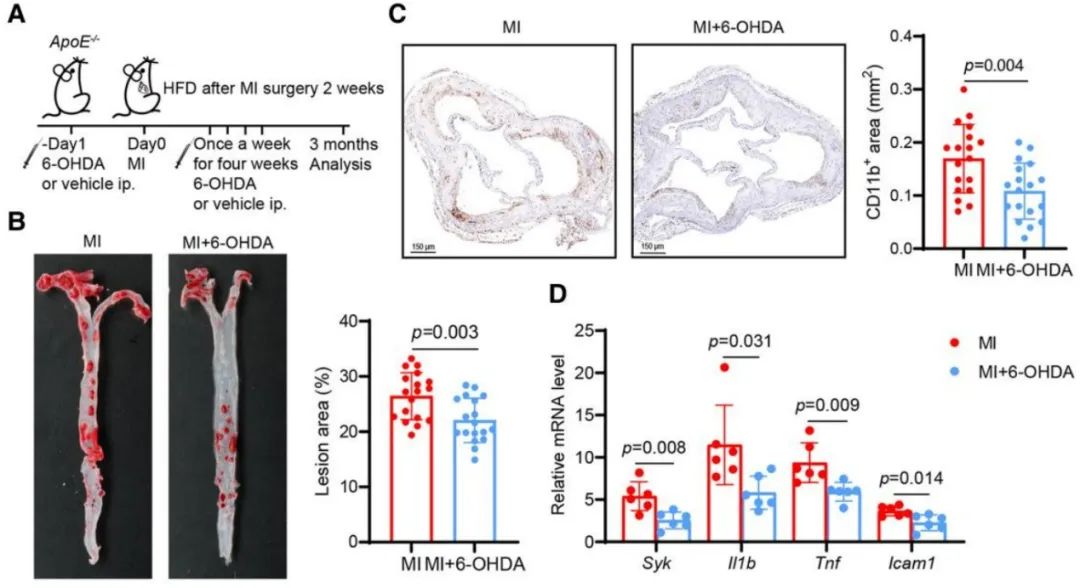
最新研究发现,心肌梗死后的焦虑、疼痛和心脏功能不佳会激活交感神经系统。研究显示,交感激活可能导致骨髓释放造血干细胞,进而贡献于循环中的促炎细胞。为了阻止外周交感神经递质的释放,研究人员使用神经毒素6-羟基多巴胺(6-OHDA)治疗心肌梗死小鼠。结果显示,这一治疗显著减小了心肌梗死小鼠动脉粥样硬化斑块的面积,同时降低了炎症水平。进一步的研究表明,交感兴奋可能在心肌梗死后激活单核细胞,促使其在动脉粥样硬化斑块中积聚并呈现促炎表型。
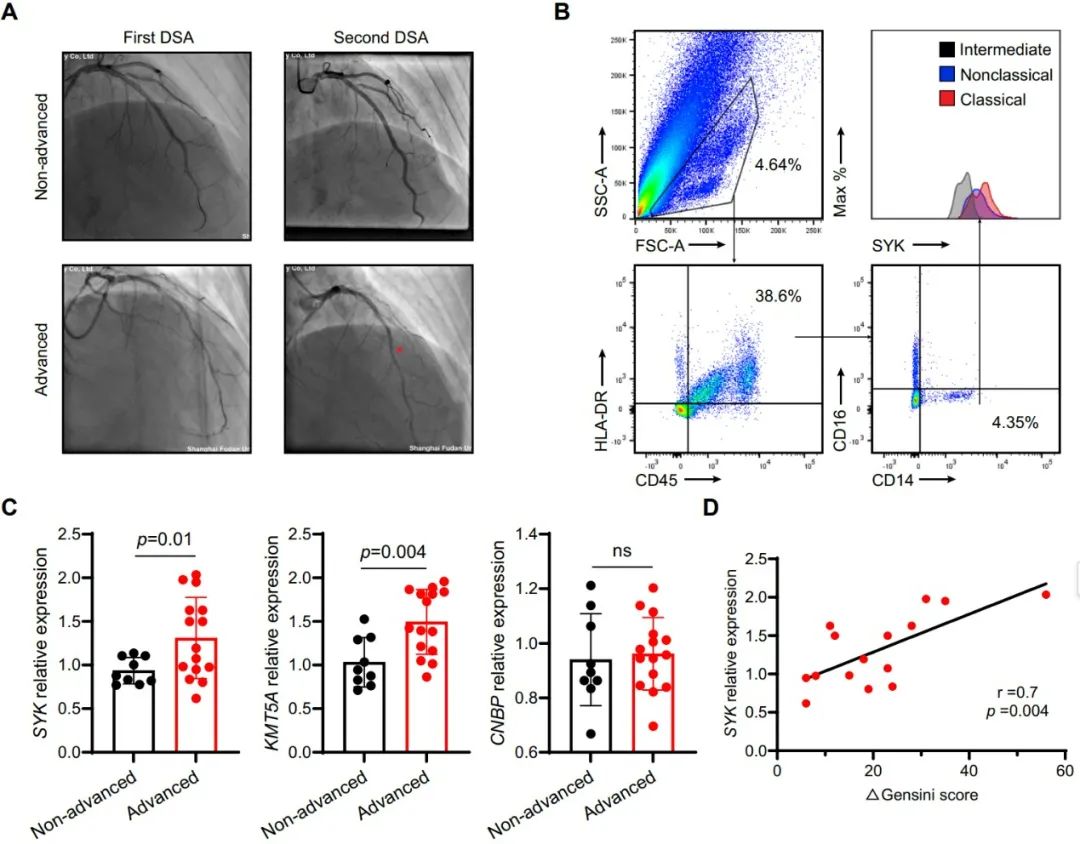
为了进一步验证上述研究结果,研究人员通过对STEMI患者进行为期一年的冠状动脉造影随访,根据Gensini评分进行分类,将患者分为动脉粥样硬化非进展组和进展组。结果显示,在进展组中,经典单核细胞中SYK和KMT5A的水平显著升高。流式细胞术进一步揭示,SYK主要表达于经典单核细胞,其mRNA水平与动脉粥样硬化斑块的严重程度呈正相关。多元线性回归分析表明,这种关联与传统心血管风险因素独立。这些结果提示,SYK在经典单核细胞中的表达可能与心肌缺血后较高的动脉粥样硬化负担相关。
综上所述,该研究揭示了心肌缺血诱导的单核细胞表观遗传重编程的过程在心肌缺血后加速非罪犯血管动脉粥样硬化进展中的重要作用,这为未来干预心肌缺血后动脉粥样硬化的残余风险提供了新的视角。
该研究由复旦大学附属中山医院/上海市心血管病研究所葛均波院士、翁鑫宇副研究员共同指导完成。复旦大学附属中山医院董正博士、上海交大医学院附属松江医院心内科行政主任侯磊博士、复旦大学附属中山医院罗伟博士(现工作于首都医科大学附属安贞医院心内科)为本文共同第一作者。中国药科大学徐涌教授在本文研究修回过程中给予重要指导。本研究获得国家科技部重点研发计划和国家自然科学基金等项目的资助。
原文链接:https://doi.org/10.1093/eurheartj/ehad787
国际著名心血管病专家。现任复旦大学附属中山医院心内科主任、教授,国家放射与治疗临床医学研究中心主任、上海市心血管病研究所所长、复旦大学生物医学研究院院长、中国医师协会心血管内科医师分会会长、世界心脏联盟理事、美国哥伦比亚大学客座教授,曾任中华医学会心血管病分会主任委员,美国心脏病学会国际顾问,亚太介入心脏病学会主席。先后荣获全国先进工作者、白求恩奖章、中国医师奖、中源协和生命医学奖、树兰医学奖、世界杰出华人医师霍英东奖。担任《Cardiology Plus》主编、《International Journal of Cardiology》副主编、《Herz》副主编。
共发表SCI 收录的通讯作者论文604篇;主编英文专著1部、中文专著22部,主编《内科学(第9版)》2021年获全国教材建设一等奖。作为第一完成人获得国家科技进步二等奖、国家技术发明奖二等奖、上海市科技功臣奖、上海市科技进步奖一等奖、上海市技术发明奖一等奖、教育部科技进步一等奖等科技奖项16项。
长期致力于推动我国重大心血管疾病诊疗技术革新和成果转化,在冠状动脉腔内影像诊断、复杂介入诊疗技术创新、新型器械研发和心血管危重症救治体系建立等方面,开展了卓有成效的研究工作。
- End -
关注我们
专业的心血管医生学术交流平台
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。






发表留言
暂无留言
输入您的留言参与专家互动