Eur Heart J | 中国人民解放军总医院陈韵岱教授团队揭示动脉粥样硬化新机制
动脉粥样硬化是心脑血管疾病的主要病理基础,其病变分布具有显著的空间异质性,常见于血管分叉处,这与该部位分布振荡剪切力的血流动力学环境密切相关。然而,振荡剪切力如何驱动局部炎症与斑块进展,其深层机制尚未完全阐明。
2025年12月17日,解放军总医院第六医学中心心血管病医学部陈韵岱教授联合中国科学院自动化研究所田捷教授团队,在心血管领域国际顶级期刊《欧洲心脏病杂志》(European Heart Journal, 影响因子35.7)上发表了题为“Atherosclerotic progression at sites of low shear stress is attenuated by Myeloid-PlexinD1 deficiency through suppression of classical macrophage polarization”的重要研究论文。研究团队在国家自然科学基金国家重大科研仪器研制项目、区域创新发展联合基金集成项目支持下,历时6年,整合临床影像、人类及动物病理、蛋白质组学、基因编辑动物、多模态分子成像等多学科技术,构建了从临床现象到分子机制的多层次证据体系,系统阐明了动脉粥样硬化斑块高发于血管分叉等特定区域的关键分子机制,为动脉粥样硬化斑块的早期精准识别与靶向干预提供了新的理论依据。

团队通过临床样本发现,在冠状动脉分叉病变患者的外周血浆及人颈动脉分叉斑块中,PlexinD1 (神经丛素D1)表达均显著上调,且与斑块不稳定性及经典M1型巨噬细胞极化密切相关。团队进一步利用基因编辑动物模型证实,特异性敲除髓系细胞中的PlexinD1,可有效抑制巨噬细胞M1极化并延缓动脉粥样硬化进展。
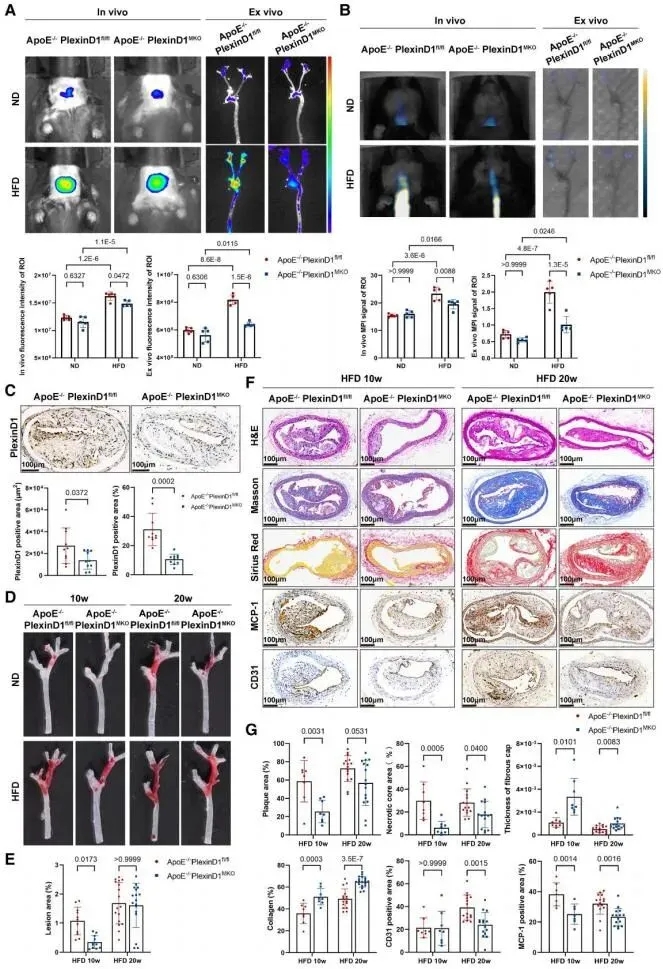
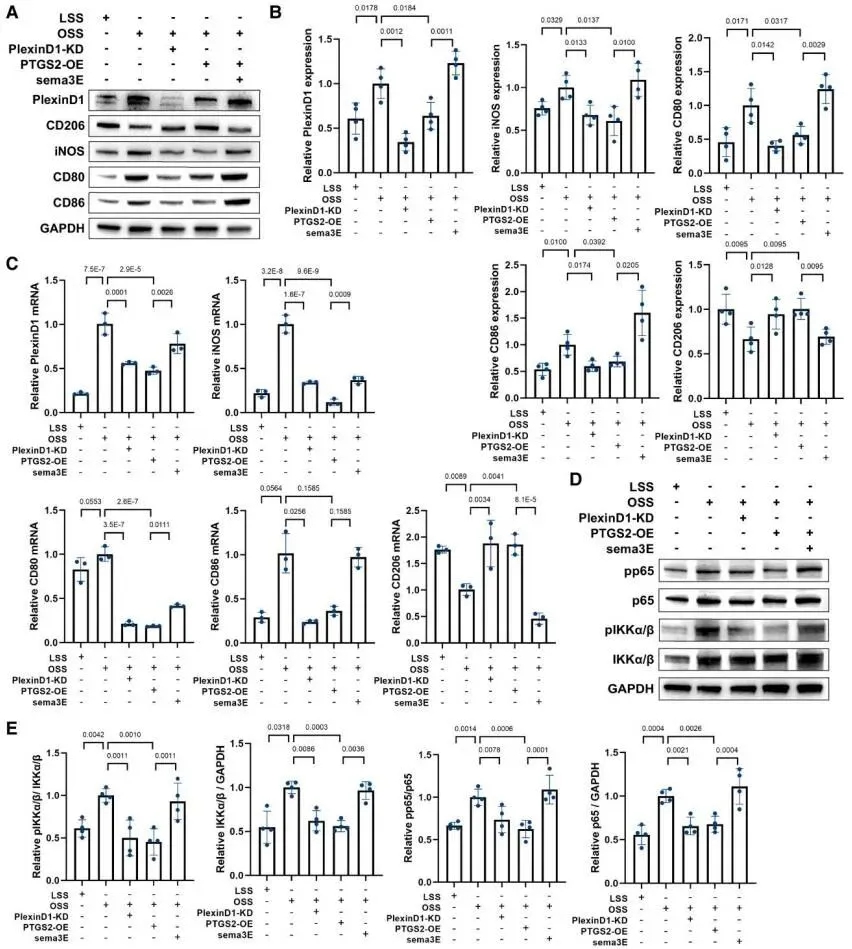
在机制层面,团队通过蛋白质组学与分子生物学手段,锁定了内皮细胞中响应振荡剪切力的关键因子PTGS2/PGE2 (前列腺素内过氧化物合酶2/前列腺素E2),完整解析了“振荡剪切力→内皮细胞PTGS2/PGE2下调→激活巨噬细胞PlexinD1/NF-κB通路→驱动巨噬细胞M1型极化”这一核心信号轴,揭示了振荡剪切力调控局部炎症微环境、促进斑块进展的分子机制链条。
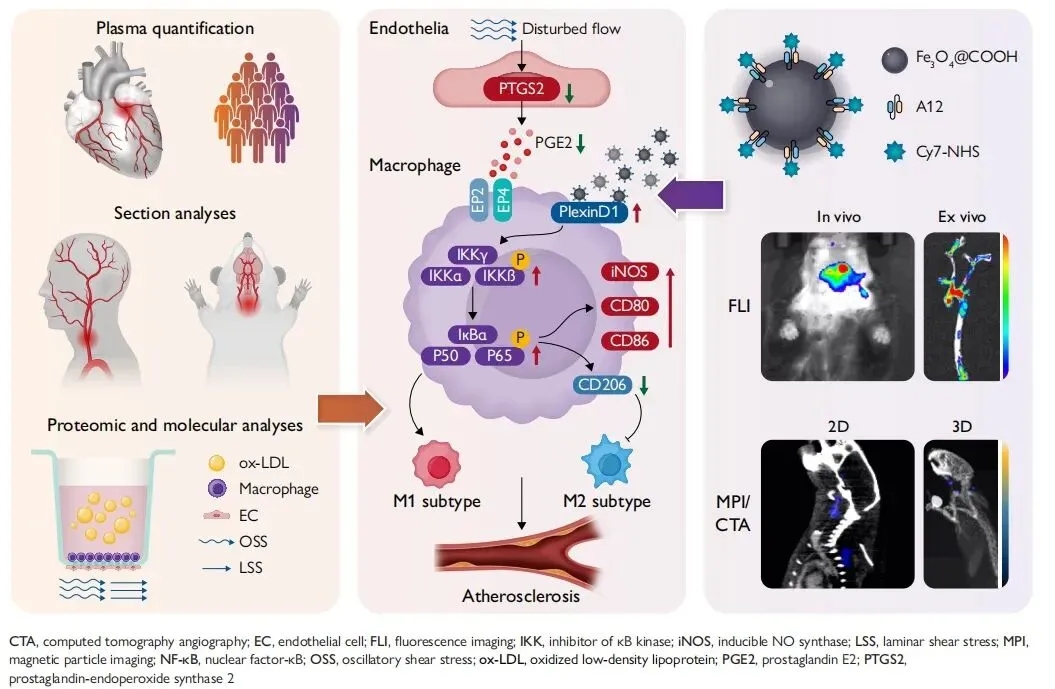
基于上述发现,团队成功构建靶向PlexinD1的多模态分子成像纳米探针,首次在活体层面实现了对小鼠颈动脉分叉病变的无创、动态、可视化监测,为动脉粥样硬化的早期诊断与精准干预提供了新型工具。该研究不仅从分子水平揭示了血流动力学影响动脉粥样硬化斑块发生及进展的机制,还创新性地提出了以PlexinD1为靶点的潜在诊疗策略。
长期以来,在陈韵岱教授带领下,研究团队始终聚焦于动脉粥样硬化性心血管疾病的多维影像精准评估及干预治疗,承担了包括国家自然科学基金、国家重点研发计划等多项国家级课题,并在《循环》(Circulation)、《欧洲心脏病杂志》(European Heart Journal)、《美国心脏病学会杂志》(JACC, Journal of the American College of Cardiology)等心血管领域顶级期刊发表系列突破性创新成果。本研究是团队深耕于动脉粥样硬化性心血管疾病的又一标志性成果,为推进心血管疾病向“精准预警、靶向干预”的诊疗模式奠定了基础。
原文链接:https://doi.org/10.1093/eurheartj/ehaf991
专家简介


-END-
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系

发表留言
暂无留言
输入您的留言参与专家互动