反复心包积液,竟是全球仅1000例的罕见病-脂质性肉芽肿(ECD)所致
心包积液是一种常见的临床表现,致病因素复杂多样。上海十院心脏中心接诊了一例反复心包积液伴黄色瘤、脂肪肝、高血压的患者,经风险评估、辅助化验检查未找到明确致病因素,后因患者家庭原因暂停进一步诊疗,一月后又因大量心包积液入院,手术切除部分组织活检、行基因诊断,结合其他检查结果,最终确诊为全球仅1000例的罕见病--脂质性肉芽肿(ECD)。给予降压、干扰素治疗后黄色瘤消退、心包积液逐渐消失、预后良好。下面让我们一起来了解下详细的诊疗过程。

主诉:
患者,男,40岁,反复胸闷、气急1年半,加重1月。
现病史:
2017年12月开始出现受凉后胸闷、气急,活动后加重,休息后缓解,无胸痛,无发热,无黑朦晕厥。当时未重视。未就诊。
2018年11月,胸闷、气急症状加重,于当地医院就诊,心超提示“中大量心包积液”,当时行“心包穿刺引流术”,“引出淡黄色澄清液体190ml,心包积液送检未见肿瘤细胞,未见结核菌”。行血T-Spot检查阴性。当时患者症状好转,但心包积液仍反复出现。
2019年1月至上海进一步检查,外院心超提示“中等量心包积液,主动脉增宽”当时自身免疫指标,肿瘤指标,尿蛋白检查提示阴性。
2019年4月再次因胸闷气急、双下肢浮肿至我院就诊,以“心包积液”收入我科。
既往史:
-
2009年8月因高空摔伤,行腰椎手术。
-
2016年7月皮肤出现“黄色瘤”, 病变侵犯口腔粘膜、咽喉部,伴有声音嘶哑,取皮肤活检: 真皮浅中层大量泡沫样细胞、少许嗜酸性粒细胞、淋巴细胞浸润。病理改变符合“黄色瘤”,开始服用辛伐他汀。
-
2018年11月当地住院时发现血压升高,最高血压190/120mmHg,服用硝苯地平、缬沙坦,美托洛尔等,平时血压在150/90mmHg。
-
发现脂肪肝10余年。
-
否认糖尿病等其他疾病病史。
个人史:少量饮酒史,否认吸烟史。
婚育史:已婚已育,子女体健。
家族史:否认有家族性遗传性疾病病史。
1.体格检查
-
T:36.5℃,P:99次/分,R: 25次/分,BP:145/95mmHg,BMI: 26.1kg/㎡。
-
神志清楚,精神正常,自主体位,皮肤黏膜可见色素沉着。
-
双肺叩诊呈清音,双肺呼吸音粗,未闻及明显干湿啰音。
-
心前区无异常隆起,心尖搏动减弱,无震颤,心界向两侧扩大,心率99次/分,律齐,可及早搏,心音减弱,各瓣膜区未及病理性杂音,未及心包摩擦音。
-
腹软,无明显压痛,肝脾肋下未及,双下肢浮肿 (++)。
2.辅助检查
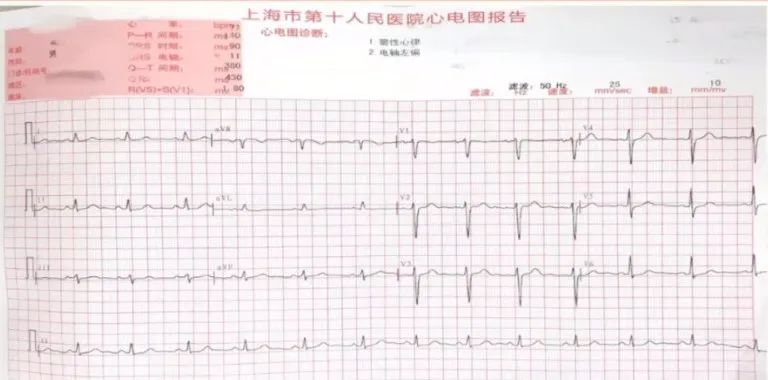
心电图
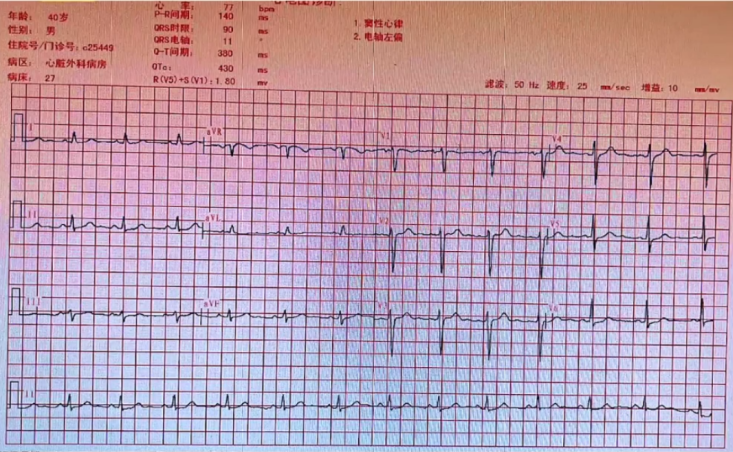
十二导联心电图:窦性心律,电轴左偏
心脏超声检查

-
中年男性,反复心包积液2年。
-
既往多次心包积液病史,曾行心包穿刺引流,查肿瘤标志物,肿瘤细胞,结核指标阴性。
-
既往病史主要为高血压病史,黄色瘤,脂肪肝病史。
-
心脏超声提示中等量心包积液。
-
心包积液(原因待查)
-
高血压3级(高危组)
-
黄色瘤
-
脂肪肝
1.该患者反复心包积液原因分析?
2.需要进一步完善哪些检查?
针对上述两个问题
复旦大学附属中山医院建议补充以下病史,患者在病程中有无消瘦、盗汗、体重下降、纳差、厌食、腹泻、血便、口干、眼干、皮疹、关节痛、雷诺现象等,有无使用过特殊药物和毒物。查体补充有无奇脉、颈静脉怒张、周围血管征、颈动脉、锁骨下动脉区域有无血管杂音,有无口腔溃疡、皮疹。
该患者在病程中无发热症状、无既往血常规结果,缺乏感染依据。应完善血常规、CRP、PCT检查,主要看白细胞分类,嗜酸性粒细胞。病毒相关进行肠道病毒、巨细胞病毒、疱疹病毒抗体的检查;支原体、衣原体抗体筛查;真菌g、gm 试验;寄生虫抗体筛查。
自身免疫相关只有T-spot阴性,需补充检查自身抗体、类风湿因子、免疫细胞、炎症因子,常规的肝炎和HIV检查排除免疫缺陷。
既往心包积液送检未见肿瘤细胞,无肿瘤依据。建议行肿瘤筛查:肿瘤标志物、胸骨盆ct、心脏磁共振,经济条件较好的可以选择pet-ct。
患者有脂肪肝、黄色瘤,未见血脂化验结果,建议补充血脂检查,考虑是否为胆固醇性心包积液。
代谢性因素相关,建议检查肾功能排除尿毒症、甲状腺功能疾病,比如甲减引起的心包积液。
除此之外,行常规的肌钙蛋白、CK-MB、D-二聚体的检查排除肺栓塞、主动脉夹层。
对于不明原因的中量心包积液,建议再行心包穿刺进行病因诊断,观察积液性质。若呈“黄金漆样”外观,考虑胆固醇性心包积液;偏白色考虑乳糜性积液,送常规生化ADA培养,包括结核培养、肿瘤脱落细胞的检查。送ngs 测序,明确有无微生物感染。
上海市宏康医院认为结合患者的病史、既往检查结果,倾向患者为特发性或代谢性因素引起的心包积液,需要完善患者的甲状腺功能及内分泌轴检查。
建议提供患者的血脂情况及既往心包积液的常规生化检查结果,包括积液的蛋白含量、LDH、葡萄糖、胆固醇、甘油三酯以及细胞计数和分类等,特别是胆固醇含量。同时建议提供近期心包积液,了解其外观性状,送病理检查,观察镜下有无碎玻璃样胆固醇结晶、巨噬细胞、泡沫细胞,若有,则胆固醇性心包炎可能性较大,同时该疾病为慢性渗出性病变,与患者慢性病程相符。
此外,因心包积液反复出现,建议行心包开窗术,取部分心包组织进行活检。
上海瑞金医院建议完善肿瘤标志物及影像学检查,如胸腹增强ct或pet-ct。
根据患者长期慢性反复发病,少中量心包积液及较低的耐受程度,考虑为心脏自身疾病,建议提供患者父母、兄弟姐妹有无高血压、冠心病等信息,以及患者的血脂控制情况。做冠脉CTA排除冠心病。
另外,心超提示室间隔厚度11接近临界值,E/E’大于15。心电图有肢体低电压倾向,要排除浸润性心肌病的可能,需提供既往心电图和心超报告做对比。另需完善血清免疫球蛋白测定、血尿电解质以及免疫固定电泳、心超心室整体长轴应变以及心脏磁共振检查。
厦门大学附属心血管病医院认为患者皮肤黄色瘤病变侵犯口腔粘膜、咽喉部,伴有声音嘶哑,不能排除血液系统疾病累及皮肤。查阅文献发现一些非朗格汉斯细胞组织增生症可以累及皮肤,导致黄色瘤样皮损,同时还会累及多个内脏器官,其中心包就是一个比较常见的累及部位。需要提供患者皮损相关照片,进一步完善心脏核磁、心脏核医学检查,明确是否有心包或心脏肿物或是浸润,必要时做心包活检,病检看是否有大量泡沫样细胞浸润。
其他补充:
1.病因方面病人不能完全排除甲状腺功能减退合并的继发性的高脂血症,需进行甲状腺功能评估。在患者病史中应补充:药物过敏情况,激素类、青霉素类药物使用情况。除此之外,病人最高血压190/120mmHg,需完善高血压相关检查。
2.根据患者病史及检查结果,排除心衰、心梗、恶性肿瘤、结核性心包炎、病毒感染、肾病、甲状腺等疾病。虽自身抗体阴性,但查体皮肤色素沉着未做具体描述,不能完全排除自身免疫性疾病。建议仔细查体,详细描述皮肤状况,主要是黄色瘤样变目前与既往的情况。评估是否有系统性硬化症、雷诺现象等,有无ECD累及骨导致骨痛的症状。完善HIV的筛查和淋巴细胞功能的检查,排除免疫缺陷。
患者2016年出现黄色瘤病,后17年心包积液,两者是否有关联?比如脂质性心包炎,心包积液或黄色瘤只是其中一种表现,原发病可能是脂质性肉芽种性疾病,比如ECD,它可以累及心包,导致心包大量积液,心包压塞。诊断主要通过组织学、临床症状和影像检查结果。组织学检查有大量泡沫样、脂质沉积样细胞,最有特异性的是Touton细胞,它是炎症细胞和多核巨细胞。患者的病史里面提及,黄色瘤侵及口腔粘膜、咽喉部,和常见黄色瘤表现不太一致,需考虑脂质性肉芽肿性疾病。建议胸部CT排除结核感染,以及自身免疫疾病肺部累及或者其他系统累及的证据。做心脏磁共振检查,明确是否有心包占位性病变。必要时,行pet -ct或骨扫描。同时建议做心包穿刺与活检。
风险评估
入院后进一步诊疗前对患者进行了风险评估,慢性起病,入院血压145/95mmHg (平素血压150/90mmHg),无颈静脉怒张,心音减弱,无心包填塞。既往心包穿刺引流,未检测到肿瘤和结核分支杆菌,考虑单浆膜腔积液。
心包积液病因
辅助检查
→肝功能:谷丙转氨酶10.4U/L,谷草转氨酶:12U/L,白蛋白:37g/L↓,Y GT17.6U/L,TB:6.2umol/L。
→肾功能、电解质:BUN:5.52mmol/L,Cr:71umol/L,UA:377.5umol/L,K+:3.9mmol/L,Na+:140mmol/L,CL:106mmol/L。
→心肌标志物:TnT:0.003ng/mL,Mb:21ng/mL,CK-MB:0.45ng/mL,NT-ProBNP:84.68pg/mL。
→血糖:FG:5.0mmol/L,糖化HGB:5.4%。
→血脂:TC:3.08 mmol/L,TG:0.86 mmol/L,LDL-C:1.95mmol/L。
→凝血功能:PT:12.0秒,APTT:26.2秒,TT:16.7秒,D二聚体:0.39mg/L。
→血常规:WBC:6.19*10^9/L,
N:69.2% ,Hb:126g/L↓,PLT:225*10~9/L,CRP:9.37mg/L。
→病毒:柯萨奇病毒(-)EB病毒(-)呼吸道病毒九联(-)
→其他:甲肝、乙肝、HIV、梅毒(-),抗结核抗体:(-)
→甲功:(-)
→肿瘤标志物:
癌胚抗原、CA153、CA125、CA199、CA724、PSA(-)
NSE 20.64 ↑ ng/ml,铁蛋白436.40↑ ng/ml
→免疫:
抗核抗体、ENA、抗线粒体抗体、抗平滑肌抗体、抗心肌抗体、ANCA、双链DNA抗体均为(-)
免疫球蛋白、补体C3/C4、抗“0”、类风湿因子均为(-)
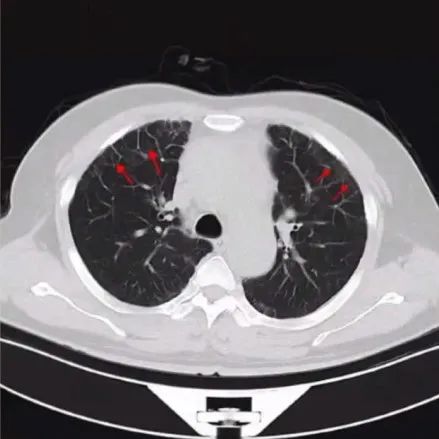
胸部CT:
两肺胸膜下间质性改变
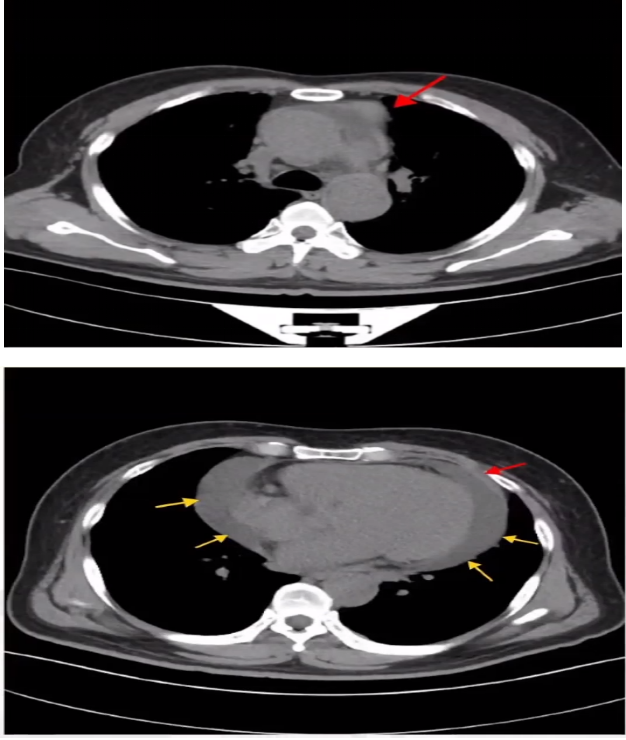
心脏MRI:
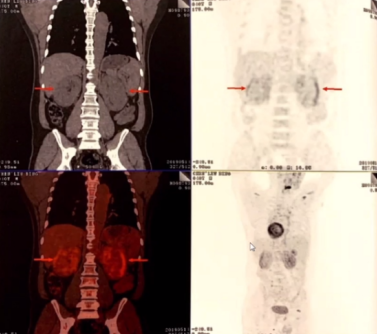
心尖水平左室前壁前缘心包局部呈团块样增厚,心包大量积液。
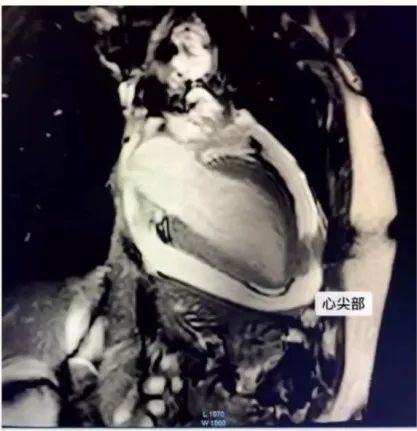
心包多处增厚(红色箭头),心包大量积液(黄色箭头)。
PET-CT:
心包多处不均匀增厚,心包积液。
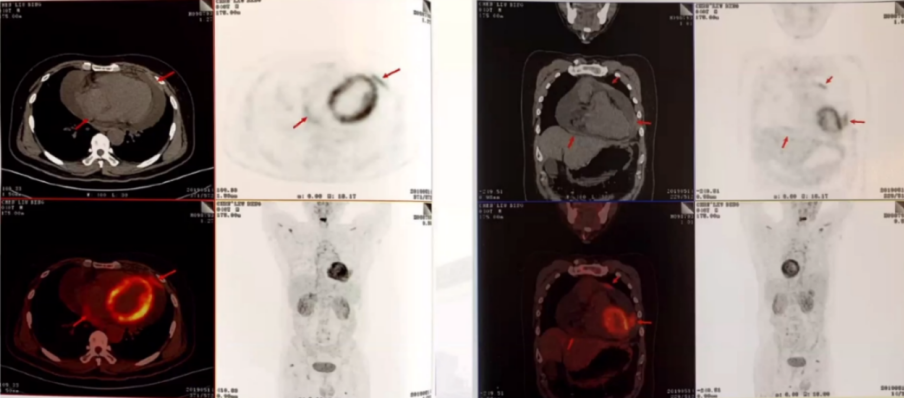
升主动脉、主动脉弓、降主动脉、及上腔静脉弥漫性代谢增高。
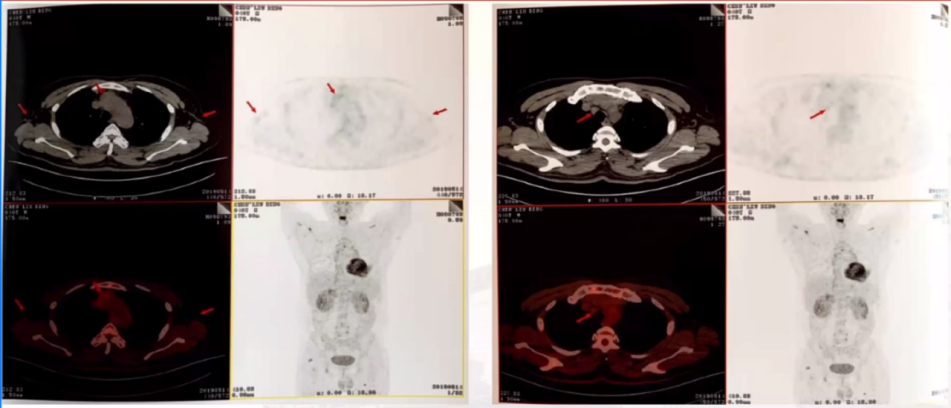
双侧杓状会厌襞明显增厚,会厌前间隙软组织增厚。
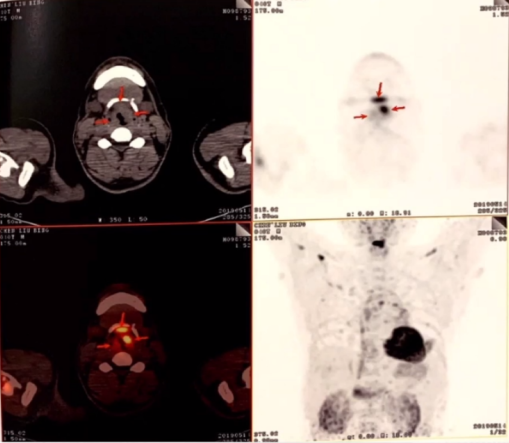
双肾弥漫性不均匀性代谢增高
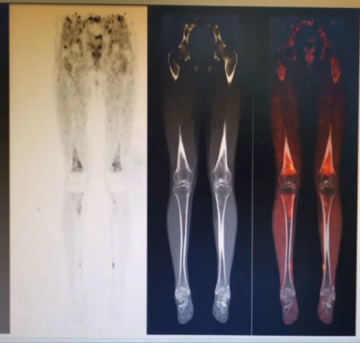
全身多发骨骼斑片状、结节样高密度影伴FDG代谢增高以股骨和胫腓骨干骺端代谢增高为主。
根据以上检查结果
诊断
-
心脏原发肿瘤?或转移瘤?
-
心包积液
-
高血压3级(高危组)
-
黄色瘤
-
脂肪肝
进行完上述化验检查,患者因家庭原因暂缓检查及治疗,1月后,再次因大量心包积液入院,行手术处理。
1.术前评估:
心超:左心饱满、室间隔稍增厚、主动脉瓣微量反流、中大量心包积液。

心电图:窦性心律,电轴左偏,和之前入院检查结果无明显差别。
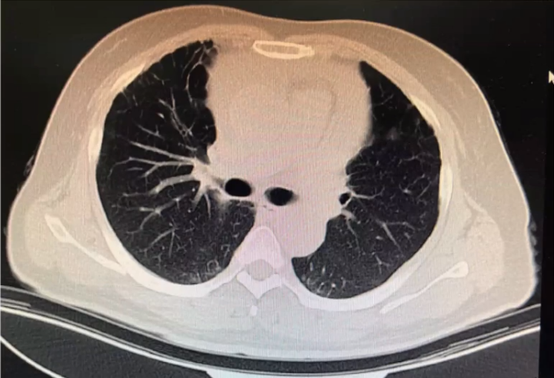
肺部CT
两肺多发散在淡薄斑片状、磨玻璃结节,考虑炎性改变;心包积液左侧胸膜稍增厚。
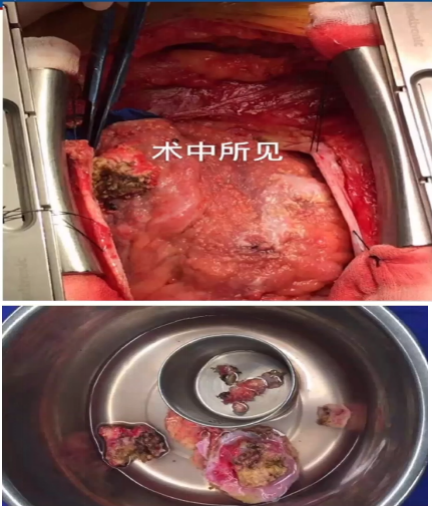
2.手术情况:
行心包肿瘤切除术,打开心包,见大量黄色心包积液,吸除600ml,探查心脏,见升主动脉、心脏表面、均有类似脂肪沉着,上腔静脉、心包膈面增生明显,触感质硬,心尖部见一肿物,与周围心包黏连。置左胸、心包及纵隔引流管各1根。
3.术后检查结果
病理结果:
-
(心包、升主动脉)淡黄色质中偏韧组织,5*4*1.5cm。
-
纤维组织增生伴胶原化,可见淋巴、浆细胞、少量嗜酸性粒细胞浸润,伴大量泡沫细胞反应及少量杜顿(Touton)巨细胞。
-
不能除外Erdheim-Chester Disease(脂质肉芽肿病),cd34+、cd99+、cd68+、pgml+、s100-。
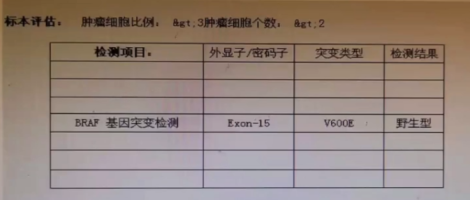
基因检测结果
ECD常见的BRAF或者MAP2K1突变为(-)。
组织和血浆外送基因检测——可见DNMT3A p.W305*突变。
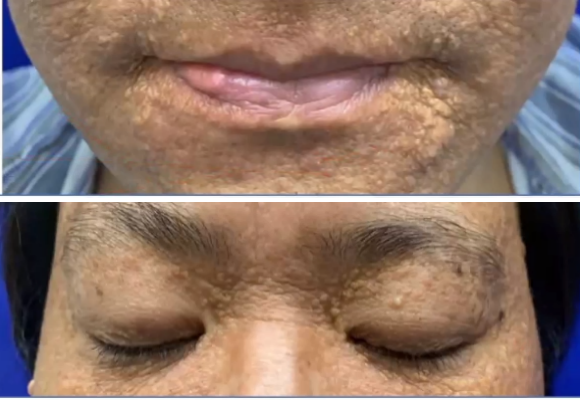
皮肤黄色瘤活检
取皮肤活检:真皮浅中层大量泡沫样细胞、少许嗜酸性粒细胞、淋巴细胞浸润,可见少量杜顿巨细胞。
4.病史小结
-
中年男性,慢性起病,起病隐匿。
-
反复中大量心包积液,心包穿刺出淡黄色液体,结核实验阴性。
-
肿瘤标志物、免疫学检查阴性。
-
心脏磁共振、PET-CT提示心尖部有团块样增生影。
-
FDG PET-CT提示多器官累及伴弥漫性代谢增高。
-
皮肤活检、心尖部肿物活检均提示:淋巴、浆细胞、大量泡沫细胞,少量杜顿巨细胞浸润。
-
组织及血浆基因检测:ECD常见的BRAF或者MAP2K1突变(-);可见DNMT3A p.W305*突变。
5.最终诊断
-
Erdheim-Chester disease (ECD,脂质肉芽肿病)
-
心包积液
-
高血压3级(高危组)
-
脂肪肝
6.治疗方案
参照文献,对于无法靶向治疗且高负荷的病人,可以考虑IFN-α/PEG-IFN-α或克拉屈滨治疗。

降压:硝苯地平控释片、缬沙坦。
抗肿瘤治疗:
-
重组人干扰素 ɑ2a。
-
300万u tiw治疗1周,600万u tiw治疗1周,900万u tiw长期维持。
黄瘤样变皮损有明显的改善
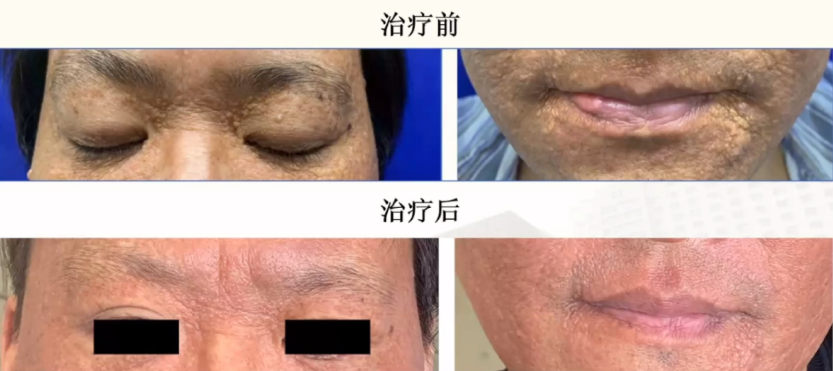
心脏超声检查,术后有少量心包积液,之后复检量逐渐减少,后再未出现。

随着治疗时间延长,PET-CT心包FGD代谢逐渐减轻,提示治疗有效。
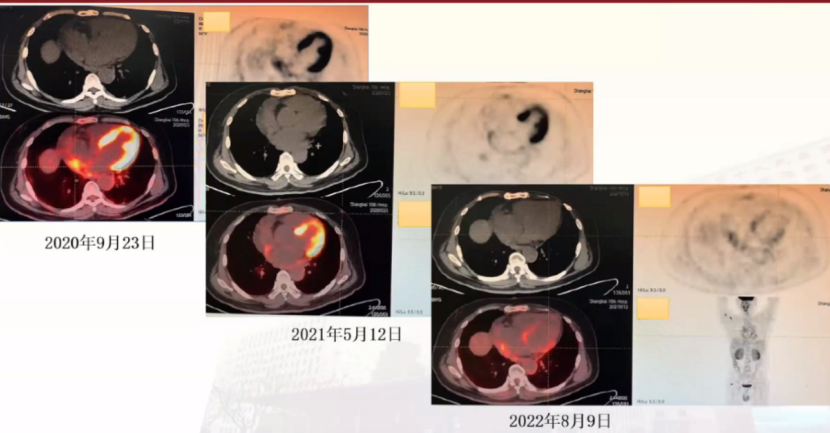
对于以呼吸困难起病,发现心包积液的患者,要进行全面病因筛查,充分排除常见心包积液病因后,发现其他部位多发病变时,尽量一元论解释疾病全貌。
如发现有合并主动脉周围病变、对称的长骨病变、肺间质、肾周、眼部及中枢神经系统病变,尤其是多系统受累时,需警惕ECD可能。必要时行组织活检病理诊断及基因突变筛查进一步明确诊断,尽早开始针对性治疗。
概述:Erdheim-Chester disease(ECD)也称为Erdheim-Chester综合征或多发性硬化性组织细胞增生症),脂质肉芽肿病,是一种罕见的组织细胞增生性疾病。于1930年被Jakob Erdheim和William Chester首次描述。它于2016年被世界卫生组织宣布为组织细胞肿瘤,在2017年版WHO组织细胞疾病和巨噬-树突细胞系肿瘤分类标准中将其与朗格汉斯细胞组织细胞增多症(LCH)共同分为L组。
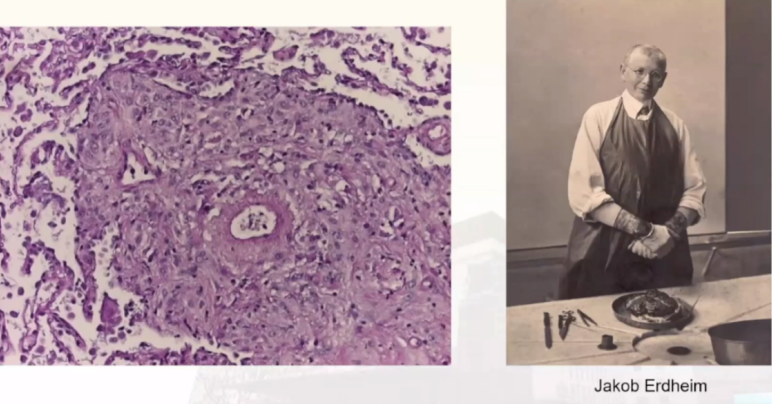
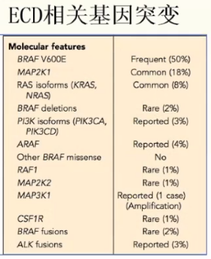
病因:目前发现50%~70%的ECD患者病变组织存在着BRAF、V600E突变;10%~20%患者存在着丝裂原活化蛋白激酶(MAPK)信号通路中其他的基因突变(如MAP2K1,NRAS,KRAS和ARAF突变等)。ECD患者通常存在相似的炎症因子激活,如干扰素α、白介素-4(IL-4)、白介素-7(IL-7)、白介素-6(IL-6)和肿瘤坏死因子-α(TNFα)等。因此,目前认为ECD是一种以MAPK信号通路激活为特征的克隆性血液系统肿瘤,属于一种炎性髓系肿瘤。
流行病学:好发于25-70岁成年人,平均年龄为53岁,男女发病率无差异,全球报道1000例左右。
临床表现:
ECD病变可累及全身各系统,因此其临床表现因受累部位不同而表现各异。一般症状包括发热、乏力、盗汗、体重下降等。其余受累系统主要包括:
1.骨骼系统
绝大多数ECD患者在诊断时候都有骨骼受累,以下肢骨最为常见,但仅有50%患者有骨痛表现。
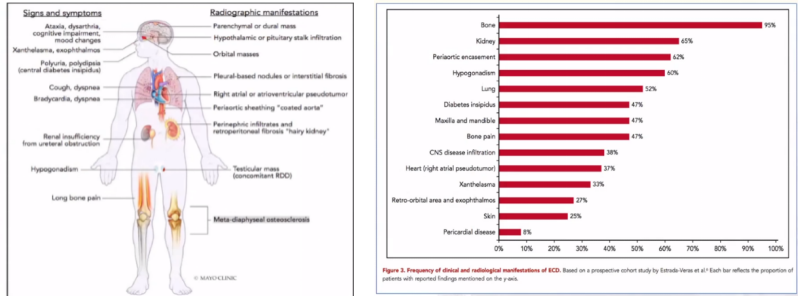
2.心血管系统
ECD病变累及心血管系统,多数患者并无明显临床表现,但如心包受累,造成大量心包积液可导致胸闷、憋气甚至心脏压塞表现;病变累及冠状动脉则可造成心肌缺血样表现,如胸闷、胸痛等;弥漫性心肌受累亦有报道,可导致心力衰竭样表现;病变包绕肾动脉则可造成肾性高血压;包绕肠系膜血管可有肠道缺血表现,如腹痛等。
3.呼吸系统
呼吸系统受累多数患者无症状,少数患者有干咳、呼吸困难等表现。
4.中枢神经系统
中枢神经系统受累可因不同部位脑实质受累而出现相应的临床表现,如肢体活动障碍、步态异常、意识改变等;脊髓受累可因不同受累节段而出现不同临床表现;垂体病灶则可表现为多饮、多尿以及其他激素分泌减少相关表现。
5.眶后病变
眶后受累为ECD常见临床表现之一,表现为单侧或双侧突眼,甚至造成失明。
6.腹膜后空间/肾脏受累
腹膜后病变可类似腹膜后纤维化,若病灶包绕输尿管可造成单侧或双侧肾后性梗阻。
7.皮肤受累
皮肤病变最为常见的为黄瘤样改变,约1/3患者发生在眼睑,面部、颈部、腋窝、躯干、腹股沟亦可出现。
ECD辅助检查
本病的实验室检查不具有特异性。可有炎性指标升高,如血沉(ESR)、超敏C反应蛋白(hsCRP)以及血小板(PLT)和纤维蛋白原(Fbg)升高;同时可有细胞因子升高,如IL-6、IL-8和TNF-α。另外,可有受累脏器功能不全表现,如肾功能异常、内分泌异常等。
影像学检查对于ECD的诊断以及疾病评估至关重要。FDG-PET-CT有助于评价疾病全身受累范围,受累脏器会有不同程度放射性浓聚表现。不同系统受累,影像学表现各不相同。①骨骼系统:骨骼X线为双侧长骨骨干的对称性骨硬化表现,骨扫描可见特征性的股骨远端和胫骨近端的放射性浓聚;②心血管系统:心电图可有短PR、传导阻滞、病理性Q波、ST-T异常等非特异性改变;心脏MRI、冠脉CTA和心脏超声可呈现心包增厚、心肌浸润、右心房占位、瓣膜反流、冠脉狭窄等改变;主动脉CTA可呈现较为典型的“主动脉套(coatedaorta)”,通常表现为血管周、主动脉旁浸润;受累血管包括头臂干、颈总动脉、锁骨下动脉、腹腔干、肠系膜上动脉、肾动脉等;③呼吸系统:肺部CT可表现为小叶间隔增厚、实变、小囊性变、间质改变、胸膜增厚等;支气管肺泡灌洗找到特异的组织细胞;④中枢神经系统:CT或MRI上可呈现垂体柄结节、脑实质占位性病变,脊髓病变;⑤眶后病变:CT或MRI可发现眶后肿物;⑥腹膜后空间/肾脏受累:腹部CT可见较为典型的“毛状肾(hairy kidney)”表现。
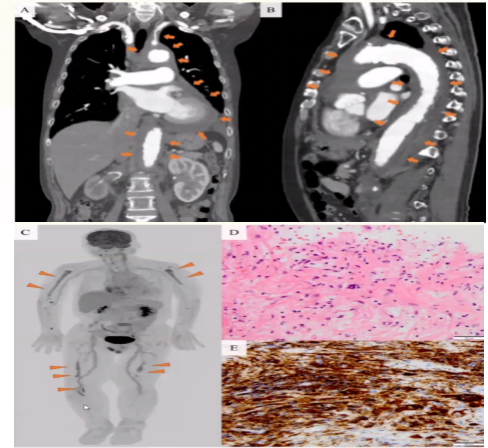
结合该病例:CTA显示心包积液、肾周脂肪、胸腹主动脉周围有明显的软组织鞘(图A、B)。(FDG-PET-CT)显示摄取增加双侧肱骨近端和胫骨远端(图C)。右侧肱骨病变活检显示一个多核的杜顿巨细胞和泡沫组织细胞(图D)阳性CD68染色(图E)。
诊断流程
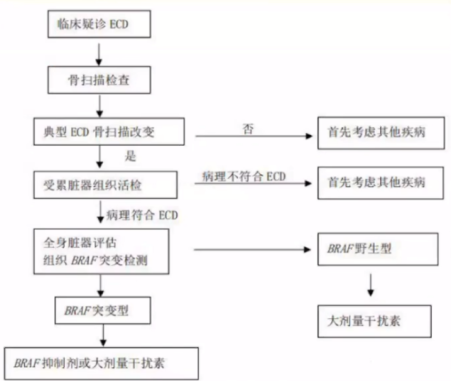
诊断要点
ECD的诊断需要结合典型的临床表现、影像学特征和病理学特征。
病理中发现组织中存在片状泡沫状组织细胞,伴有炎性细胞和多核巨细胞(Touton细胞)浸润以及纤维组织混合其中或包绕在外。组织细胞表达CD68和CD163,S100部分患者可以阳性,但不表达CD1a或CD207;电镜无Birbeck颗粒。50%-100%的ECD患者存在BRAF V600E 基因突变。
鉴别诊断
1.播散型幼年性黄色肉芽肿(DJXD):发生于10岁以下儿童,半数在1岁以内。与Ι型神经纤维瘤病相关,无BRAF突变。
2.Langerhans细胞组织细胞增多症(LCH):多见于儿童。肿瘤细胞呈现典型的Langerhans 细胞特征,有"咖啡豆样"核沟。背景较多嗜酸性粒细胞。表达CD1a、S-100、Langerin,弱或不表达CD68和CD163,电镜下有Birbeck颗粒。
3.组织细胞肉瘤(HS):HS肿瘤细胞呈现明显异形性,细胞大,圆或椭圆形,胞质丰富、嗜酸性,核膜不规则。无泡沫状(脂质化)组织细胞,无Touton巨细胞。
4.Rosai-Dorfman病:累及淋巴结或结外组织,表现为大量组织细胞增生。增生的组织细胞核圆形,较大,空泡状,核仁显著。胞质丰富,泡沫状,常含有完整的淋巴细胞和浆细胞。组织细胞免疫表型:S100+、CD68+。
5. Gaucher病:Gaucher细胞具有嗜酸性胞浆呈“皱纹纸”样,常与骨坏死相关,Gaucher病骨骼无硬化,骨髓梗死时可出现硬化。
治疗
ECD目前尚无标准治疗。由于ECD临床表现的高度异质性,例如一些患者仅有缓慢进展的单个器官受累,如单独垂体受累表现为尿崩症的患者,在经手术切除后病情可稳定多年不需要治疗;而另一些有重要脏器受累如中枢神经系统、心血管等,或者进展迅速的患者,则需要积极全身治疗。
存在BRAF、V600E突变患者可以首选BRAF抑制剂维莫非尼(vemurafenib)治疗。而BRAF野生型患者可首选大剂量干扰素治疗(600~900 MIU,3次/周),或聚乙二醇干扰素2α:135~200 μg/周。对于难治复发ECD患者的其他治疗选择包括重组IL-1抑制剂阿那白滞素、克拉屈滨、阿糖胞苷、西罗莫司等。由于发现ECD是一种MAPK信号通路激活为特征的克隆性血液系统肿瘤,因此国外已有研究使用MEK抑制剂治疗,然而国内尚无此药。
一般治疗:如有中枢性尿崩患者,对症使用醋酸去氨加压素控制尿量。如有其他垂体-下丘脑受累导致的内分泌指标改变,可行相应的替代治疗。如有大量心包积液、胸腔积液等可对症行心包穿刺、胸腔穿刺引流,缓解临床症状。如发热、盗汗等症状明显,可考虑短期使用糖皮质激素控制炎症症状,但长期使用糖皮质激素患者无获益。
预后
为慢性临床过程,预后取决于疾病范围。中枢神经系统或多器官系统累及患者预后不良。


发表留言
暂无留言
输入您的留言参与专家互动