洪葵教授:心脏疾病遗传检测国际专家共识-遗传性心律失常篇
遗传性心血管疾病是指由基因变异引起,以心血管损害为唯一表型或伴有心血管损害,符合孟德尔遗传规律的一系列心血管疾病,数量达百余种,常表现出家族性聚集。基因检测是该类疾病诊断的重要方法,为更好的指导临床工作,2022年AEHRA/HRS/APHRS/LAHRS颁布了《心血管疾病基因检测专家共识》,第十五届逸仙国际心血管病论坛上,南昌大学第二附属医院洪葵教授从遗传方式与疾病、检测选择与突变解释、遗传性心律失常综合征的基因检测三个主要方面对指南内容进行了解读。
2022年4月欧洲心律学会(EHRA)联合美国心律学会(HRS)、亚太心律学(APHRS)、拉美心律学会(LAHRS)共同发布了关于心脏病基因检测的专家共识声明。
共识概述了基因检测的基本原则,并介绍了遗传性心律失常综合征、心肌病、心原性猝死、先心病等的基因检测现状。

1.孟德尔疾病的遗传模式
常染色体显性遗传(AD)基因的单个拷贝缺陷,无论该缺陷来自母亲还是父亲,都可致病;也可能由没有家族史的新突变引起。
常染色体隐性遗传(AR)母亲和父亲都需携带该基因缺陷,后代才能出现疾病表型。
X连锁疾病(X-linked disorders)是由X染色体上的基因突变引起的,分为X连锁显性遗传和X连锁隐性遗传。
女性患者 :X连锁显性遗传疾病,基因两个拷贝中的任一突变,就足以出现疾病表型;
男性患者 :无论是X连锁显性还是隐性,只要出现基因拷贝的突变就会出现疾病表型。
特点:这两种X连锁遗传的一个特点是男性不能将这种疾病遗传给其儿子。
2.相关遗传疾病
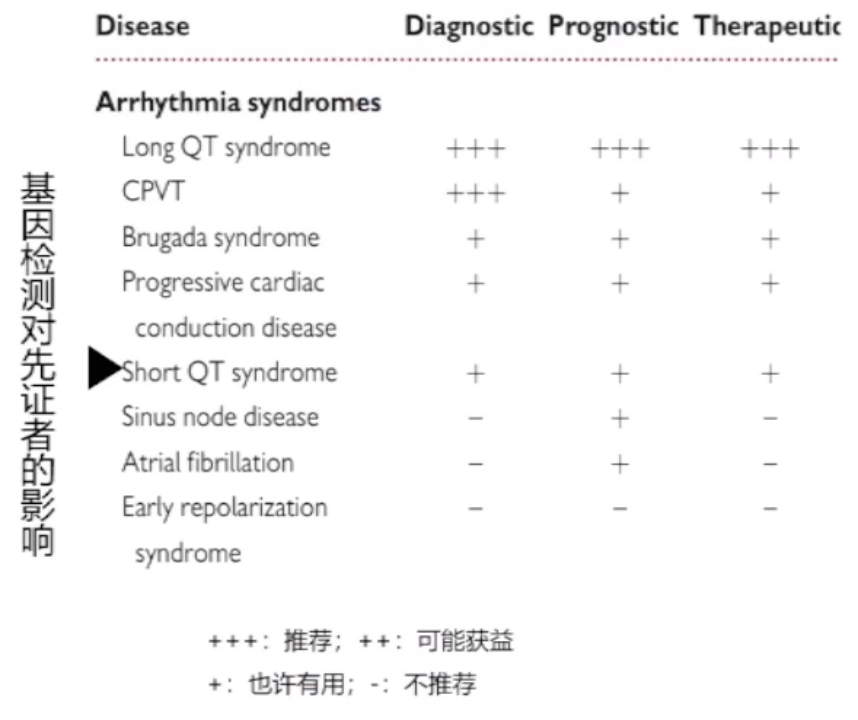
基因检测已被推荐用于许多遗传性心脏疾病的诊断,当已确定导致该疾病的基因突变时,可以通过级联筛查确定家系中该突变的风险携带者。
遗传性心律失常
-
长QT综合征(LQTS)
-
Brugada综合征(BrS)
-
短QT综合征(SQTS)
-
儿茶酚胺多形性室性心动过速(CPVT)
-
心脏传导缺陷
2015年,ACMG为临床试验中的遗传突变解释提供了一种标准的方法。根据该标准,可以将突变分为:致病性(P),可能致病性(LP),不确定临床意义的突变(VUS),可能良性(LB)和良性(B)。
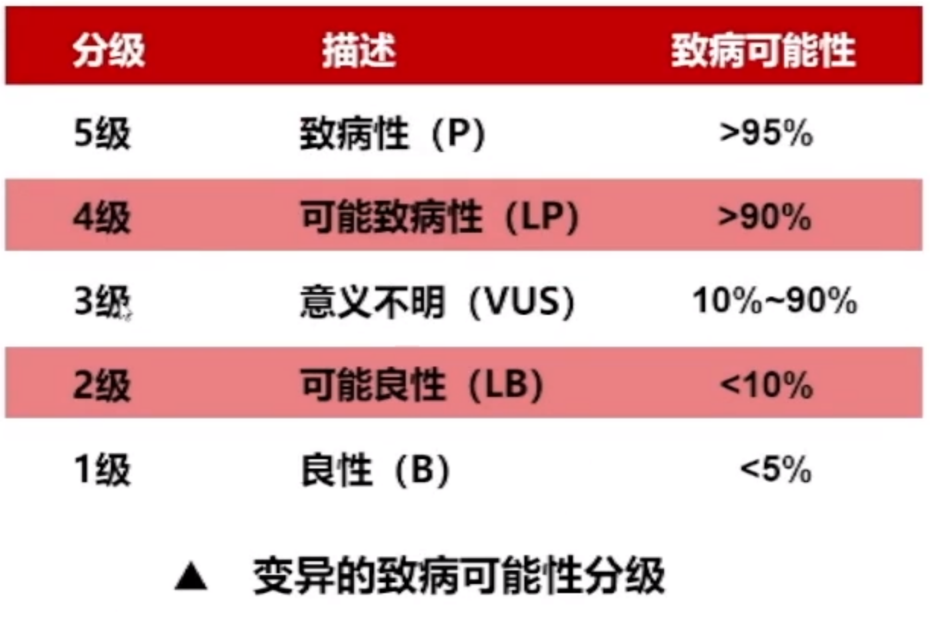
值得注意的是:
-
专业多学科诊所具有足够的临床专业知识或证据,可能将该突变升级或降级为致病或良性。
-
VUS解释的具有强大致病性的家族性突变,可能由于家系内分离作用导致重新被分类为良性。
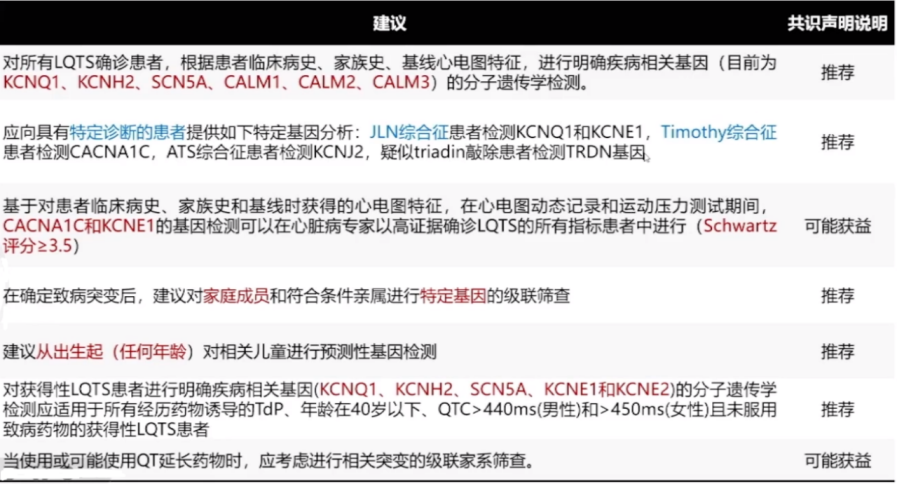
1.LQTS诊断

2.LQTS先证者基因检测
-
对所有LQTS诊断概率高的指标患者,根据患者临床病史、家族史、基线心电图特征,进行明确疾病相关基因(目前为KCNQ1、KCNH2、SCN5A、CALM1、CALM2、CALM3)的分子遗传学检测;
-
特定综合征(JLN综合征、Timothy综合征、ATS、TKOS)中,CACNA1C和KCNE1在LQTS背景下有中度证据,可以考虑在有相应综合征诊断可能的患者中进行该基因检测。
-
对于LQTS概率为中等的患者(如:QTc延长,Schwartz评分1.5-3.0),可考虑对现有基因进行检测。
值得注意的是:部分运动员存在QTc延长,且停止训练后完全可逆。在这些病例中,不应诊断为LQTS。
3.LQTS的家系筛查
-
只要在先证者中发现致病突变,就需要对家庭成员进行级联筛查;
-
疾病的低外显率和表型多变,正常的基线心电图不可轻易排除诊断;
-
早期识别受影响的家庭成员十分重要。同时,要及时制定预防措施;
-
即使在基线 QTc 正常的患者中,也有发生危及生命的心律失常的风险。
4.共识中相关建议
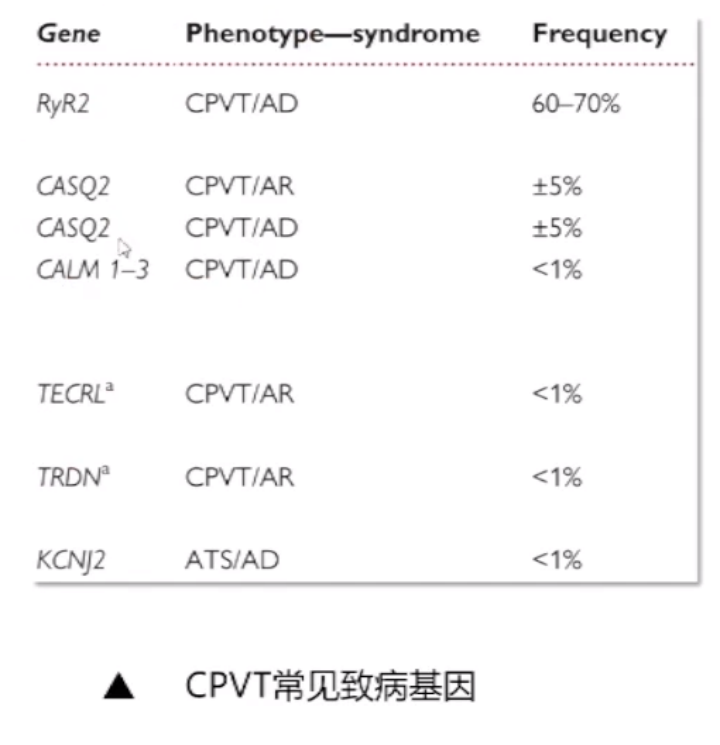
1.CPVT常见致病基因
2.CPVT基因检测的诊断意义
CPVT通常为AD遗传,但也有少部分为AR遗传。与AD相比,AR更为严重。
1. 与LQTS相比,散发性新突变的频率更高,尤其是最常见的CPVT致病基因RYR2(AD)。
2. 其他具有AD遗传模式的基因是3个CALM基因,它们也与LQTS和特发性心室颤动(IVF)有关。
3. 与CPVT相似的一种表型是ATS,由编码Kir2.1内向整流钾通道(IK1)的KCNJ2基因的功能缺失突变引起。
4.PKP2突变型可能在早期阶段表现为一种没有结构改变但伴有肾上腺素介导的心律失常的疾病。
5. 表现为AR遗传的基因突变有CASQ2、TRDN和TECRL。
3.CPVT先证者基因检测
1.基因变异检出率在表型较强的患者中最高(60%);临床表现不典型的患者的检出率要低(15-20%);
2.由于RYR2基因中良性突变率高(略高于3%),导致非典型表现型患者的假阳性结果的可能性有1/6。而表型较强的患者的假阳性结果为1:20。CPVT诊断评分,可以提高CPVT诊断的临床准确性。
3.在CPVT诊断评分为>3.5的患者中,CPVT1(即RYR2介导)的可能性至少为60%。目前基因检测机构几乎将RYR2中的每一个新错义变体都指定为VUS,因此结合这一临床评分可以更准确地帮助医生分析基因测试结果。
应用:临床评分强烈提示CPVT,但RYR2检测结果为VUS患者,医生可将该VUS升级为“可能致病突变(LP)”。
4.CPVT家系筛查
-
在所有CPVT家系中,应对已确定的CPVT致病性突变进行家族特异性的级联筛查;
-
基因型阳性的个体即使无临床症状,即基因型阳性但表型阴性,也可能需要积极治疗;
-
2TRDN和TECRL相关突变的杂合携带者通常无表型,可选者不积极治疗;
-
三分之一的杂合患者符合CPVT的诊断标准,其中一些患者甚至出现心脏骤停或运动相关的晕厥。在这些患者中,可能需要运动试验指导治疗。
5.共识推荐

1.BrS相关致病基因

2.Brs基因检测的诊断意义
-
SCN5A突变占BrS的20%。在具有致病性SCN5A突变的家系中,外显率不完全;
-
BrS中的病例对照GWAS确定了几个常见突变的基因位点。而缺乏SCN5A突变的BrS多为多基因突变。多基因评分(Polygenic scores,PRSBrS)可能基于SCN5A致病突变携带者疾病表达的多样性;
-
其他与BrS有关的基因经ClinGen评估后,多数(SCN5A 除外)致病性一直存在争议。ClinGen并未否认这些基因在BrS病理生理学中的作用,但其强烈反对将这些基因作为BrS的诊断基因。
3.BrS先证者基因检测与家系筛查
-
LP/P SCN5A突变可以帮助确定I型心电图的先证者BrS的诊断,但缺乏SCN5A突变也并不应排除诊断;
-
在药物诱导的I型心电图中,当缺乏临床背景和家族史时,可以考虑进行SCN5A检测,以进行风险预测、管理和家系筛查;
-
当在BrS亲属中发现LP/P的SCN5A突变时,应对家庭成员进行基因检测。携带者采取与BrS相同的预防措施;
-
BrS先证者SCN5A阴性的亲属筛查应在临床上复查心电图。为了预防BrS,可考虑激发性试验,无症状和SCN5A突变的激发试验呈阳性可诊断BrS;
-
BrS与药物诱导的BrS显著相关,证明其在临床实践中的潜力。
4.BrS基因检测的预后和治疗意义
-
具有致SCN5A突变的BrS患者传导异常多见,且预后更差。
-
SCN5A致病突变并不是预防性植入ICD的适应症,出现晕厥等临床危险表现时,应采取积极的治疗措施。
-
在选择可植入设备时,除了基线心电图和心律失常记录外,还应考虑SCN5A致病突变的类型。
5.共识推荐

1.基因检测在CCD/PCCD中的诊断意义
-
CCD/PCCD具有遗传异质性,在大多数CCD家族中表现为AD遗传,而在某些神经肌肉疾病的背景下是X染色体遗传,男性患者多见,隐性遗传则较为罕见;
-
总体和基因特异性突变检出率(敏感性)未知,但在以SCN5A和LMNA为核心突变基因的病例中,致病突变检出率>50%,各占约20%(另有TRPM4占5-10%);
-
在可测序的部分病例中,包括家族聚集性疾病,对相关已知心脏病基因的调查仍然不足以揭示潜在的致病基础,说明新基因突变尚未被发现。
2.CCD/PCCD先证者基因检测
-
在心电图诊断为CCD/PCCD且没有确切病因的证据时,提示遗传因素;
-
年龄小于60岁、原因不明的二度或三度房室传导阻滞患者,需要筛查心脏结节病(使用CMR或正电子发射断层扫描)。进一步的常规检查包括运动心电图、动态心电图和超声心动图,以排外心肌病或CHD;
-
LMNA 致病性突变携带者,可以考虑心脏磁共振成像(钆增强);
-
早发性或特发性的CCD/PCCD应考虑基因检测,特别是家族史具有基因检测适应症时(存在CCD/PCCD、起搏器植入、心肌病等);
-
心脏遗传学已经建立了针对CCD/PCCCD检测的靶向基因组,建议重点检测四种基因:SCN5A、LMNA、GLA和PRKAG2。
-
在有疾病表型的基因检测中鉴定出致病性突变可证实CCD/PCCD的诊断,且有助于将其归类为具有或不具有其他临床特征的遗传(和潜在可遗传的)疾病。
3.CCD/PCCD家系筛查
-
先证者存在CCD/PCCD的LP/P致病基因时,建议对家庭成员进行级联筛查;
-
在对该致病性突变检测呈阴性的亲属中,不需要进一步检查;
-
应仔细评估致病性突变阳性家族成员是否存在与基因突变相关表型的孤立或综合形式的CCD/PCCD;
-
十岁以下的无症状儿童并不需要对其进行遗传筛查。
4.CCD/PCCD基因检测的预后和治疗意义
-
基因型无法对CCD进展的风险进行确切分层,但CCD的不同基因突变可提供预后信息,例如LMNA提示SCD风险;
-
部分基因(例如LMNA、TNNI3K)的致病突变可能与心力衰竭的发展有关;
-
具有LMNA致病性突变的患者还可能会出现房性和室性心律失常以及进行性(终末期)心力衰竭,并且可能需要ICD或心脏移植;
-
SCN5A 致病性突变患者也可能发生BrS,建议避免使用特定延长QT的药物,以减少室性心律失常的发生发展。
5.共识推荐

1.2020室性心律失常中国专家共识SQTS诊断建议:
-
QTc≤340ms可诊断为SQTS
-
QTc≤360ms 伴有以下至少1个条件可诊断为SQTS:
存在致病基因突变;
有SQTS家族史;
有年龄<40 岁猝死的家族史;
发生在无心脏病的室速/室颤幸存者。
诊断时应明确排除导致QT间期缩短的继发性因素,如高 热、高钾血症、高钙血症、酸中毒、交感神经兴奋、洋地黄类药物中毒等因素。
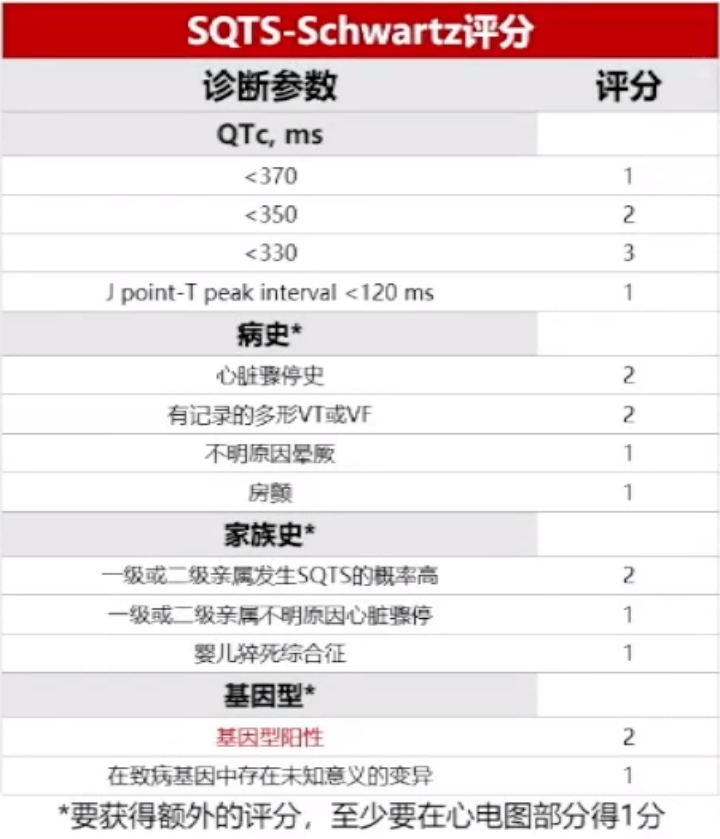
评分≤2时,SQTS概率低
评分为3时SQTS中等概率
评分≥4时,SQTS概率高
2.共识推荐

关于房颤的共识推荐
关于房颤的基因检测推荐仅在该共识中出现。

关于窦房结病变的推荐

关于早期复极综合征推荐

近年来,随着分子遗传学的高速发展,遗传性心血管疾病在基因检测方面取得了显著的进展,基因检测已被推荐用于许多遗传性心脏疾病的诊断,在诊断精度、治疗选择和评估预后方面优势明显。
洪葵教授对于2022共识的解读,让我们对于目前基因检测的现状、遗传性心律失常的检测方法有了详细的了解,对于临床基因检测工作有重要的指导意义。
随着基因治疗领域的不断发展,未来可能会实现患者致病变异位点特异性治疗,使遗传性心血管疾病诊疗迈向新阶段。
专家简介

医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动