病例分享:先天性心脏病经导管主动脉瓣置换术

在过去十年里,经导管主动脉瓣置换术(TAVR)的应用发生了巨大的变化,如今已覆盖了手术风险从高到低的广泛患者群体。先天性心脏病(CHD)通常涉及主动脉瓣(AV)、二叶式主动脉瓣等独立病变或肖恩综合征等复杂缺陷,可能需要一生进行多次手术干预。由于年龄较小且复杂性增加,CHD患者被排除在TAVR试验之外。尽管TAVR在年轻人中的使用逐渐增加,但对于CHD人群而言,在更广泛范围内应用该技术仍缺乏相关结果数据支持。最近发布了儿科先天性人群中使用TAVR进行治疗的病例报告证明了其在CHD领域的潜力。基于此,JACC:Case Reports中发表的一篇病例分享描述了6例不同CHD成年患者接受TAVR的单中心经验,以期为TAVR在CHD领域的应用提供补充和参考。

男性,43岁,患有法洛四联症,总共接受了5次手术,其中4次是开胸心脏手术,以及2次经皮介入治疗:右侧经典Blalock-Taussig-Thomas(RBTT)分流术;法乐氏四联症完整修复术;右心室流出道导管和三尖瓣置换术;三尖瓣和主动脉瓣重新置换术(分别使用33mm生物瓣膜和27mm生物瓣膜);经导管肺动脉瓣置换术 (TPVR,使用22mm牛颈静脉瓣膜);以及植入治疗室性心动过速的植入式心脏复律除颤器。
该患者患有右心室衰竭、左心室(LV)舒张功能障碍、肝硬化伴门静脉高压和腹水、消化道出血、严重限制性肺疾病及心肝肾疾病。既往患有肺动脉瓣人工瓣膜心内膜炎,考虑到手术风险,使用抗生素以及姑息性TPVR治疗。患者出现了三尖瓣和主动脉瓣人工瓣膜功能障碍和双心室衰竭。经胸超声心动图(TTE)和经食管超声心动图(TEE)提示重度人工主动脉瓣关闭不全(AR)和主动脉瓣狭窄(AS)(峰值压差为74mmHg,平均压差为34mmHg),以及重度TR。考虑到患者复发性心内膜炎的风险高,经过多学科治疗团队讨论,决定在移植前的过渡阶段,先采用瓣中瓣(ViV)TAVR和经导管三尖瓣置换术(TTVR)进行优化,后进行心脏和肝脏移植评估。
在全身麻醉和无菌条件下进行手术。使用超声引导下的微穿刺技术获得血管通路。术前给予抗生素。鉴于患者有右侧经典Blalock-Taussig-Thomas分流术史,以及右侧股动脉 (RFA) 和双侧股静脉闭塞,无法使用脑栓塞保护装置。ViV TTVR入路为右侧颈内静脉,左侧颈内静脉作为静脉入路,左侧股动脉用于ViV TAVR操作,左侧尺动脉用于动脉监测。
术中采用26mm球囊扩张式(BE)牛心包瓣膜(SAPIEN S3,Edwards Lifesciences)进行ViV TAVR,并使用鳄鱼夹连接LV中硬弯曲导线进行起搏。采用24mm球囊进行后扩张。最终血管造影显示AR微量。随后进行了TTVR。术后TTE显示无AR,平均压差为5mmHg;无TR,平均压差为3mmHg。
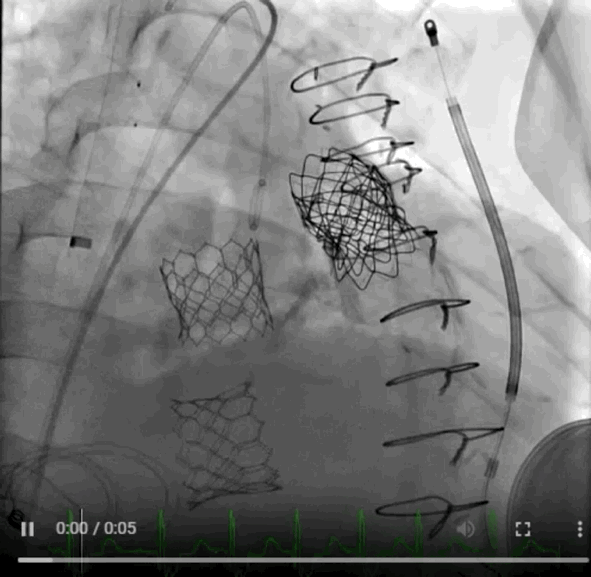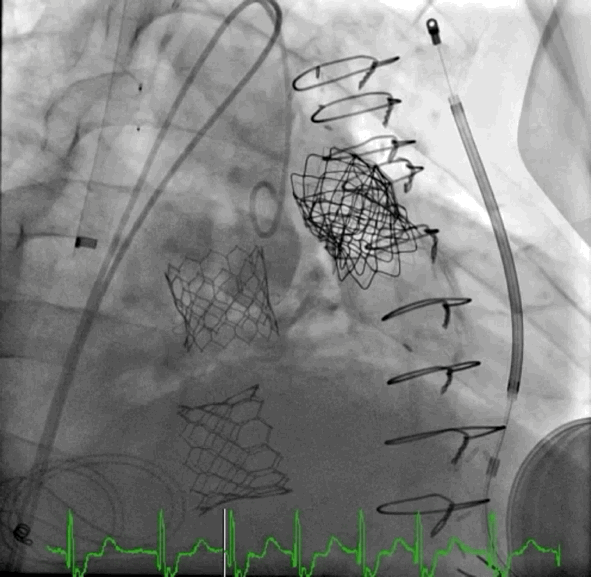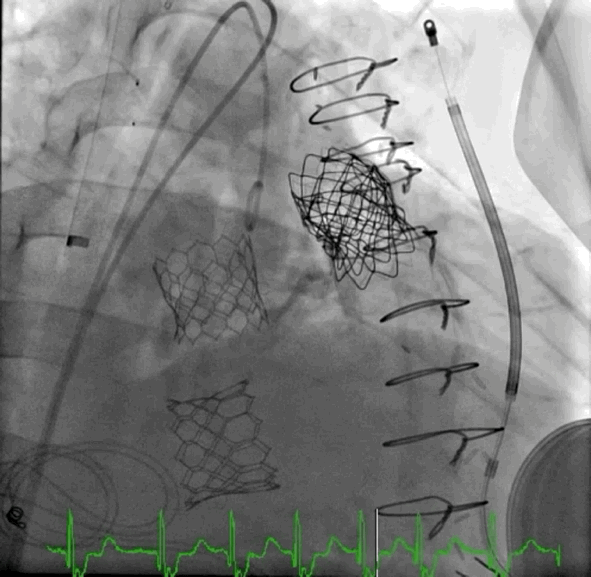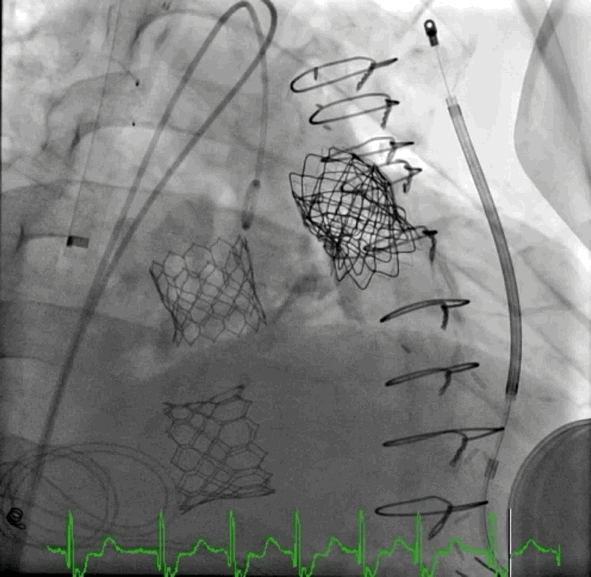
动图1 植入后血管造影
12个月后,TTE显示微量至轻度AR,峰值压差/平均压差为26/13mmHg。患者的临床症状明显改善,并接受了心脏和肝脏移植手术。
女性,40岁,患有房室间隔缺损(AVSD)、二尖瓣裂开并MR以及升主动脉狭窄。接受了5次开胸心脏手术:AVSD修复和二尖瓣修复、主动脉瓣下切除、Konno手术、二尖瓣生物瓣置换术和二尖瓣机械瓣置换术。
患者病史复杂,包括肝硬化、未接受药物治疗的瓣膜赘生物菌血症、依赖起搏器的心脏传导阻滞以及房性心律失常。出现心力衰竭症状,功能逐渐下降。TTE和TEE提示,自Konno手术以来,双心室收缩功能轻度降低,重度AR无进展。
经过多学科团队讨论,考虑患者手术风险很高,选择TAVR来改善功能,并为将来手术做准备。考虑到患者为主动脉瓣膜未钙化,瓣环周长70mm,瓣环直径21mm,选择26mm自膨式瓣膜(SE)。
该病例的手术方式与病例1类似,但采用股动脉入路。在RFA中使用8-F用于瓣膜植入,5-F导管用于动脉通路,在右股静脉中使用8-F用于静脉通路和起搏,在右桡动脉鞘中使用6-F用于脑栓塞保护。放置一个猪尾导管在非冠状动脉瓣上,并将起搏器放置在右心室中。血流动力学显示左心室舒张末压为20mmHg,主动脉舒张压为42mmHg。成功部署了一个26mmSE瓣膜,主动脉舒张压增加至60mmHg。
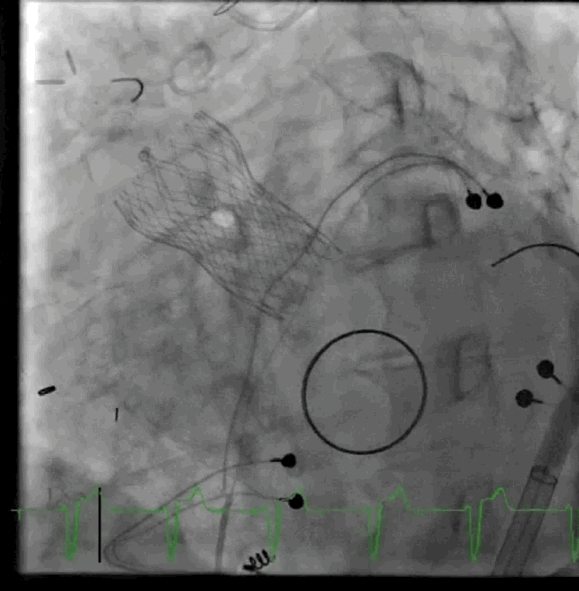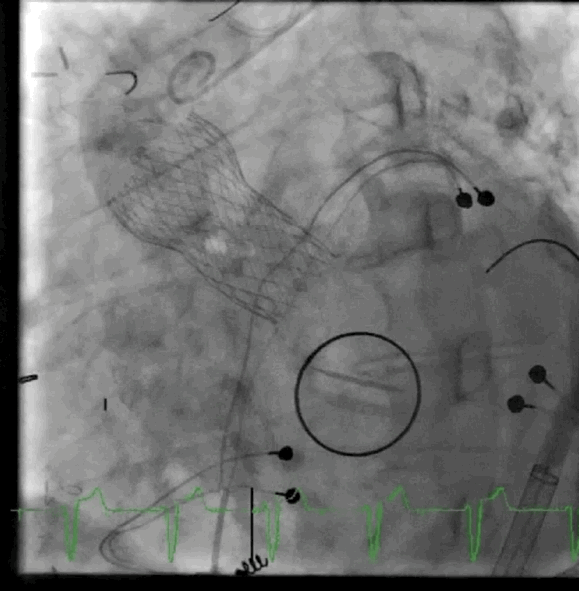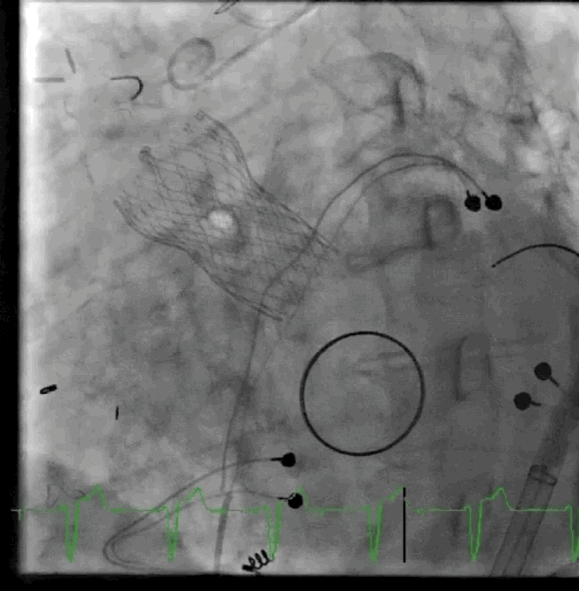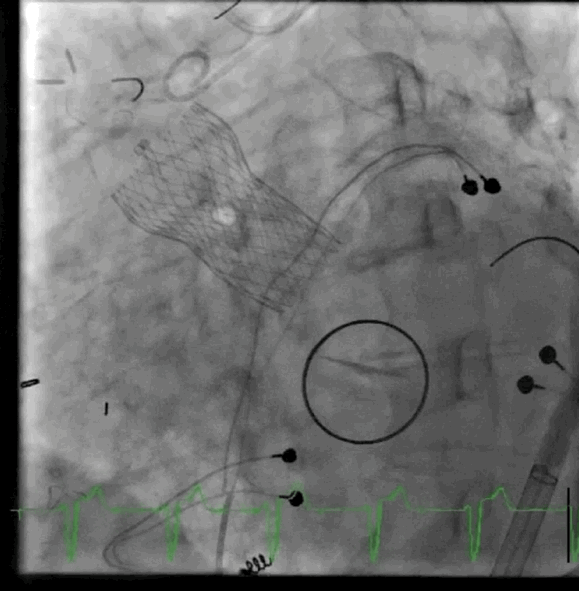
动图2 植入后血管造影
3个月后,TTE显示无AR和瓣周漏。AV峰值压差/平均压差为 17/9mmHg。患者恢复日常活动。
男性,29岁,D型大动脉转位和室间隔缺损,接受了3次开胸心脏手术:大动脉转位手术、再次neo-AV修复术和主动脉置换术(使用25mm牛心包瓣膜)。
患者失访,10年后出现心力衰竭和严重的AS,峰值压差/平均压差为125/90mmHg,新发左心室功能障碍,射血分数为20%。
该患者的治疗方式与病例2类似。患者接受了ViV TAVR,采用26mm BE牛心包瓣膜 (SAPIEN S3)。术后主动脉压差从90mmHg降至0mmHg(动图3)。
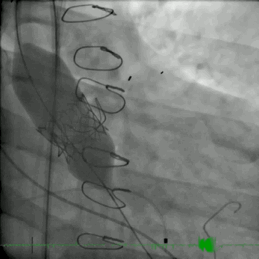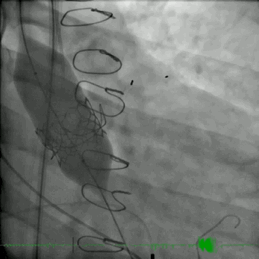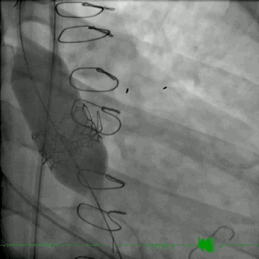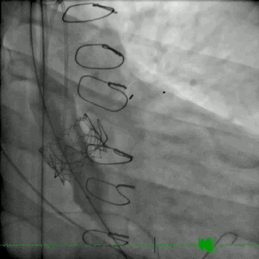
动图3 TAVR植入后血管成形术
3个月随访时,TTE显示AV峰值压差/平均压差为23/13mmHg,通过药物治疗左心室射血分数提高至50%。
男性,47岁,患有法洛四联症,共接受了5次开胸心脏手术:右侧经典Blalock-Taussig-Thomas分流术;法乐氏四联症完整修复术;AV修复和肺动脉瓣置换术;再次主动脉瓣和肺动脉瓣置换术;再次27mm主动脉瓣置换、24mm肺动脉瓣置换术和二尖瓣修复术;以及TPVR。
表现为有症状的中度至重度主动脉狭窄,TTE提示AV峰值压差/平均压差为51/30mmHg,DI为0.24,无AR,左室功能轻度降低(LVEF为50%),人工肺动脉瓣功能良好。经过多学科讨论,决定进行ViV TAVR,作为未来手术的过渡,以使主动脉瓣和肺动脉瓣在未来的手术中均可处理。
该病例的手术方式与病例2类似。选择26mm BE牛心包瓣膜 (SAPIEN S3),成功在额定容量下植入,并用24mm球囊在14个大气压下进行后扩张(动图4)。
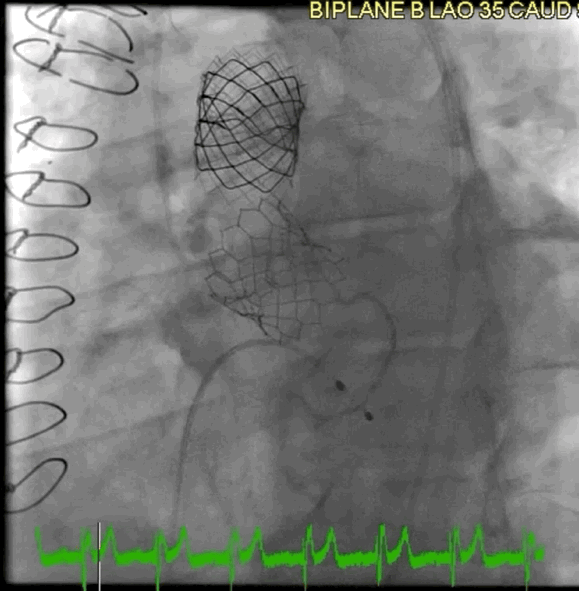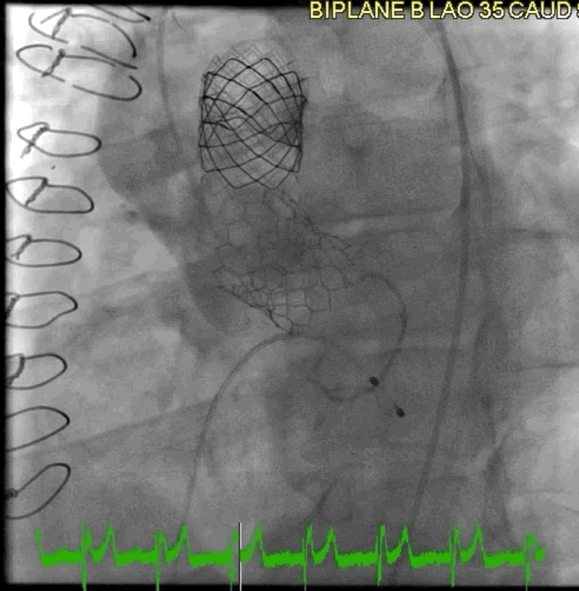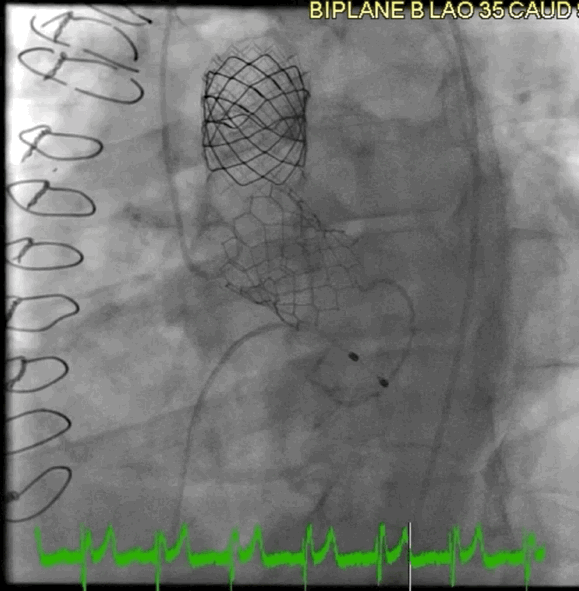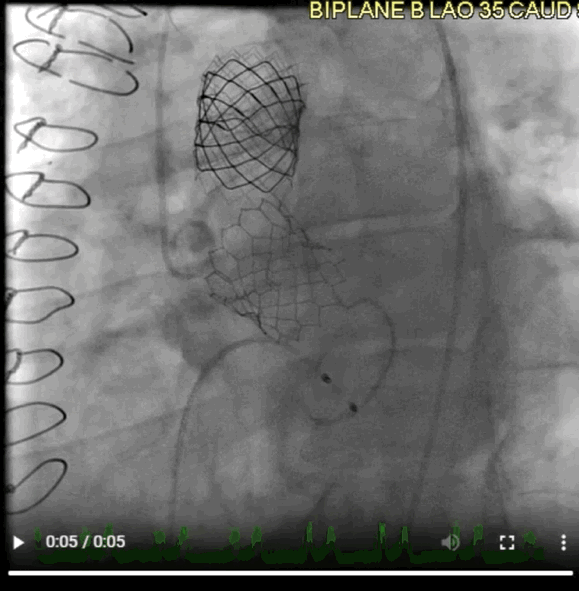
动图4 植入后血管造影
术后超声心动图显示,峰值压差/平均压差为27/16mmHg,无AR。3个月和6个月时,TTE显示瓣膜功能稳定,峰值压差/平均压差为25/12mmHg,DI为0.6。患者自述症状缓解,并恢复了私人教练的工作。
女性,25岁,患有二叶式主动脉瓣、慢性免疫性血小板减少性紫癜、严重特发性原发性肺动脉高压以及肝功能衰竭(需肝移植)。出现了呼吸困难和先兆晕厥。TTE提示中度至重度AS,峰值压差/平均压差为62/38mmHg,DI为0.27。采用球囊瓣膜成形术将主动脉瓣跨瓣压差从43mmHg降低至22mmHg,改善了症状,但术后9个月内出现了严重的AS复发。
经过多学科讨论,选择TAVR来治疗二叶式主动脉瓣狭窄。考虑到较高的SE支架可能会粘附在升主动脉壁上,需要进一步解剖并修复或置换,因此选择较短的BE支架。患者的主动脉瓣环不是明显的椭圆形(约19*23mm),瓣周漏的风险也不是主要问题。
该病例的手术方式与病例2类似。成功地在额定容量下部署了一个23mm的BE牛心包瓣膜(SAPIEN S3),并在额定体积上进行了后扩张(动图5a、5b )。
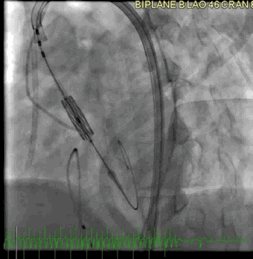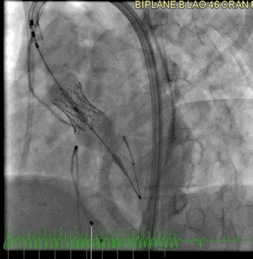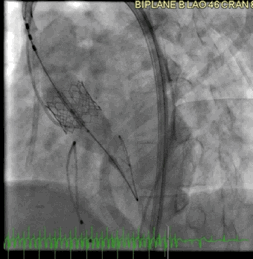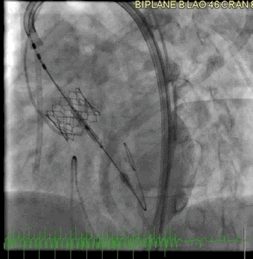
动图5a TAVR瓣膜部署
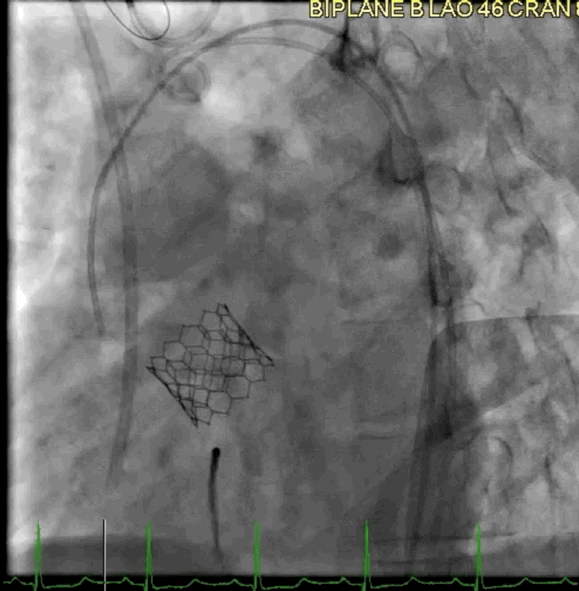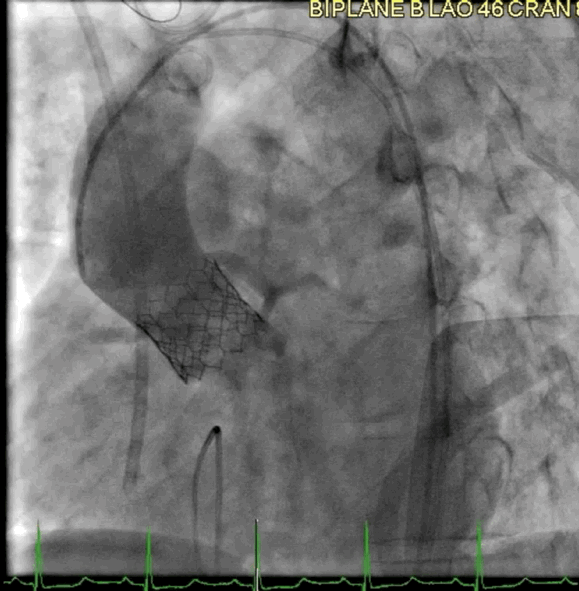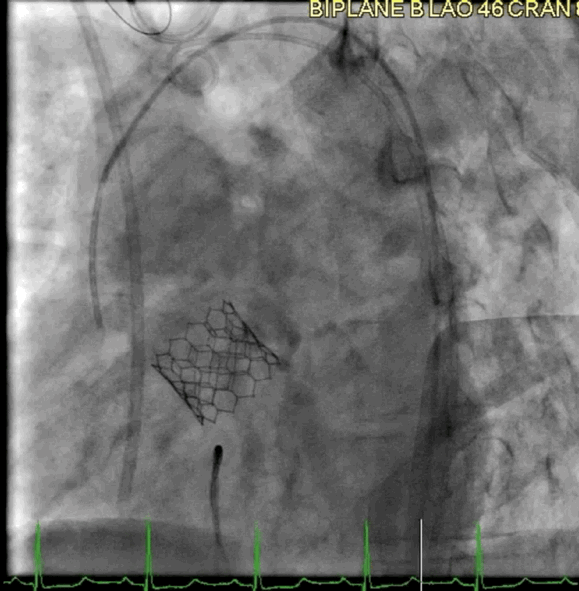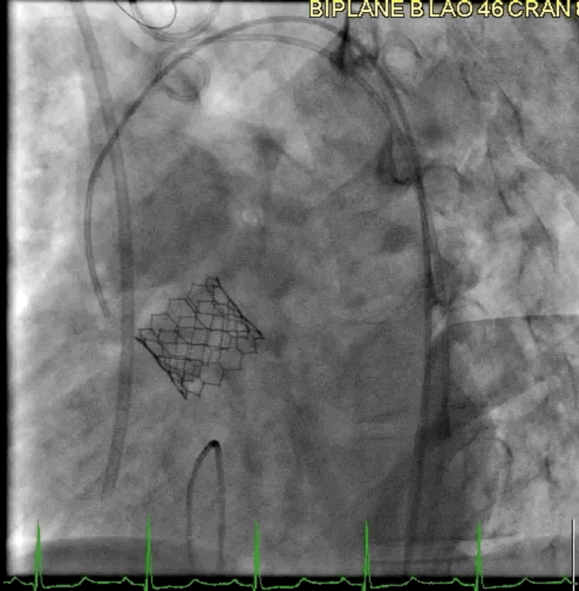
动图5b 植入后血管造影
9个月随访时,TTE显示峰值压差/平均压差为23/11mmHg,DI为0.45,无AR,症状缓解。
男性,49岁,患有Shone综合征,伴二叶式主动脉瓣、室间隔膜和主动脉缩窄。接受过5次开胸心脏手术:AV修复、主动脉缩窄修复、再次AV修复、主动脉和肺动脉同种移植以及再次主动脉和肺动脉同种移植置换。曾接受了肺动脉覆膜支架置入术和TPVR,以解决升主动脉和肺动脉之间瘘管连接导致的严重肺动脉高压(肺动脉平均压从62降至23mmHg)。
两年后,突发呼吸困难和容量超负荷。TEE提示同种移植物严重钙化,重度AR,瓣膜破裂,无AS(峰值压差/平均压差为27/16mmHg),左室功能轻度降低。经过多学科讨论,选择TAVR来缓解其症状,并作为未来手术(处理AV和肺静脉生物瓣膜问题)的过渡。尽管主要的病理变化是AR,但考虑到同种移植物钙化严重,SE和BE瓣膜支架均可选择。根据瓣环直径22.5mm和面积396mm2,选择 23mmBE瓣膜 .
该病例的手术方式与病例2类似。通过股动脉途径,成功植入23mm BE牛心包瓣膜 (SAPIEN S3)。术后,AV 峰值压差/平均压差为10/6mmHg,无AR(动图6a、6b)。
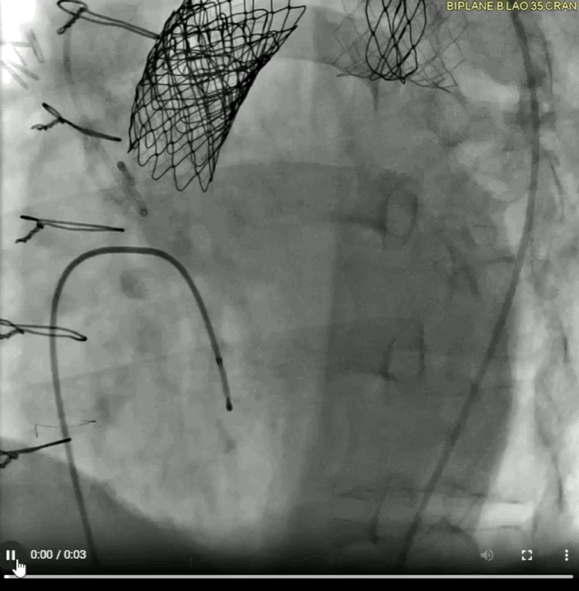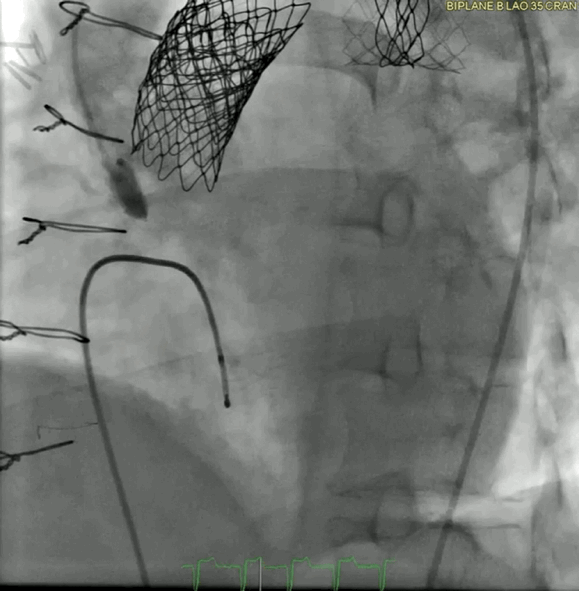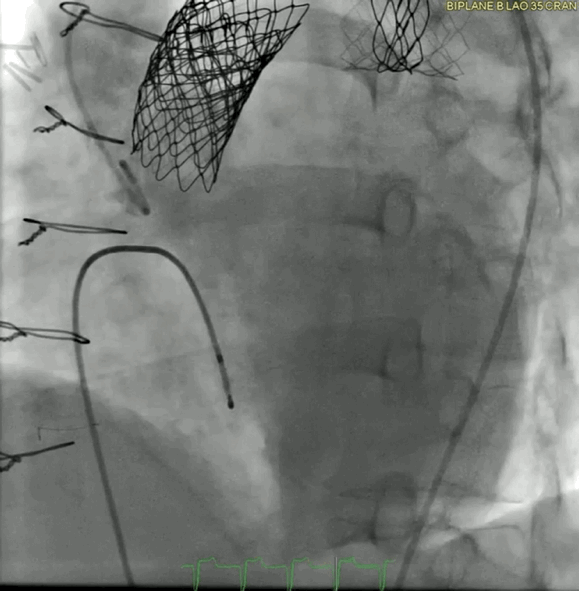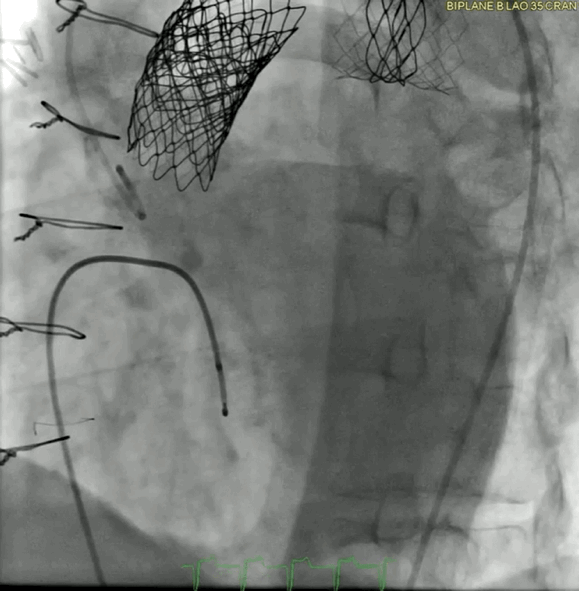
动图6a 术前血管造影

动图6b TAVR植入后血管造影
6 个月随访时,TTE提示LVEF稳定在45%,AV峰值压差/平均压差为24/13mmHg,DI为0.42,症状缓解(图1)。
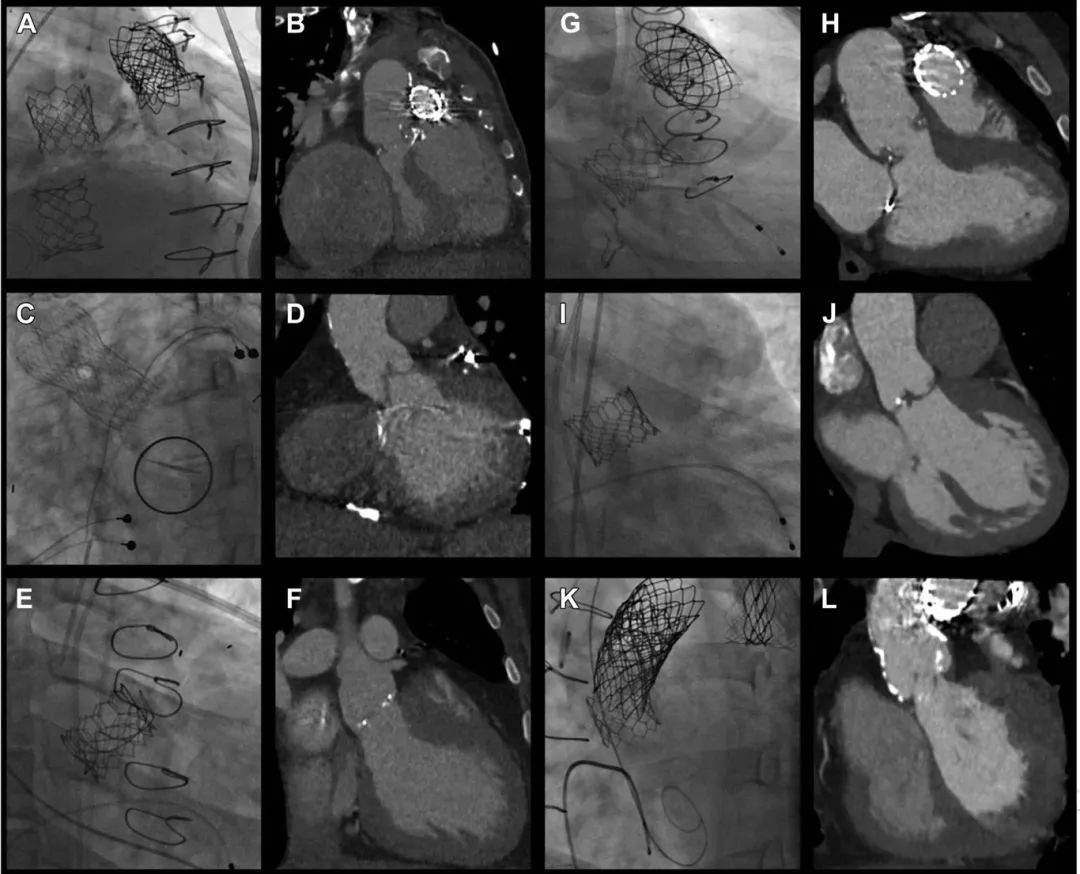
图1 计算机断层扫描和透视
(A)病例1 ViV TAVR、ViV 经导管三尖瓣置换术和TPVR 的X线透视;(B)病例1术前计算机断层扫描血管造影 (CTA) 右心房/右心室扩张;(C)病例2 TAVR透视和二尖瓣机械瓣膜置换术;(D)病例2术前CTA显示自体三尖瓣未钙化。(E)病例3 ViV TAVR的X线透视;(F)病例3术前CTA显示手术主动脉瓣置换术、LeCompte术后升主动脉周围的肺动脉分支;(G)病例4 ViV TAVR和TPVR的X线透视;(H)案例4术前CTA检查;(I)病例5二叶式主动脉瓣TAVR的透视检查;(J)病例5术前CTA显示二叶式主动脉瓣叶增厚并伴微小钙化,肺动脉扩张;(K)病例6同种瓣膜移植物TAVR、TPVR和左肺动脉支架的透视检查;(L) 病例6术前CTA显示主动脉同种移植物和肺动脉覆膜支架重度钙化。
讨论
在以上针对CHD进行TAVR的6例病例中,患者平均年龄为38岁,开胸心脏手术中位次数为4次。所有患者的手术风险均很高或难以承受。尽管存在解剖和入路方面的挑战,所有患者都安全接受了TAVR,且未出现急性并发症。重要的是,所有患者的血流动力学均得到显著改善且可接受,术后无或轻度AR,平均主动脉峰值压差为11mmHg。与先心病专家和心脏团队进行多学科讨论对于解决每位患者的不同疾病特征至关重要(图 2)。

图2 先天性TAVR独特特征
CHD患者具有复杂的解剖结构,既往多次胸骨切开术、伴有疤痕和粘连,使得手术入路具有挑战性,这增加了术中和术后心血管、肺部和神经系统并发症的风险。TAVR是一种微创手术,可降低再次开胸手术的风险,可以成为CHD患者终生管理AV疾病的重要工具。重要的是,对于等待移植的CHD患者,TAVR可以改善患者的功能,延长患者的生存期,同时不会增加手术风险。该领域迫切需要创新,特别是开发适合CHD患者需求的支架,例如自体或纯AR同种异体移植(图2)。对于年轻的先天性患者,存在长期耐久性的相关担忧。为了进一步了解TAVR在CHD患者中的中远期疗效和持久性,需要进行更大队列的前瞻性试验。
结论
在特定的临床情况下,TAVR可以成为CHD的有效干预措施,在这个小型病例系列中证明了TAVR既具备可行性又安全,并取得了良好的短期治疗效果。在手术风险较高的情况下,TAVR可以作为恢复、未来手术、移植或姑息治疗之间的桥梁。急需开展针对CHD患者TAVR治疗的大规模前瞻性临床试验。
原文链接:
https://www.jacc.org/doi/10.1016/j.jaccas.2023.102199
- End -
关注我们
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。

发表留言
暂无留言
输入您的留言参与专家互动