JASE前沿综述│肥厚型心肌病的梗阻性:多方面因素

肥厚型心肌病(HCM)是最常见的遗传性心肌病,具有复杂的表型和基因表达。即使在单个HCM家族谱系中,临床、解剖、血流动力学和心律失常上的表型也可能存在巨大的差异。分子基础上,肌动蛋白-肌球蛋白相互作用增强导致心肌过度收缩和同时舒张功能受损。过度剪切力和异常超负荷条件的下游问题构成了病理性肥大发展的一种机制。肥厚经常不对称,累及室间隔,但也可发生在任何类型。二尖瓣(MV)异常相对常见,包括乳头肌肥大或移位,腱索附着异常同时瓣叶过度前移,二尖瓣前叶的冗长。75%的HCM患者在静息或激发动作后存在左心室流出道(LVOT)梗阻。识别不同的HCM梗阻性表型(动态LVOT梗阻,左室中部梗阻[MVO],合并LVOT梗阻和MVO)以及易发生梗阻的解剖异常具有管理意义。TTE仍然是初始诊断、无创血流动力学评估、药理学和室间隔减容治疗(septal reduction therapy)监测的首选影像学检查,并与心脏磁共振成像(CMR)一起,在确定HCM的心源性猝死风险方面具有预后作用。
多种不同条件可能模仿了HCM在TTE上的表型。表型包括超生理的左室肥大(LVH),如运动员心脏,心脏后负荷增加(高血压心脏病、固定性的主动脉瓣下狭窄、瓣膜性主动脉狭窄、主动脉瓣上隔膜),储存障碍如法布里(Fabry)心肌病以及浸润性疾病,浸润性疾病最常见的是心脏淀粉样变。运动员心脏中,LVH通常是对称的,很少超过14mm,且通常不会导致SAM或LVOT阻塞。7高血压性心脏病可导致收缩期向前运动(SAM)和LVOT梗阻。高血压心脏病可导致与室间隔膨出相关的SAM和LVOT梗阻,特别是高血压严重、长期存在且未经治疗。提示高血压心脏病的一个特征是在收缩期末出现SAM,这种现象被称为“伪”SAM征。老年患者可表现为明显的室间隔基底段凸起,易导致LVOT梗阻,特别是在深度后凸的情况下,这加剧了左室流出道-主动脉成角。虽然在这种情况下局限性LVH的程度通常是轻微的,但区分老年性室间隔基底段隆起和HCM需要临床背景。对这种情况下的梗阻治疗方法与HCM的动态左心室梗阻相似,主要集中在生活方式的改变,避免不必要的前负荷或后负荷降低,以及谨慎性使用β受体-阻滞剂。
HCM动态梗阻的机制是一个复杂的相互作用,包括二尖瓣(MV)和瓣下装置异常,室间隔肥厚,LVOT狭窄,以及陡峭和/或流出道-前间隔成角。大约1/3的HCM患者在静息时就存在流出道梗阻。大多数患者收缩期左室压差仅在体力消耗或改变负荷条件的动作时引出。根据梗阻程度对HCM进行分类:(1)静息时梗阻(LVOT压差≥30 mmHg),(2)隐匿性梗阻(静息时<30mmHg,诱发时≥30 mmHg),(3)非梗阻性(静息时<30 mmHg,诱发时<30mmHg)。矢量血流图已经阐明了二尖瓣装置异常促进动态LVOT梗阻的机制是通过心室收缩期拖拽血流在MV上,而不是抬高血流(Venturi效应),如下面插图。
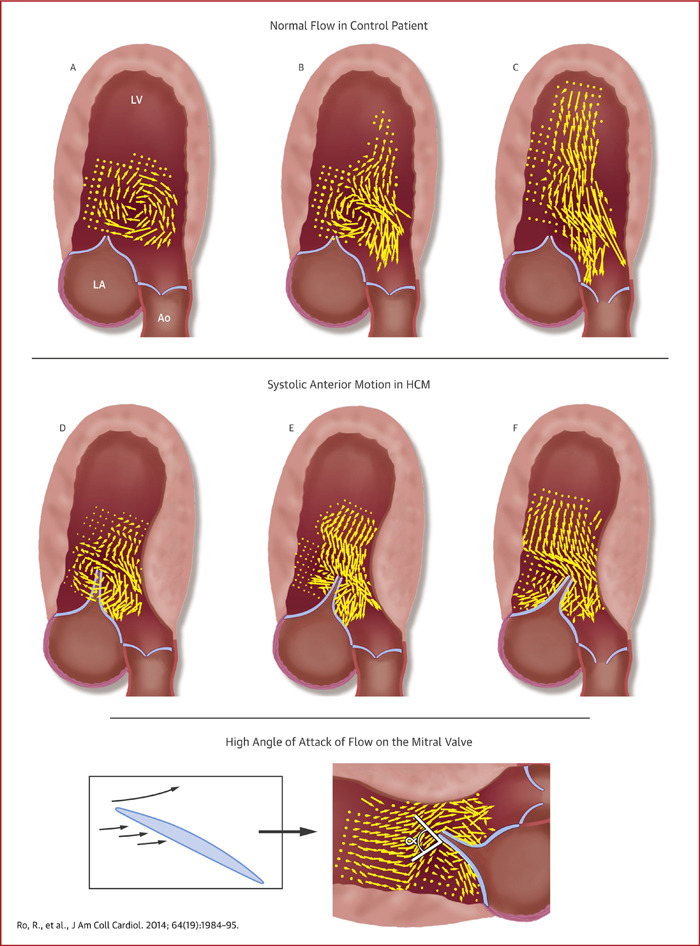
拖拽血流使具有较大表面积的前叶出现构象改变,导致二尖瓣叶向室间隔靠近和动态LVOT阻塞。SAM通常始于收缩早期,肥厚的隔膜将收缩期早期的低速血流重新定位至MV下方,并将MV移至前方,从而否定了Venturi效应作为引发SAM征介导的LVOT梗阻的主导作用。随着SAM的进展,LVOT逐渐变窄,加重LVOT阻塞,进而加重SAM。LVOT梗阻的严重程度常通过连续波多普勒(CWD)衍生的瞬时峰值压差来评估(图1A)。
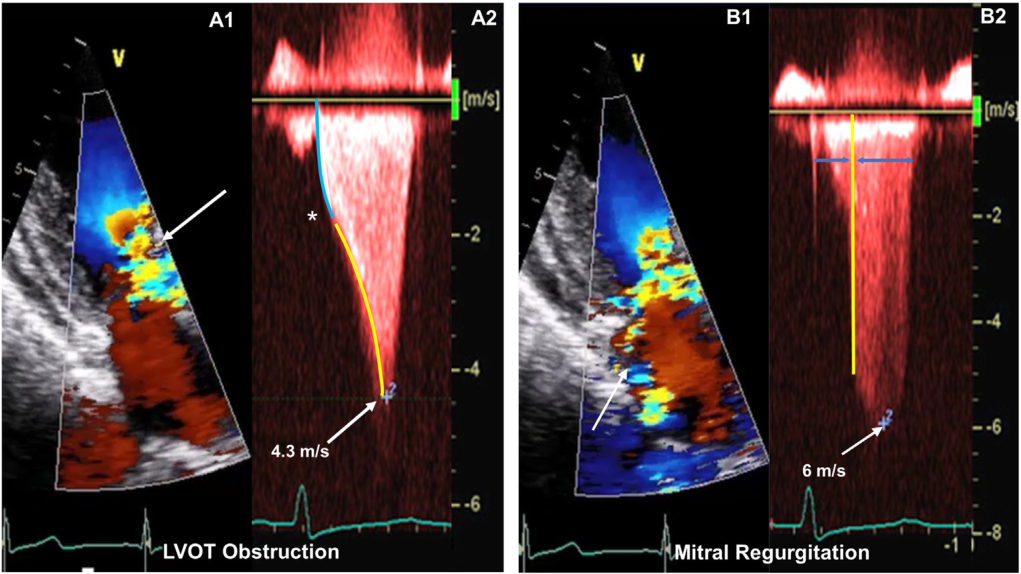
图1彩色血流多普勒显示LVOT阻塞部位呈现混叠(A1,箭头所示)。随着SAM征在收缩期加剧,CWD轮廓转为凹形(A2,箭头所示)。经典”SAM”介导的二尖瓣反流(MR)束朝向后方(B1,箭头所示),收缩中晚期CWD峰速加快(B2,箭头所示)。
SAM和相关的MR涉及不同的机制,包括异常拉长或肥大的乳头肌,腱索增厚或伸长,异常的乳头肌直接插入MV瓣叶,二尖瓣帐篷容积增加,短小或增厚的瓣叶,MV脱垂,腱索断裂。通常,MV的前后叶在收缩期中期不能对合,因为前叶向LVOT向上和向前运动,形成一个漏斗,引导MR穿过瓣叶间隙向后射出。静息性LVOT阻塞的程度已被证明与SAM相关的MR程度成正比。与LVOT梗阻的CWD轮廓相比,SAM介导的MR的轮廓更圆,速度更高,后者反映了更高的左室-左房梯度(图1B)。在MV瓣叶和乳头肌的解剖异常导致的没有LVH的情况下,也可发生动态LVOT梗阻,这对手术和预后有影响。二尖瓣环钙化也可能导致二尖瓣叶运动受限,导致MV向前移位,进一步诱发LVOT梗阻。原发性MV病变可能与SAM共存,通常导致非向后的定向MR射流,当TTE评估MR机制不确定时,经食管超声心动图(TEE)通常是有帮助的。
M-型由于其优越的时间分辨率,仍然是评估梗阻的有价值的超声心动图工具。胸骨旁长轴位的M型可以评估主动脉瓣的收缩中期切迹,反映了收缩期早期左室每搏容量的快速射出,随后在阻塞期每搏容量的衰减(图2A)。收缩期前向运动与室间隔接触时间与左室梗阻的严重程度相关。SAM的程度可分为:(1)轻度(二尖瓣前叶-室间隔距离>10 mm),(2)中度(二尖瓣前叶-室间隔距离≤10 mm或二尖瓣前叶-室间隔接触持续时间<收缩期的1/ 3),(3)重度(前叶-室间隔接触时间延长;≥超声心动图收缩期1/3)。彩色M型还提供了高精度的动态梗阻定位和定时,并在我们实践中经常使用到(图2B)。连续波多普勒对于区分固定性梗阻(主动脉瓣狭窄/瓣下隔膜)和动态LVOT梗阻至关重要,因为治疗方法不同。动态阻塞将导致CWD呈喷射样,开始于收缩早期和后期峰值呈凹型加速曲线,通常被称为“匕首形”。固定性阻塞CWD梯度在收缩期早-中期达到峰值,轮廓更圆润。梯度>60mmHg可能导致“龙虾爪”图案(图3A)。这一独特的多普勒曲线反映了由于动态LVOT梗阻部位下游阻抗增加,左室腔内心顶至底部血流在收缩中期下降。胸主动脉脉波多普勒显示双峰轮廓(图3B),与有创主动脉压示像中的尖峰-圆顶和严重动态LVOT梗阻患者的双裂外周脉冲相关(图3C)。
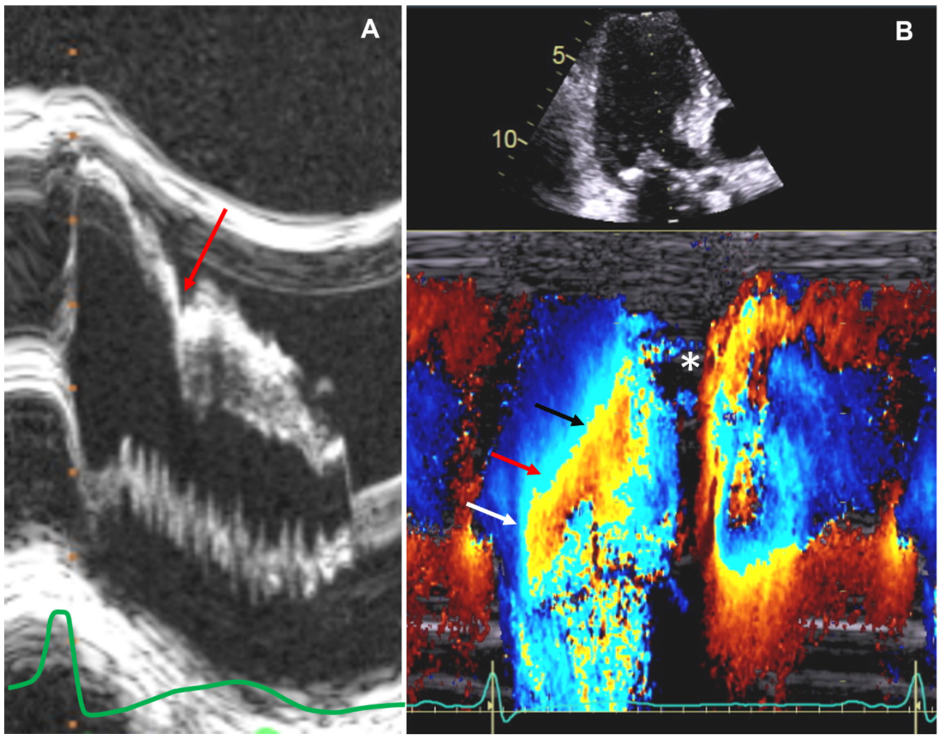
图2主动脉瓣M型显示梗阻性血流动力学特征(A)的瓣叶颤动和收缩中期切迹(红色箭头)。彩色M型(B)提示梗阻性血流动力学的时间和位置。
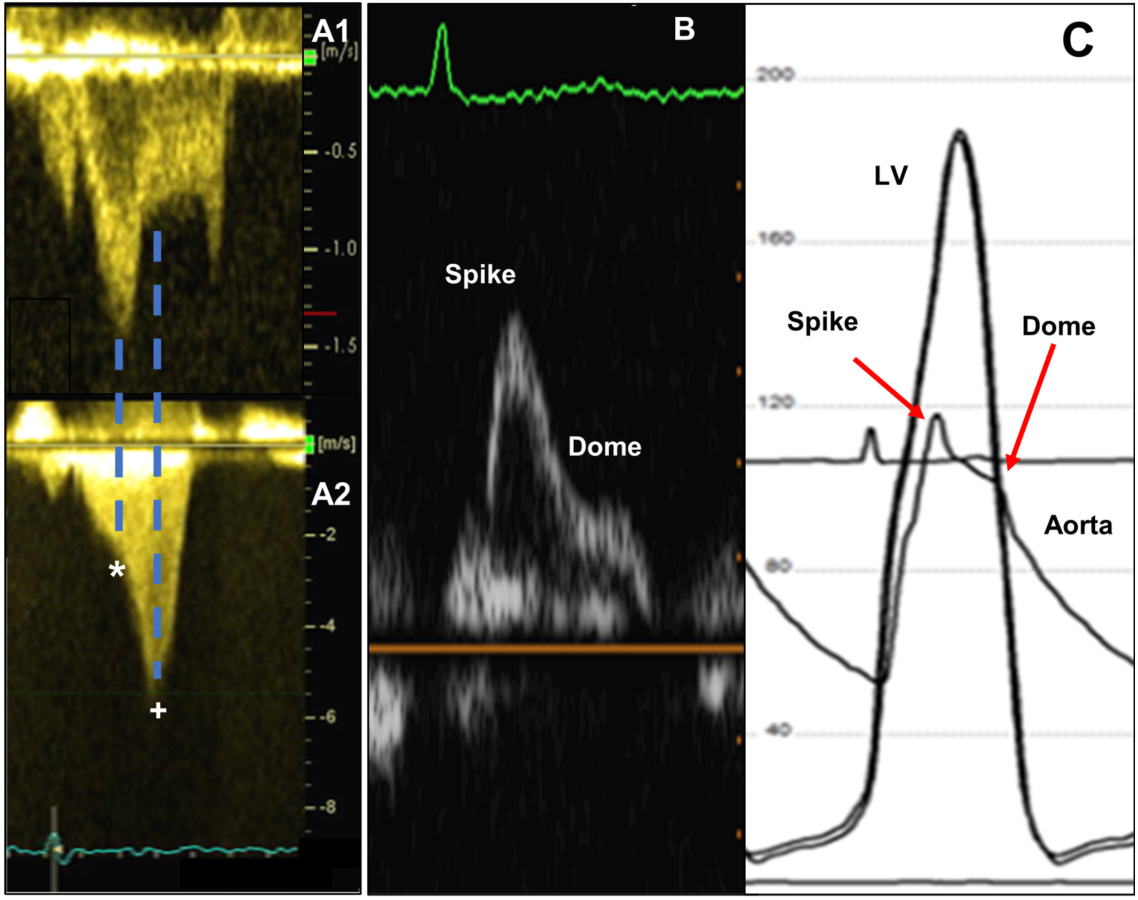
图3 严重LVOT梗阻部位近端收缩期血流的脉冲波多普勒显示双轮廓(龙虾爪现象)(A1)。近端血流速度快速下降,这与LVOT CWD拐点(*)和LVOT动态梗阻的发生(A2)一致。具有双峰轮廓的脉冲波多普勒在腹主动脉(B)和主动脉压力追踪(C)的尖峰(箭头)等同于严重动态LVOT梗阻患者的外周脉冲。
肥厚型心肌病合并MVO是HCM的一个重要亚型,需要识别,因为它可能导致难治性症状,并与室性心律失常、死亡率、LV室壁瘤伴或不伴血栓的风险增加相关。左室中部梗阻通常与中腔运动过度有关,导致中隔肥大和乳头状肌肥大,与MV的SAM不同(图4A)。彩色血流多普勒显示左室腔中部水平湍流,CWD通常描绘狭窄,收缩速度峰值较晚(“冰锥”外观;图4B)有创血流动力学评估(图4C)和直接手术可视化(图4D)可能提供临床有用的相关性。MVO和心尖室壁瘤的同时合并(图5A)导致明显的多普勒特征,通常类似于尖牙的峰谱,这在任何其他情况下都没有见过(图5B)。
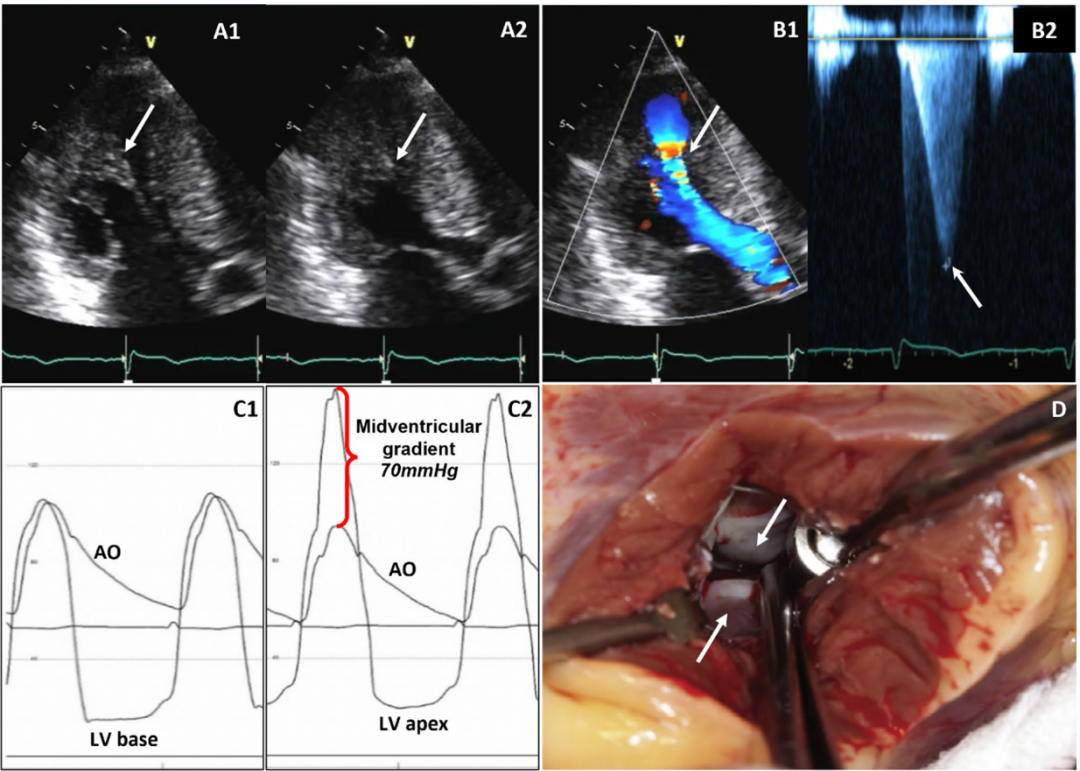
图4左室中部梗阻由突出的乳头状肌引起(A1,箭头),在收缩期毗邻肥厚的肌束(A2,箭头)。彩色血流多普勒显示左室中部(B1,箭头)出现混叠(湍流),对应于高射流速的CWD信号(B2,箭头)。侵入性血流动力学未显示左室基底和主动脉(AO)之间有压差(C1)。然而,在将导管重新定位到远端乳头肌(C2)后,现在可以看到左室顶部和基底部之间的压差(红色框架)。患者通过经心尖入路行室间隔心肌切除术,可以更好地观察左室节段和足够的切除深度。直接观察接触性纤维化(D,箭头)。
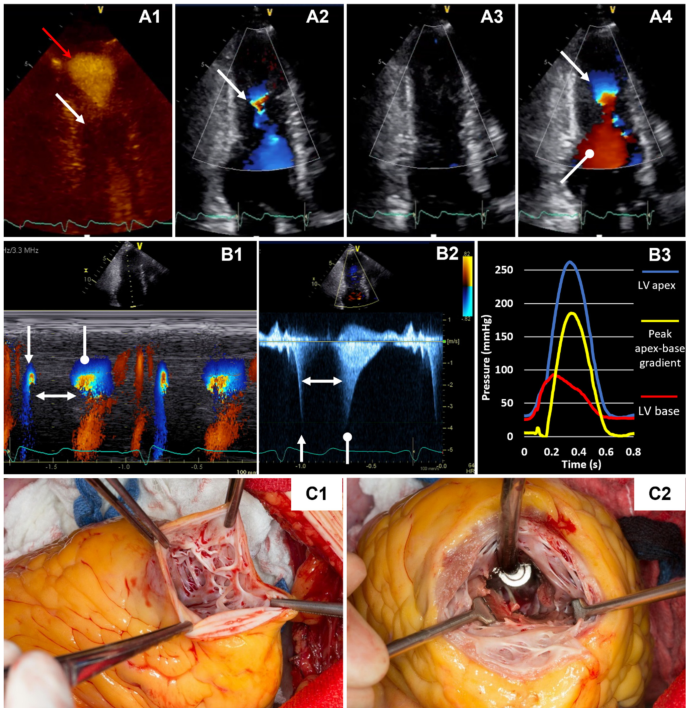
图5二维超声心动图显示心室中部肥厚(A1,白色箭头)和无血栓的心尖部室壁瘤(A1,红色箭头)。彩色血流多普勒显示在收缩早期时心室中部射流加速(A2,闭合箭头),随后在收缩中晚期时室壁血流完全停止(A3)。在舒张期早期(A4),从顶端开始的矛盾正向血流再次出现(闭合箭头),与早期二尖瓣流入血流发生碰撞(圆头箭头)。彩色M型(B1)显示了早期收缩期心尖部正向血流(闭合箭头)和中腔闭塞(双头箭头),随后是矛盾的舒张期正向血流(圆头箭头)。在没有收缩期中期血流的情况下,多普勒超声心动图显示2个类似尖牙的峰,但不能评估腔内峰值压差(B2)。有创的血流动力学测量显示了非常高的心尖部压力,这可能是心尖部室壁瘤的发生(B3)的原因。室壁瘤切除术和心室中肌切除术是某些病例的一个潜在的治疗选择(C1-2)。
绝大多数伴有心尖室壁瘤的HCM患者都有MVO;然而,MVO可能存在或不存在心尖室壁瘤的形成。对于存在心尖室壁瘤的必要条件,应及时考虑使用超声心动图图像增强剂和/或CMR。在超声心动图检查中,必须检查贯穿整个心尖部的视野,以避免丢失小而偏心的心尖室壁瘤。
合并梗阻
彩色多普勒对识别合并狭窄特别有用(如主动脉瓣狭窄患者的LVOT阻塞或MVO)。如果识别出LV内的多节段梗阻,如MVO合并LVOT梗阻,就会改变治疗决策。患者应进行左室中部解剖和彩色多普勒的彻底评估。对于LVOT梗阻,既可以识别多节段梗阻的患者(图6),也可以识别在LVOT梯度降低后揭示MVO的解剖结构。对于多节段梗阻和医学上难治性症状的患者,中隔肌切除术(经主动脉、经心尖或联合入路)仍然是治疗的选择。
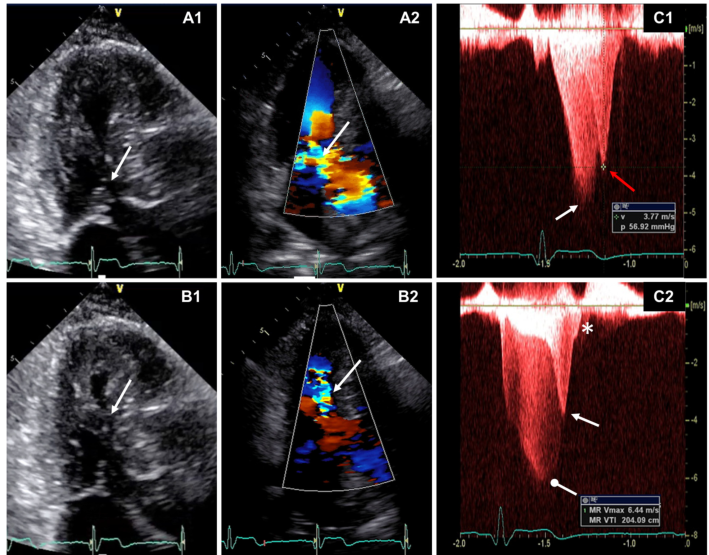
图6 二维超声心动图显示二尖瓣叶SAM (A1,箭头)与LVOT血流加速(A2,箭头)。在收缩期晚期,由于突出的乳头状肌邻近室间隔(B1,箭头),并伴有左室中部水平的血流湍流(B2,箭头),出现MVO。通过LV和LVOT的连续波多普勒显示2个独立的晚峰值信号(C1)。第一个峰对应LVOT梗阻(C1,白色箭头),第二个峰对应MVO (C1,红色箭头)。通过LV、MV连续波多普勒显示MR信号(C2,圆尖箭头)和MVO峰值信号(C2,箭头)。
OBSTRUCTION
大约1/3的HCM患者是非阻塞性的。LVOT、室间隔和MV装置的结构和内在几何形状的差异可能导致梗阻的隐藏。最初为非梗阻性的患者在未来的评估中可能会发展为动态梗阻。真正的阻塞必须与高动力状态的左室收缩功能相区分,后者通过使用彩色多普勒和CWD导致腔内速度增加和/或腔内闭塞(图7A和B)。当血流动力学不清楚时,应使用有创评估合并TTE来确认诊断(图7C)。
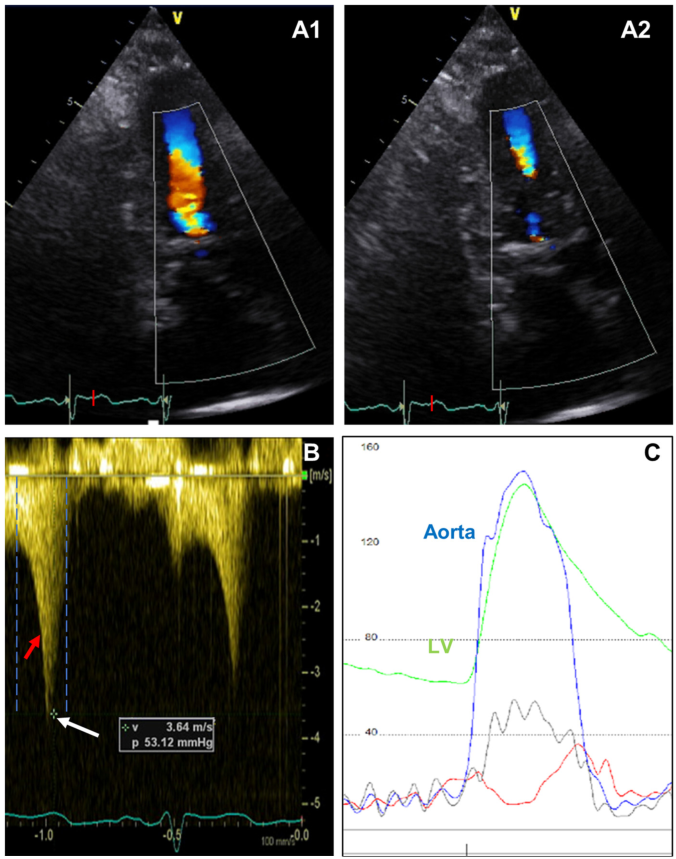
图7 偶尔,腔内CWD血流速度的增加是由于高动力收缩功能引起的腔室梗阻,而非真正的梗阻。这种现象可以通过左心腔中部的彩色血流显像在小左室(A1-A2)的情况下得到证实。连续波多普勒提示腔内压差为 50 mm Hg (B,白色箭头);然而,同时伴有CWD (C)的有创血流动力学评估证实没有心内压力阶差。这一现象的另一个线索是收缩期中期CWD速度的快速下降(B,红色箭头),而收缩期晚期CWD等高线没有高速“尾巴”轮廓,因此收缩期持续时间较短(B,蓝色虚线)。
非阻塞性HCM随没有梗阻,但与不良结局相关,包括进行性舒张功能障碍的低输出状态,射血分数保留的心力衰竭,以及心源性猝死。如果静息状态HCM患者左室内没有明显的压差,则需要一种系统的方法来激发梗阻。Valsalva动作减少前负荷,是诱发梗阻的第一步,所有HCM患者应常规进行。当Valsalva动作未发现明显梗阻时,我们常规地将重复蹲下站立动作纳入HCM的标准的静息TTE评估。我们发现重复的蹲下站立动作比Valsalva动作更敏感(图8)。
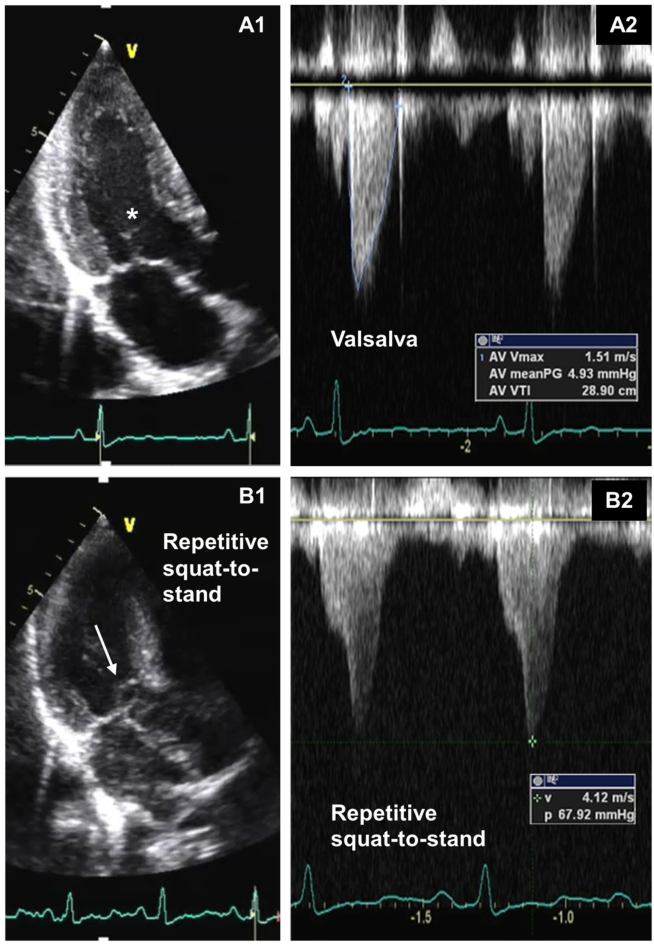
图8不对称的室间隔肥厚和二尖瓣瓣叶被拉长(星号)(A1),静息和Valsalva动作后未出现SAM(A2)。Valsalva动作在检测LVOT梗阻方面具有很好的特异性,但灵敏度有限。重复蹲立动作后容易诱发SAM (B1,箭头)和CWD多普勒动态显示LVOT阻塞(B2)(峰值压差,68 mm Hg)。
RESPONSE
Mavacamten(玛伐凯泰)
玛伐凯泰是一种有效的负性肌力药物,被证明可以降低HCM伴梗阻性LVOT的L VOT压差。在使用玛伐凯泰的患者中,需要对静息和Valsalva操作时的LVOT压差进行连续的超声心动图评估,以指导剂量调整。经胸超声心动图必须在治疗开始后第4,8和12周进行,此后每12周进行一次,用于压差监测和评估LV收缩功能障碍,是作为玛伐凯泰风险评估和缓解治疗计划的一部分。如果发生剂量调整,超声心动图也必须在4周后重复。
心肌切除术
对于由严重LVOT梗阻引起的药物难治性症状的HCM患者,应考虑室间隔减容治疗,通过室间隔心肌切除术或室间隔酒精消融术。超声心动图是评估手术候选性、术中解剖和血流动力学以及术后随访的核心。术前TTE解剖评估梗阻位置,包括室间隔、MV前叶、腱索和乳头肌。了解LVH的范围和形态对手术计划很重要。转流前TEE允许对LVOT的解剖进行评估(图9A),并排除可能与SAM共存的原发性MV异常,在多达20%的患者中需要考虑到手术入路变化的可能性。由于心肌切除术对主动脉瓣的潜在风险,应评估主动脉瓣反流的存在和程度。TEE可与胸骨切开后直接针测压(图9B)结合使用异丙肾上腺素或刺激心脏诱发心室过早复极,以确认动态梗阻的存在和位置。转流后TEE应常规进行,以评估残留的左室压差,残留或未显露的MVO,医源性室间隔缺损、新发或加剧的主动脉瓣反流、MV SAM、MR程度(图9C)和双心室收缩功能。间隔心肌切除术后,继续评估多普勒血流动力学用于指导临床管理(图9D和E)。
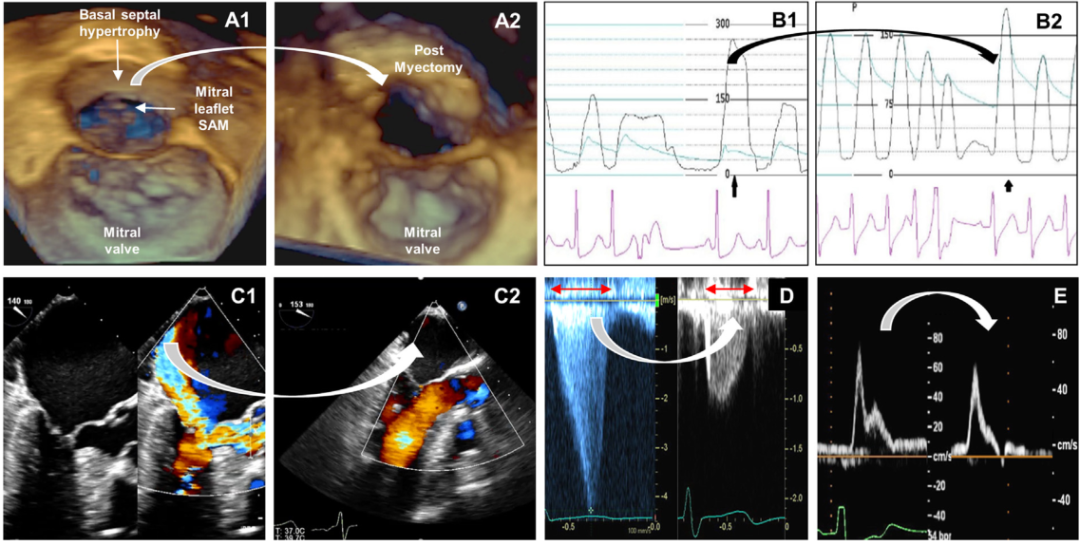
图9 三维超声心动图通过主动脉瓣观察LVOT,显示室间隔肥大和MV SAM伴严重LVOT梗阻(A1)。室间隔心肌切除术后,LVOT增大,静止时无SAM或LVOT阻塞或室性早搏(A2)。术中经针在主动脉和左室测量LVOT梯度(术前(B1)和术后(B2))。5 .成功切除心肌后,SAM介导的MR得到解决(C1-2)。LVOT压差改善也与收缩射血期的缩短相对应(D,红色箭头)。腹主动脉血流速度的脉冲波多普勒显示从双轮廓脉冲到正常主动脉血流的转换(E)。
酒精性室间隔消融
术中TTE用于评估冠状动脉内注射超声心动图增强剂的分布(图10A),仔细检查乳头状肌、右心室、非靶向性室间隔和侧壁等应避免的结构。术后(图10B),室间隔二维(2D)外观,LVOT梗阻程度,SAM和MR也必须利用彩色多普勒和CWD进行评估。应谨慎评估左室中部有无隐匿性MVO,并利用彩色M型超声。
超声心动图在HCM患者的诊断、随访和手术计划中是必不可少的。虽然动态梗阻通常发生在LVOT水平,但必须注意评估MVO或其他腔内单独的或合并的病变,以确保不遗漏隐匿性左室VOT或左室中部梗阻。多普勒成像技术为HCM的管理、预后、手术指导和随访提供了宝贵的诊断和预后信息。
参考文献:
Muhannad Abbasi , Kevin C Ong , D Brian Newman , et al.Obstruction in Hypertrophic Cardiomyopathy: Many Faces[J].J Am Soc Echocardiogr,2024:S0894-7317(24)00103-2.
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动