周菁教授│肺静脉隔离的难点:心外膜肌束在肺静脉隔离中的启示
 肺静脉隔离(PVI)作为房颤导管消融的基石,其术后复发率仍存在显著挑战。近年研究发现,心外膜肌束可能形成隐匿性电传导通路,导致解剖隔离后电学传导恢复。这些跨越冠状沟的“电桥”结构绕过了传统心内膜消融平面,揭示了单纯内膜面消融可能遗留外膜传导缝隙的机制缺陷。心外膜肌束的三维分布特征及其与Marshall韧带等结构的复杂关联,为理解消融失败提供了新的解剖电生理视角,推动着消融策略向跨壁性损伤与心外膜干预方向演进。近期,北京大学第一医院的周菁教授在学术大会上针对该问题通过病例介绍和国内外研究分享进行阐述,以期与大家一同获得心外膜肌束在PVI中的启示。
肺静脉隔离(PVI)作为房颤导管消融的基石,其术后复发率仍存在显著挑战。近年研究发现,心外膜肌束可能形成隐匿性电传导通路,导致解剖隔离后电学传导恢复。这些跨越冠状沟的“电桥”结构绕过了传统心内膜消融平面,揭示了单纯内膜面消融可能遗留外膜传导缝隙的机制缺陷。心外膜肌束的三维分布特征及其与Marshall韧带等结构的复杂关联,为理解消融失败提供了新的解剖电生理视角,推动着消融策略向跨壁性损伤与心外膜干预方向演进。近期,北京大学第一医院的周菁教授在学术大会上针对该问题通过病例介绍和国内外研究分享进行阐述,以期与大家一同获得心外膜肌束在PVI中的启示。

基本信息
患者,女,73岁,持续性房颤1个月,2022年10月22日行消融手术,进行双侧PVI。术后于右下肺静脉内仍可记录到肺静脉电位,消融线上未见明显电位。
为探究消融术后电压位置,先给病人进行复律,然后在窦率下再进行标测,发现最早点位于门静脉右前支(RAPV)与右下肺静脉(RIPV)之间,距消融线13.9mm,因此可知该电压出现与消融线无关,那是什么途径传入的呢?接下来跟着周菁教授一起来探究该问题吧。
跨越心外膜的“隐形桥梁”
周菁教授首先引用了2020年荷兰一研究1,该研究对214名接受首次接触力引导射频 PVI 的房颤患者(57% 阵发性,61% 男性,平均年龄 62 ± 9 岁)进行了研究。术前心脏计算机断层扫描成像用于评估左心房和外上叶解剖结构。在首次创建广域周向消融(WACA)圈后、至少等待 30 分钟后和输注腺苷后,直接对 PVI 进行评估。根据最早的激活部位,持续传导被定为额外消融的目标,并分为间隙-RPC 或心尖-RPC。间隙-RPC 患者的房颤 1 年复发率(47%)高于无间隙-RPC 患者(28%;P = .003)。在 1 年复发率方面,心尖部 RPC 患者(37%)与无心尖部 RPC 患者(31%;P = .379)之间无明显差异。多变量分析确定阵发性房颤和 WACA 周径是间隙型传导恢复现象(RPC)的独立预测因素,而 WACA 周径是间隙型 RPC 的独立预测因素。
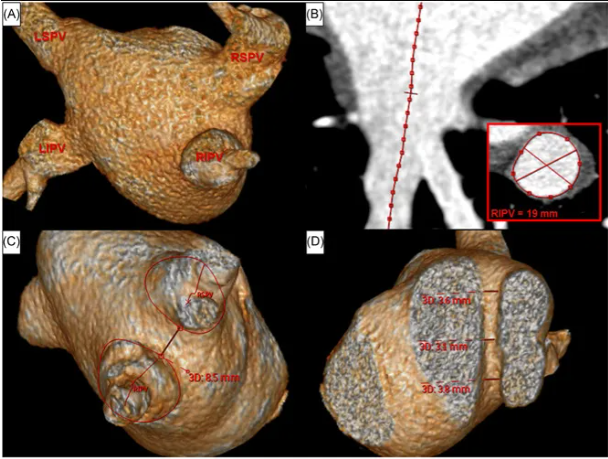
图2 心脏CT图
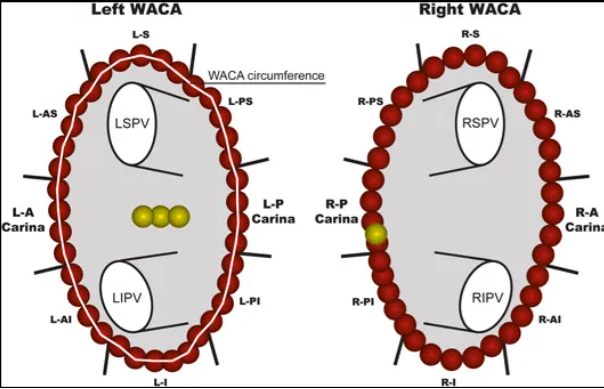
图3 WACA 节段示意图和 WACA 周径测量图
值得注意的是,上述荷兰研究中关于心外膜与消融效果的相关性在过往其他研究中得到了进一步佐证,周教授提到,相似的,西班牙某研究2纳入连续接受射频消融术的 534 例心房颤动(AF)患者,收集了所有患者的临床和电生理变量。对患者进行了为期 12.9±9.4 个月的随访,在3个月空白期后记录到的任何房性快速心律失常均被归类为复发。得出结论,在AF患者中,房室旁路和其他相邻结构之间的孔隙经常出现(发生率:13.5%)。结构性心脏病和卵圆孔与心外膜连接的存在密切相关。

图4
同时,周菁教授还引用了其团队的研究3,从定量角度验证该想法。此研究招募了 30 名首次进行 PVI 的AF 患者,通过在标准VisiTag的参数下,即当消融参数设置为导管移动距离限制在3mm内、持续时间至少20s且关闭压力-时间积分(FOT)时,在三维解剖模型上观察到60个无血栓形成的连续性有效消融损伤(CEAL)。首次消融后存在26个传导间隙(conduction gap CG),圈上补点可消除24个CG剩余2个CG需在left anterior carina进行消除。说明,部分存在于心外膜连接(ECs)。
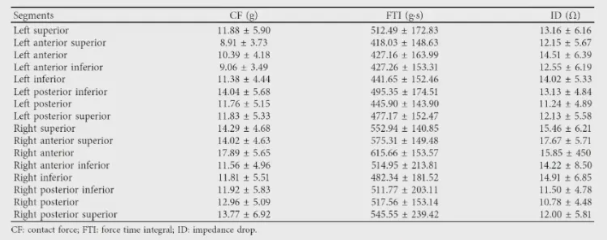
图5
另外,周菁教授引用了国内阜外医院的研究4进行参考。该研究对接受射频(RF)导管消融术的房颤患者进行回顾性分析。在 35/597 例(5.86%)患者中发现并消融了 36 个ECs。在35例ECs患者中,至少有一个ECs的PV插入位于心尖区。31例(88.6%)患者中最常见的模式是单次突破,其次是3例患者中的多次突破和1例患者中的宽突破。射频能量传递的平均次数为 1.75 ± 1.00,16/36(44.4%)名患者的单次射频能量传递足够。9/34(26.5%)名患者的最早激活区域(EAA)存在持续电位。得出结论:5.86%(35/597)的房颤患者使用 高密度标测导管(HDM)成功确认并消融了心室EC。心室EC的肺静脉插入点主要位于心尖区,连续电位可能有助于预测EC。因此,心外膜连接的消融可减少复发的可能。
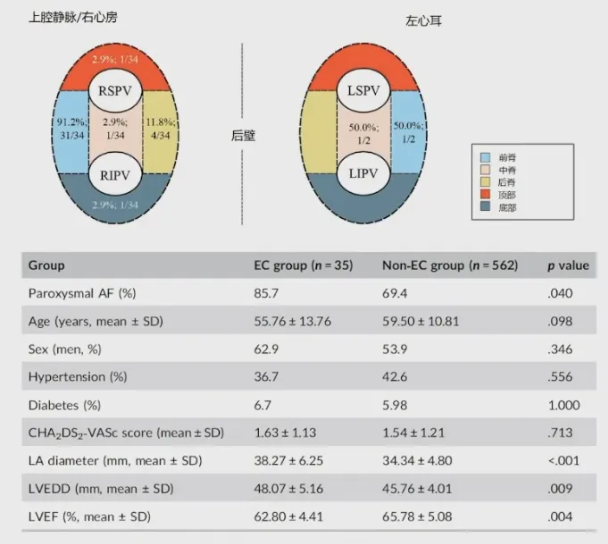
图6
周菁教授提到,针对消融术后复发的电压,多数可在肺静脉部成功消融,但少部分需要再对右房进行消融。
隐匿的心外膜“多通道”
周教授指出,上述阜外医院的研究4中,对EC的标准为:
(1)环形消融后未PVI;
(2)消融线上CG补点(大头找)后仍未PVI;
(3)窦律下高密度标测显示最早激动区位于肺静脉内远离消融线;
(4)心外膜插入点可多于一个(图7,图A、B);或存在较宽的插入(图7,图C-E)
(5)最早激动区消融后PVI,消融靶点可位于消融环线内。可得出,有些心外膜插入点不止一个。
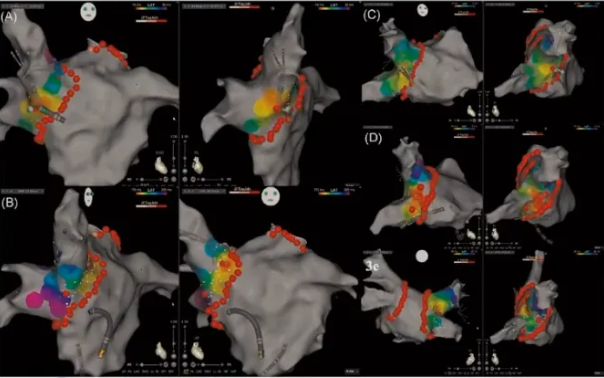
图7
同时,西班牙的研究2通过对右肺静脉进行起搏发现最早激动点远离右肺静脉与消融线,线上消融不成功,在最早激动点消融可成功PVI,可知右肺静脉存在其他位置的最早插入点。
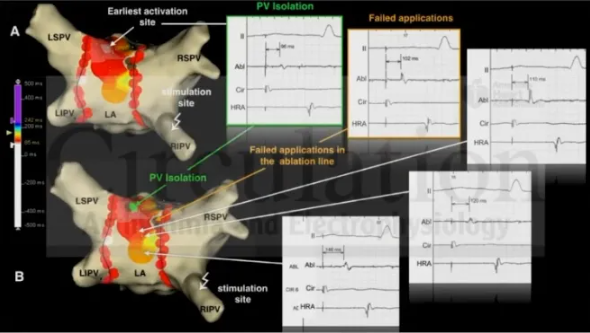
图8
周菁教授还介绍到某患者消融术前右心房起搏和窦性心律期间的激活图显示左心房(LA)传播明显5,通过心外膜连接有多个 LA 突破点,大面积环形消融无法实现右肺静脉(RPV)隔离,需要进行内肺静脉消融才能隔离RPV。可得出:
(1)右肺静脉存在多个外膜连接;
(2)外膜连接在窦性心律下传导功能被掩盖;
(3)在右房间隔中部起搏显示了两条心外膜肺静脉连接通道。
因在窦性心律下难找到心房内的插入点,因此需要在肺静脉内找到电位进行起搏,可传出找到心外膜的插入点。
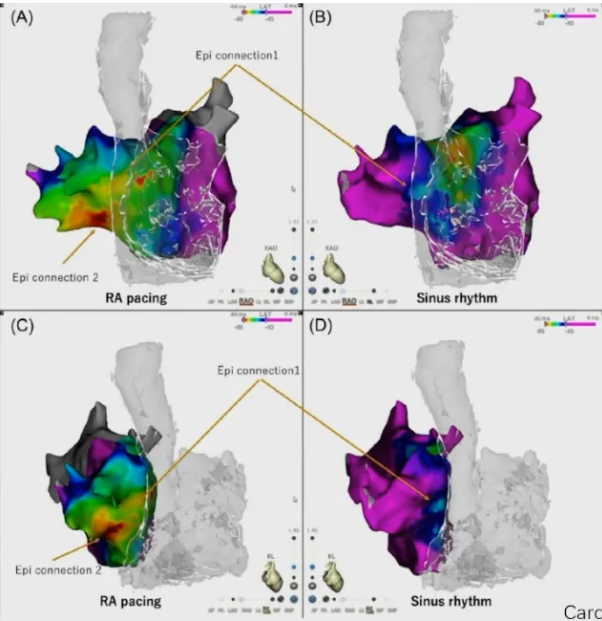
图9
总结
肺静脉与心外膜肌束之间的异常连接在临床实践中并不罕见,这种解剖和电生理上的特殊联系是导致PVI失败和AF复发的重要原因之一。研究表明,当标测结果显示远离消融线(通常平均距离为5-7mm)存在最早激动点时,应高度怀疑存在心外膜的连接。这种现象提示,单纯依赖心内膜消融可能无法彻底阻断肺静脉与心房之间的异常电传导,从而影响PVI的长期效果。
在临床操作中,肺静脉脊部是消融成功的关键区域之一,但对于部分患者,异常连接可能延伸至心房侧,尤其是在右侧肺静脉,可能需要通过在右心房侧进行补充消融以实现彻底隔离。因此,精确标测最早激动点并确定异常连接的具体位置,对于优化消融策略、提高PVI成功率以及降低房颤复发风险具有重要意义。
周菁教授的讲座不仅深化了学界对肺静脉隔离机制的认识,更为复杂房颤病例的临床处理提供了新思路。在特定病例中,通过结合心内膜和心外膜标测技术,针对性地消融异常连接点,有望进一步提升房颤导管消融的疗效,为患者带来更好的临床预后。这一研究方向凸显了精准电生理标测和个体化消融策略在房颤治疗中的重要性,具有重要的临床价值和科研意义。
参考文献:
[1] Mulder MJ, Kemme MJB, Götte MJW, van de Ven PM, Hauer HA, Tahapary GJM, van Rossum AC, Allaart CP. Differences between gap-related persistent conduction and carina-related persistent conduction during radiofrequency pulmonary vein isolation. J Cardiovasc Electrophysiol. 2020 Jul;31(7):1616-1627. doi: 10.1111/jce.14544. Epub 2020 May 22. PMID: 32406138; PMCID: PMC7383882.
[2] Barrio-Lopez MT, Sanchez-Quintana D, Garcia-Martinez J, Betancur A, Castellanos E, Arceluz M, Ortiz M, Nevado-Medina J, Garcia F, Almendral J. Epicardial Connections Involving Pulmonary Veins: The Prevalence, Predictors, and Implications for Ablation Outcome. Circ Arrhythm Electrophysiol. 2020 Jan;13(1):e007544. doi: 10.1161/CIRCEP.119.007544. Epub 2020 Jan 15. PMID: 31940223.
[3] Wang YC, Huang B, Li K, He PK, Chen ED, Xia YL, Jiang J, Sheng QH, Zhou J, Ding YS. A Pilot Study on Parameter Setting of VisiTag™ Module during Pulmonary Vein Isolation. Cardiol Res Pract. 2018 Oct 29;2018:8960941. doi: 10.1155/2018/8960941. PMID: 30510796; PMCID: PMC6231390.
[4] Sun X, Niu G, Lin J, Suo N, Guo T, Lu J, Feng T, Zheng L, Yao Y, Zhang S. The incidence and location of epicardial connections in the era of contact force guided ablation for pulmonary vein isolation. J Cardiovasc Electrophysiol. 2021 Sep;32(9):2381-2390. doi: 10.1111/jce.15174. Epub 2021 Jul 27. PMID: 34270147.
[5] Kitamura T, Hayashi K, Ohta M, Izumi C, Masuda N, Ogata N, Isshiki T. Distinct propagation patterns of right pulmonary veins through multiple epicardial connections during right atrial pacing and sinus rhythm. J Cardiovasc Electrophysiol. 2022 Aug;33(8):1905-1907. doi: 10.1111/jce.15619. Epub 2022 Jul 11. PMID: 35775820.
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动