学术分享丨宋光远教授:TEER在FMR患者中的应用策略选择及病例分析
二尖瓣返流(MR)是由左心室(LV)的血液通过二尖瓣(MV)逆行流入左心房(LA)引起的,在放射至心尖部时最容易在左腋下听到收缩期杂音。MR 是全世界最常见的瓣膜异常,影响总人口的 2% 以上,并且随着年龄的增长而患病率增加,而其中的FMR更是近年来研究的热点话题。首都医科大学附属北京安贞医院宋光远教授以“TEER在FMR患者中的应用策略选择及病例分析”为题通过病例详细剖析FMR,回顾和总结二尖瓣返流的特点、病理生理机制以及对应治疗策略的选择。

一、MR的分类方法
(一)从病理生理学角度,MR可细分为原发性和继发性原因。
1.原发性二尖瓣反流,也称为退行性二尖瓣返流(DMR)或先天性MR,任何由瓣叶、腱索和/或乳头肌(PM)的结构畸形或损伤导致的 MR,导致瓣叶在收缩期闭合不充分。常见原因如乳头肌破裂、二尖瓣脱垂(MVP)或瓣叶穿孔。
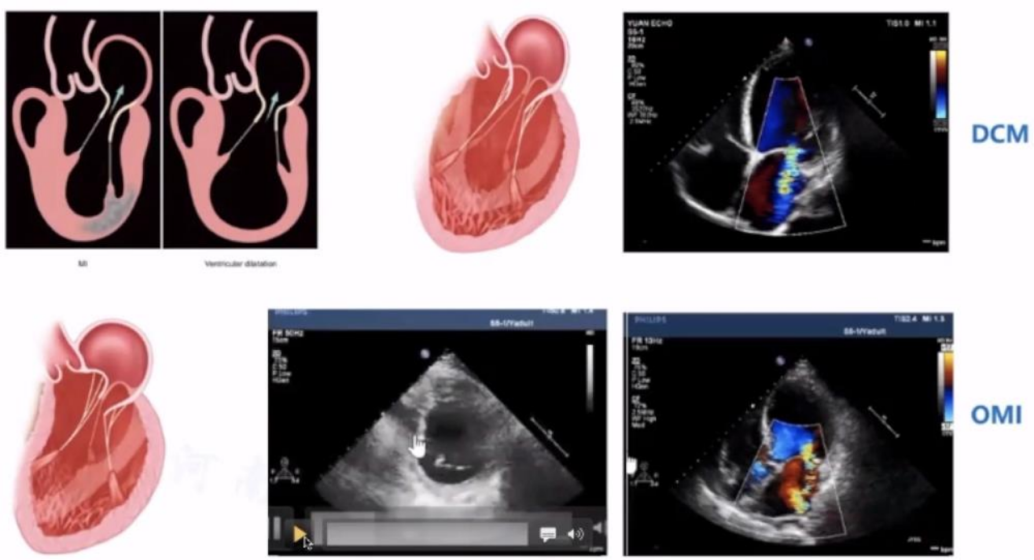
2.继发性二尖瓣反流,也称为功能性二尖瓣返流(FMR)或缺血性二尖瓣返流(IMR),是指由于左心室壁运动异常(即缺血性心肌病)或左心室重构(即扩张型心肌病),瓣膜本身没有结构问题,导致二尖瓣环扩张或乳头肌移位,导致不正确关闭的二尖瓣小叶逆行。
(二)依据MR的Carpentier 的分类,分型如下:
Type 1:正常的小叶运动由环状扩张或瓣叶穿孔引起;反流射流集中引导。
Type 2:过度的小叶运动由乳头肌破裂、腱索断裂或多余腱索引起;偏心射流远离相关瓣叶。
Type 3:受限的瓣叶运动。
Ⅲa:收缩期和舒张期的瓣叶运动受限多由风湿性心脏病引起;正常乳头肌;射流可以是中心导向或偏心导向。
Ⅲb:瓣叶运动受限于收缩期由乳头肌功能障碍或左心室扩张引起;乳头肌异常;射流可以是中心导向或偏心导向。
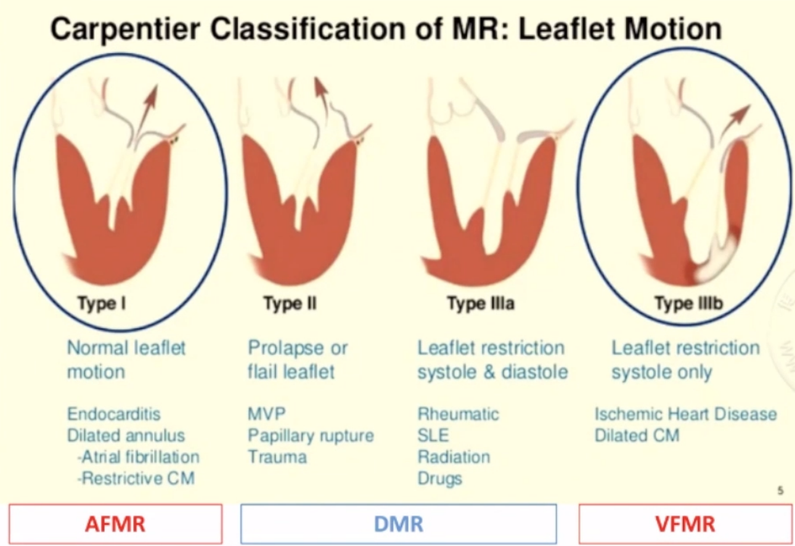
▲分类示意图
此外,FMR又分为AFMR和VFMR。AFMR是指左房扩大引起的FMR,VFMR是指左室扩大引起的FMR。
二、FMR的病因学和临床特征
AFMR患者在孤立性房颤中只占到6%-7%,但高达53%患者属于射血分数保留的心力衰竭(HFpEF)。临床诊断的特征是左心室收缩功能正常,正常的瓣叶活动,中心喷射,但伴有严重的LA扩张,瓣叶对合点下移,瓣环明显扩张,穹窿高度降低。
VFMR患者有11%-59%发生于心肌梗死(缺血性心肌病)后,且>50%疾病发生于扩张型心肌病。临床诊断的特征是收缩期左室功能障碍,瓣叶束缚和运动受限,偏心射流>中央射流,LA相对扩张。
三、FMR的病理生理学机制
AFMR是中心性返流,表现为二尖瓣闭合力降低,LA压力升高,瓣环收缩降低。关于瓣叶对合不良的原因主要是瓣环扩张和扁平化,不充分的小叶生长,纤维小叶增厚以及心房和瓣环动力学的改变。
VFMR是偏心性返流,表现为二尖瓣闭合力降低,LV收缩力下降,LA压力升高,瓣环收缩降低。瓣叶束缚力量升高的原因是LV扩张运动障碍,PM移位或不同步,以及相对环形扩张,简单归纳,两者的不同点体现在:相对LA/LV尺寸,瓣叶补偿深度,LVEF(左心室射血分数),喷射方向。
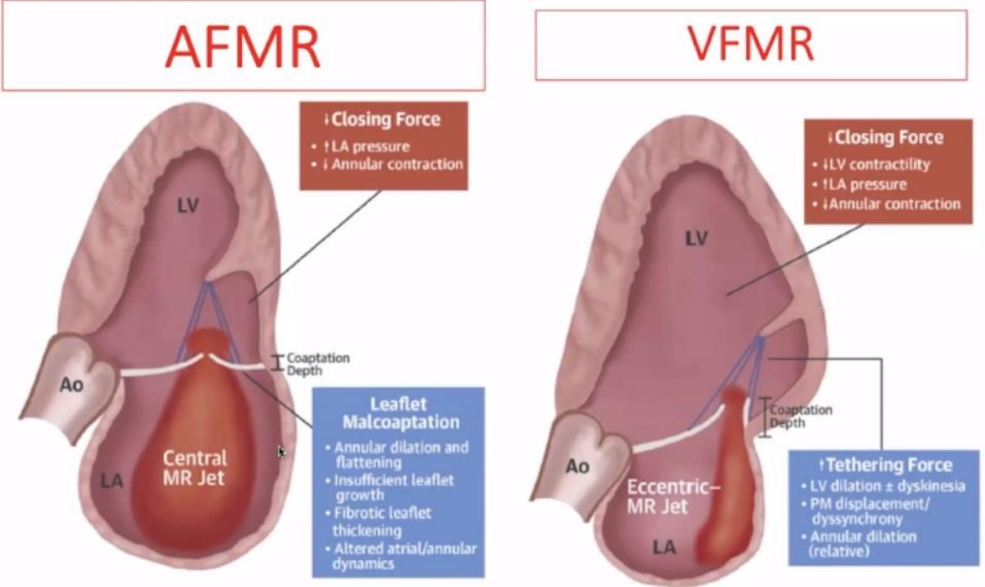
▲病理生理机制示意图
依据Carpentier Ⅲb分类对AFMR分析如下:
AF(心房颤动)引起LA扩大(白色箭头)超过MA(瓣环)扩张(红色箭头)时,LA后壁扩张至MA后方,LV后壁相对内移(黑色箭头),MA后壁从LV后壁向LA后壁移动,PML(二尖瓣后叶)向LV后壁牵拉(Hamstring of PML),导致偏心性AFMR。
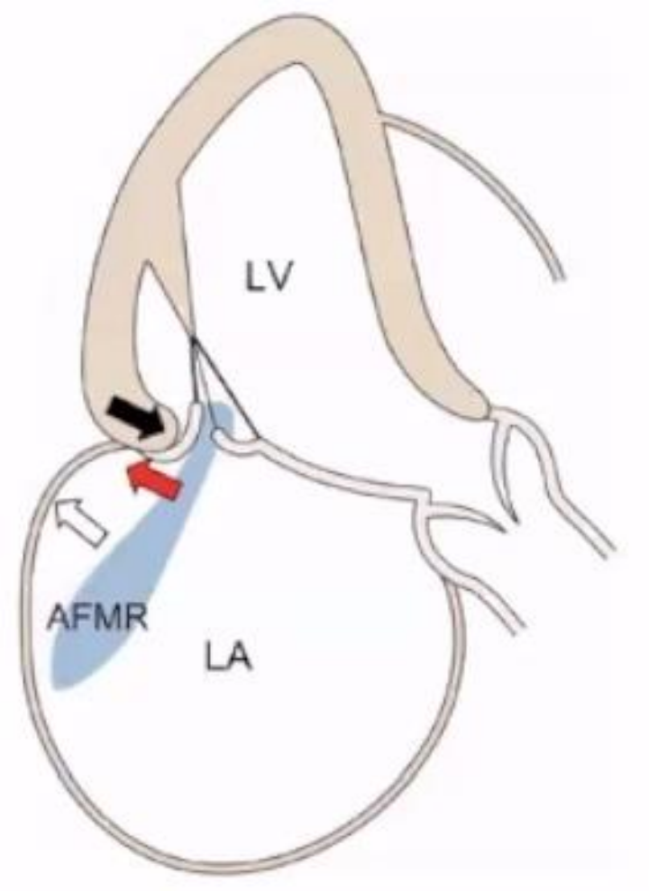 ▲AFMR示意图
▲AFMR示意图
依据Carpentier Ⅲb分类对VFMR分析如下:
VFMR是由于LV扩大,收缩功能下降导致,PML被牵拉(白色箭头)帐篷样隆起(红色箭头)。
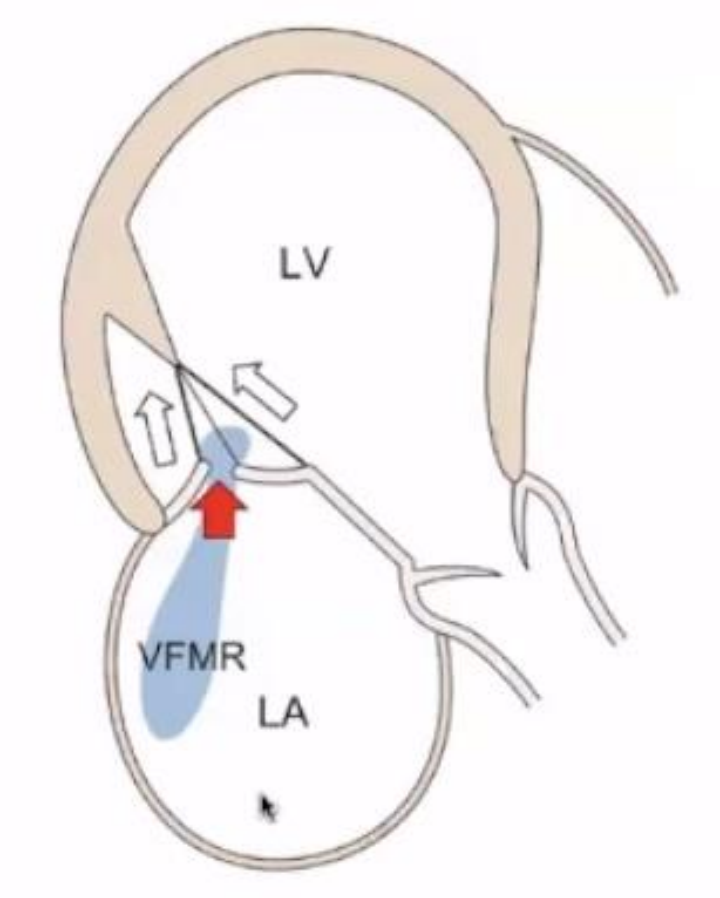
▲VFMR示意图

▲AFMR和VEMR的临床分类
四、FMR的影像学
经典的对称性AFMR typeⅠ型的影像学特征如下图所示,图左提示单纯心房扩张,穹窿高度降低,瓣环扩张,类似于正常的二尖瓣瓣膜,而非扁平化(DMFR)的或前后径扩张(VFMR),相对来说是把正常的瓣膜放大了几倍,中间出现中心性返流。
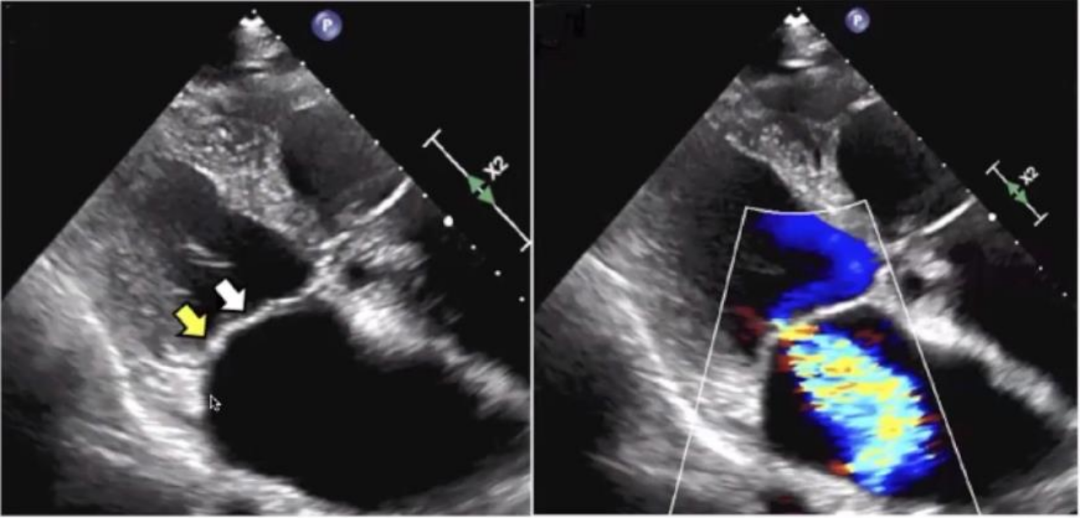 ▲AFMR typeⅠ型超声:二尖瓣前叶(白色箭头)和二尖瓣后叶(黄色箭头)沿二尖瓣环面变平
▲AFMR typeⅠ型超声:二尖瓣前叶(白色箭头)和二尖瓣后叶(黄色箭头)沿二尖瓣环面变平
非对称性AFMR typeⅠ+Ⅲ型的影像学特征如下图所示,影像学可见LA明显扩大,MV 瓣环明显扩大 ,MV扁平化,PMVL(二尖瓣后叶)束缚,AMVL(二尖瓣前叶)假性脱垂,且后叶常常较短,前后叶对合不良。
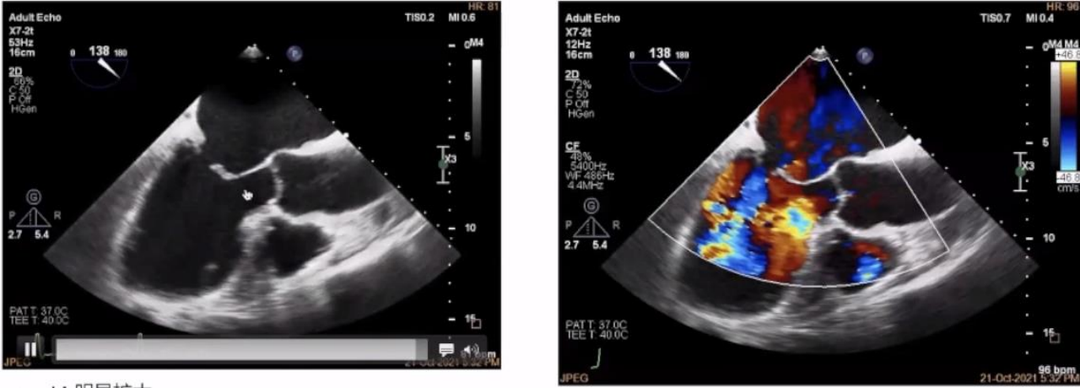
▲非对称性AFMR typeⅠ+Ⅲ型的超声影像图
二尖瓣是一个复合体的构造,影响因素较多。在乳头肌定位和MV栓系模式中可见看到,乳头肌是从左心室游离壁发出的两条粗大的肌小梁。前乳头肌发出的腱索与MV前半部分相连,后乳头肌发出的腱索与MV后半部分相连。前乳头肌有双重血供,后乳头肌仅仅有一支动脉供血。
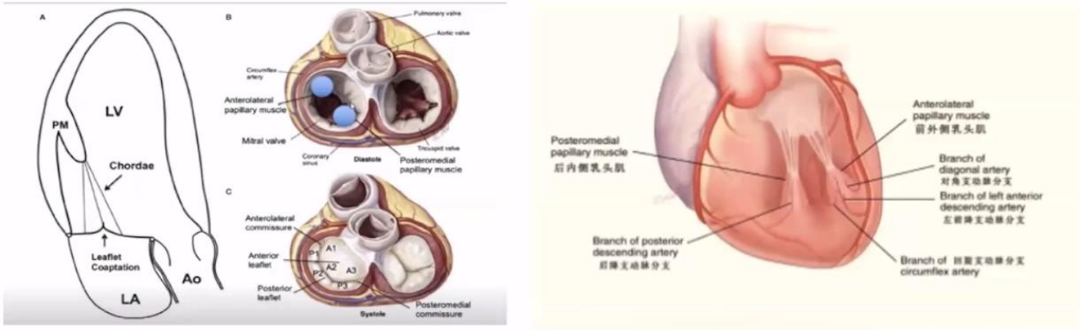
▲解剖图:前外侧乳头肌:A2.A1.AC.P1.P2;后内侧乳头肌:A2.A3.PC.P3.P2
MR Carpentier Ⅲb型的影像学可以看出是瓣膜活动度收缩期受限。
▲MR Carpentier Ⅲb型影像图
非对称射流的Carpentier type Ⅲb型的VFMR由于缺血性心脏病引起。影像学资料可见,以LV扩大为主,后叶拴系力增强,常常较短,前后叶对合不良,MR常起源于A2-P2范围弥散。宋教授强调,在评估时超声影像应仔细寻找MR来源和机制。
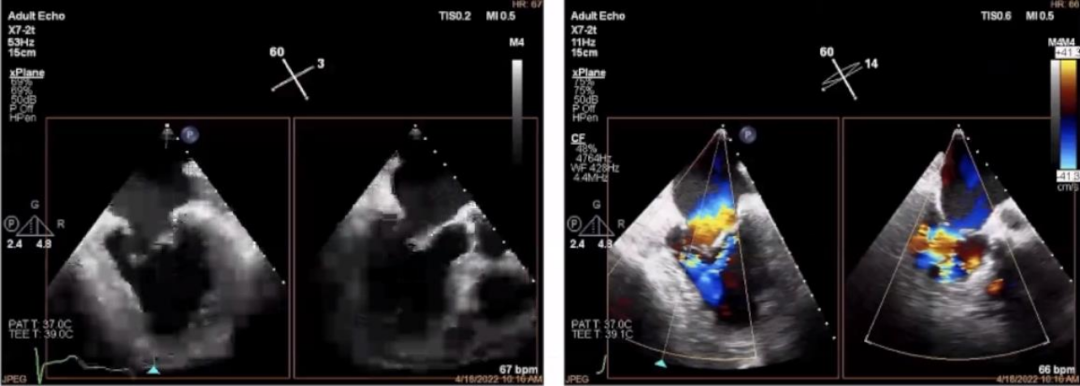
▲超声影像学
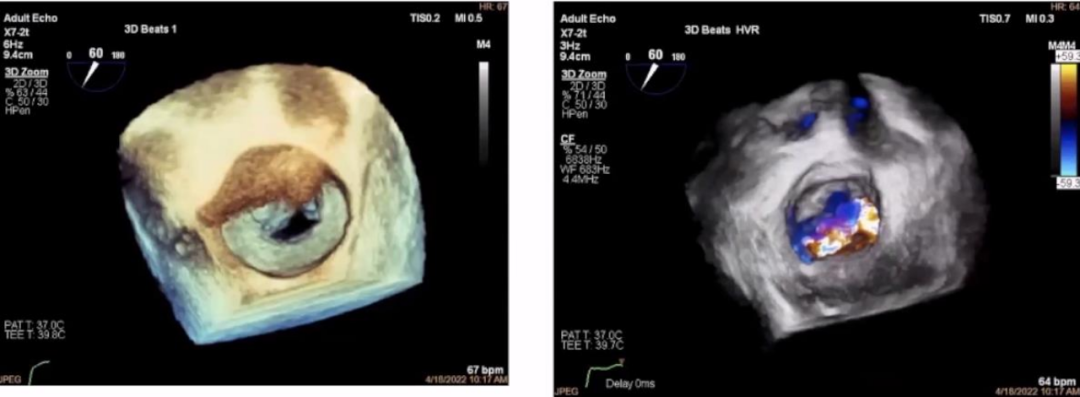
▲影像学图片
五、循证医学证据和患者筛选
关于TEER(经导管二尖瓣缘对缘修复)治疗FMR的循证医学证据,2018年的《新英格兰杂志》发表了一篇关于《心力衰竭患者的经导管二尖瓣修复》的文章。该研究是在美国和加拿大的 78 个地点,招募了心力衰竭和中度至重度或重度继发性二尖瓣关闭不全的患者,尽管使用了最大剂量的指南指导的药物治疗(GDMT),但仍有症状。患者被随机分配接受经导管二尖瓣修复加药物治疗(器械组)或单独药物治疗(对照组)。主要有效性终点是随访后 24 个月内因心力衰竭住院的所有患者。主要安全终点是在 12 个月时无设备相关并发症;该终点的发生率与预先设定的 88.0% 的客观绩效目标进行了比较。
COAPT研究入选标准是:无重度左室功能障碍,且LVEF≥20%,LVESD≤70mm;右心室损害和/或肺动脉高压,且TAPSE≥15mm或收缩压峰值≥8cm/s,三尖瓣返流不严重,SPAP≤70mmHg;无血流动力学不稳定,无药物治疗难治的晚期心力衰竭,不需要静脉注射药物或机械循环支持。
研究将参加试验的 614 名患者中,302 名被分配到设备组,312 名被分配到对照组。装置组 24 个月内因心力衰竭住院的年化率为 35.8%/患者年,而对照组为 67.9%/患者年(风险比,0.53;95% 置信区间 [CI], 0.40 至 0.70;P<0.001)。12 个月时无器械相关并发症概率为 96.6%(95% 置信下限为 94.8%;与性能目标相比,P<0.001)。装置组 29.1% 的患者在 24 个月内因任何原因死亡,而对照组为 46.1%(风险比,0.62;95% CI,0.46 至 0.82;P<0.001)。
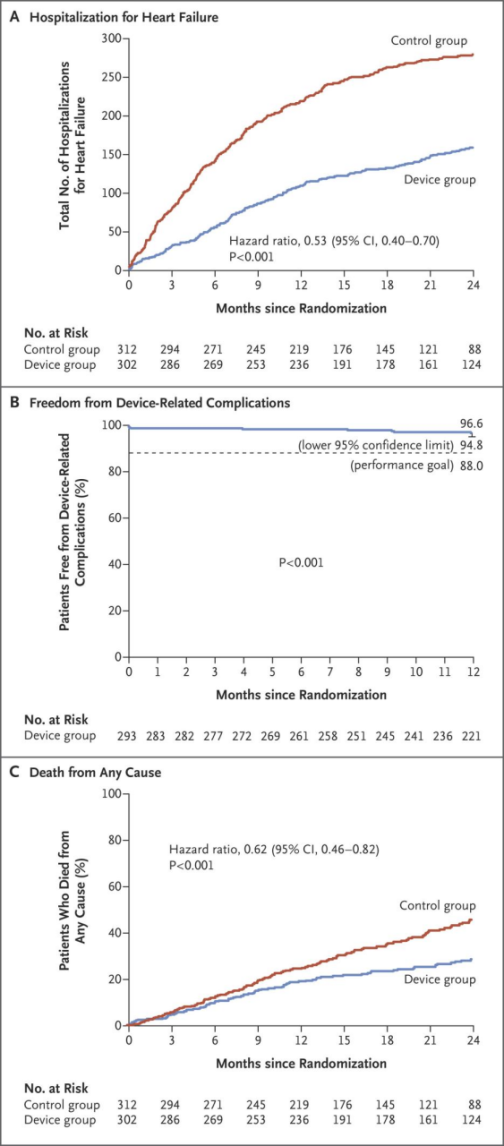 ▲主要有效性和安全性终点和死亡
▲主要有效性和安全性终点和死亡
研究得出结论,在使用最大剂量的GDMT后仍有症状的中度至重度或重度继发性二尖瓣关闭不全的心力衰竭患者中,经导管二尖瓣修复术可降低心力衰竭住院率,并降低所有在随访后 24 个月内导致死亡率高于单独药物治疗。无设备相关并发症的比率超过了预先设定的安全阈值。
2021 ESC/EACTS 瓣膜性心脏病管理指南:由欧洲心脏病学会 (ESC) 和欧洲心胸外科协会 (EACTS) 瓣膜性心脏病管理工作组制定,关于二尖瓣返流患者的治疗管理给出推荐意见。
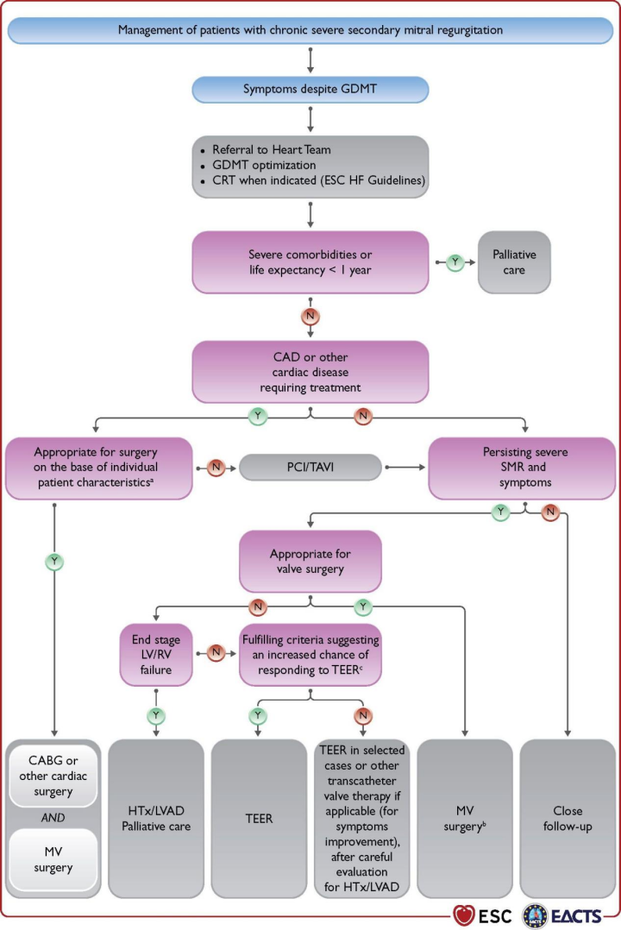 ▲慢性重度继发性二尖瓣关闭不全患者的管理。CAD = 冠状动脉疾病;CABG = 冠状动脉旁路移植术;CRT = 心脏再同步化治疗;ESC = 欧洲心脏病学会;GDMT = 以指南为导向的药物治疗;HF = 心力衰竭;HTx = 心脏移植;LVAD = 左心室辅助装置;LV = 左心室/左心室;LVEF = 左心室射血分数;MV = 二尖瓣;PCI = 经皮冠状动脉介入治疗;RV = 右心室/右心室;SMR = 继发性二尖瓣关闭不全;TAVI = 经导管主动脉瓣植入术;TEER:经导管边缘到边缘修复。一个LVEF、预测的手术风险、心肌存活量、冠状动脉解剖结构/目标血管、所需的伴随手术类型、TEER 资格、持久手术修复的可能性、手术二尖瓣置换的需要、当地专业知识。b特别是当需要同时进行三尖瓣手术时。c COAPT 标准(功能性二尖瓣关闭不全心力衰竭患者 MitraClip 经皮治疗的心血管结果评估)
▲慢性重度继发性二尖瓣关闭不全患者的管理。CAD = 冠状动脉疾病;CABG = 冠状动脉旁路移植术;CRT = 心脏再同步化治疗;ESC = 欧洲心脏病学会;GDMT = 以指南为导向的药物治疗;HF = 心力衰竭;HTx = 心脏移植;LVAD = 左心室辅助装置;LV = 左心室/左心室;LVEF = 左心室射血分数;MV = 二尖瓣;PCI = 经皮冠状动脉介入治疗;RV = 右心室/右心室;SMR = 继发性二尖瓣关闭不全;TAVI = 经导管主动脉瓣植入术;TEER:经导管边缘到边缘修复。一个LVEF、预测的手术风险、心肌存活量、冠状动脉解剖结构/目标血管、所需的伴随手术类型、TEER 资格、持久手术修复的可能性、手术二尖瓣置换的需要、当地专业知识。b特别是当需要同时进行三尖瓣手术时。c COAPT 标准(功能性二尖瓣关闭不全心力衰竭患者 MitraClip 经皮治疗的心血管结果评估)
六、TEER治疗FMR的手术策略
关于TEER治疗FMR的策略方面,需要考量三个方面:
1.二尖瓣面积>4 mm2
2.二尖瓣后叶的长度≥7 mm
3.VFMR接合的差距,MV栓系模式,LVESD≤70mm,LVEF≥20%;AFMR的二尖瓣环直径≤40mm,二尖瓣环功能保留,以及MV栓系模式。
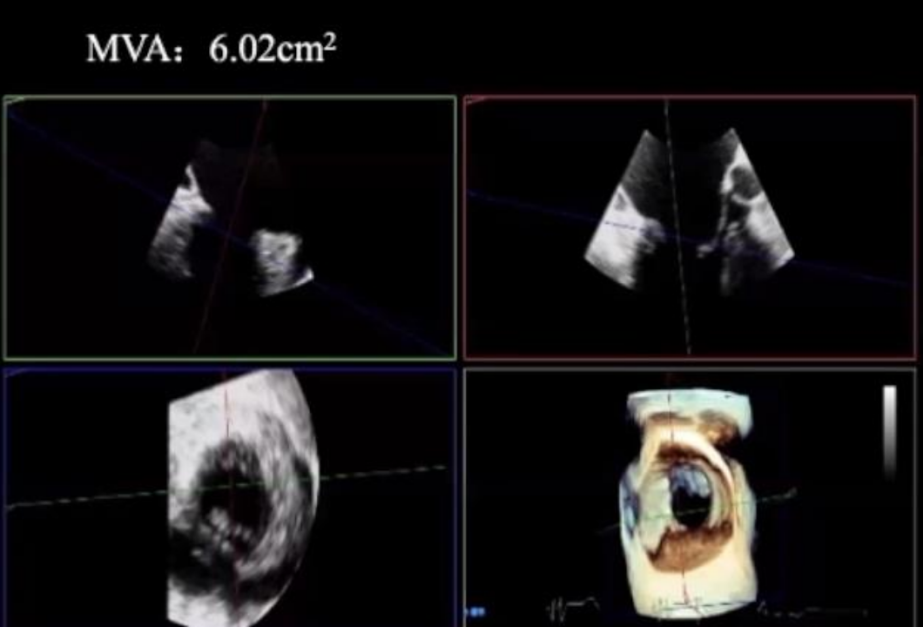 ▲影像学
▲影像学
关于TEER的临床应用方面,宋教授强调,清晰的的TEE成像分析在患者筛查中至关重要。引用《2021 ESC/EACTS 瓣膜性心脏病管理指南》推荐如下:
1.支持手术干预的证据仍然有限。对于接受 CABG 或其他心脏手术的严重 SMR 患者,建议进行二尖瓣手术。手术方法必须适合个体患者。
2.在选定的没有晚期 LV 重塑的患者中,使用尺寸过小的完整刚性环修复二尖瓣可恢复瓣膜功能,改善症状,并导致反向 LV 重塑。
3.对于超声心动图预测修复失败的患者,可以考虑额外的瓣膜/瓣膜下技术或腱索保留瓣膜置换术。瓣膜置换可避免二尖瓣关闭不全的复发,尽管这并不能转化为更好的 LV 逆向重塑或存活。
4.由于手术风险显著、二尖瓣反流复发率高以及缺乏经证实的生存益处,SMR 中孤立二尖瓣手术的适应症特别受限。
5.在心房功能性二尖瓣关闭不全的患者中,LVEF 通常正常,LV 扩张不太明显,二尖瓣环扩张是二尖瓣关闭不全的主要机制。该亚组可能通过通常与 AF 消融相关的环状瓣环成形术得到更有效的治疗,但证据仍然有限。
6.带有 MitraClip 系统的 TEER 是 SMR 的微创治疗选择。两项 RCT(COAPT 和 MITRA-FR)评估了其在有症状的心力衰竭和尽管药物治疗仍持续存在严重 SMR 的患者中的安全性和有效性,这些患者被心脏团队认为不适合或不适合进行手术,结果表明,该程序是安全的,可有效降低 SMR 长达 3 年。
7.然而,在 MITRA-FR 试验中,与单独使用 GDMT 相比,MitraClip 植入对 12 个月和 2 年的全因死亡率或心力衰竭住院的主要终点没有影响。
8.在 COAPT 试验中,MitraClip 植入显著降低了心力衰竭累计住院的主要终点,以及几个预先指定的次要终点,包括 2 年的全因死亡率。COAPT 试验的子分析证实了几个患者亚组对 TEER 的积极反应;相反,在 MITRA-FR 试验的超声心动图亚组分析中,介入治疗的效果在所有亚组中都是中性的。
9.这两个试验的相互矛盾的结果引起了相当多的讨论。这些不同的结果可能部分由试验的效果大小、试验设计的差异、患者选择、SMR 严重程度的超声心动图评估、药物治疗的使用和技术因素来解释。
10.COAPT 患者表现出更严重的 SMR(EROA 41±15 mm2对 31±10 mm2)和更少的 LV 扩张(平均指数 LV 舒张末期容积 101±34 mL/m2对 135±35 mL/m2) 比那些参加 MITRA-FR 的人。也许反映了 SMR 与 LV 尺寸(“不成比例的”二尖瓣反流)相关的更严重程度,COAPT 患者总体上更有可能从 TEER 中受益,从而降低死亡率和心力衰竭住院率。
11.需要更多的研究来确定将从 TEER 中受益最多的患者。因此,在符合 COAPT 纳入标准的严重 SMR 患者中应考虑 TEER,接受由心力衰竭专家监督的最佳药物治疗,并尽可能接近实际参加研究的患者。还应追求程序结果的优化。此外,仅当 COAPT 标准未达到改善症状和生活质量的目的时,才可考虑 TEER。在 SMR 不太严重(EROA<30 mm2)和晚期 LV 扩张/功能障碍的患者中,MitraClip 的预后益处仍未得到证实。心脏移植或 LV 辅助装置植入可能更好地服务于终末期 LV 和/或 RV 衰竭且没有血运重建选择的患者。当 LVEF<15%时,瓣膜干预通常不是一种选择。
12.接受 CABG 的患者中度缺血性 SMR 的管理仍然是一个争论的对象。如果存在心肌活力并且合并症较低,则更有可能考虑手术。运动引起的呼吸困难和二尖瓣反流严重程度和 SPAP 的大幅增加有利于联合手术。
13.TEER 以外的经导管二尖瓣修复系统以及经导管二尖瓣置换装置目前是深入研究的主题,但临床数据仍然有限。
宋教授最后引入真实临床案例,深入浅出的为我们剖析了TEER在FMR中的临床应用。对于手术策略的选择,他强调临床医生在工作中要充分评估,从文献和同道中学习更多相关经验,才能更好的指导今后工作,最终造福患者。
七、总结
1.FMR需要积极优化原发疾病的治疗至少1个月进行评估MR严重程度和TEER干预指征。
2.利用TEE仔细分析MR机制和解剖特征制定手术策略。
3.术后仍需要强化药物治疗,密切随访FMR进展。
4.AFMR需要重视瓣环功能的评估和心房心肌病的机制突破。