现代二尖瓣修复术:技术洞察与未来展望
随着先进外科手术和经导管技术的出现,二尖瓣修复术取得了显著发展。三维可视化、机器人手术和经导管缘对缘修复等创新技术提高了手术精度,并为高危患者提供了更多治疗选择。经导管二尖瓣修复术、瓣环成形术和腱索系统等新兴技术,为复杂二尖瓣病变提供了个性化解决方案。在多模态成像和人工智能驱动规划的指导下,个性化治疗策略正在重塑临床决策。正在进行的试验和下一代设备有望改善长期预后,标志着二尖瓣治疗正向微创、精准引导方向转变。2025年10月发表在《Journal of Clinical Medicine》的这篇综述旨在全面概述外科和介入领域二尖瓣修复术的最新技术进展、临床应用及未来方向。

引言
二尖瓣反流(MR)是发达国家中需要干预的第二大常见瓣膜性心脏病,仅在美国就影响着超过300万人,是导致心力衰竭(HF)发生、发病率和死亡率升高的重要因素。根据病因,它通常分为退行性二尖瓣反流(DMR)和功能性二尖瓣反流(FMR)。退行性二尖瓣反流由二尖瓣(MV)装置的内在结构异常引起,最常见的是黏液样变性或纤维弹性缺乏;而功能性二尖瓣反流则由心室(v-FMR)和/或心房(a-FMR)重构导致,这种重构会扭曲二尖瓣几何结构,但不会造成二尖瓣结构性损伤。
外科二尖瓣修复术(SMVr)仍是治疗退行性二尖瓣反流的金标准,与瓣膜置换术相比,其预后更优,尤其是在保留左心室(LV)功能和长期耐用性方面。对于心室功能性二尖瓣反流,外科二尖瓣修复术的获益仍存在争议,因为这类患者通常合并症负担重且存在与年龄相关的衰弱,导致术后复发率高,长期耐用性不确定。因此,治疗方案不断发展,经导管缘对缘修复术(TEER)现已被认为是经过恰当选择的患者的循证一线治疗。
而对于心房功能性二尖瓣反流,情况则相反,尽管缺乏直接比较经导管二尖瓣修复术(TMVr)与手术治疗的综合数据,但手术治疗效果良好,再次手术率、死亡率和二尖瓣反流复发率均较低。
传统开胸手术围手术期并发症发生率较高,在老年或合并其他疾病的患者中尤为明显 。为克服这些局限性,近年来外科技术取得了快速创新,包括可视化辅助系统和机器人辅助(ROB)技术,这些技术旨在减少手术创伤,取得了良好的短期和中期预后 。同时,经导管二尖瓣修复术装置(如经导管缘对缘修复术、瓣环成形术装置和人工腱索系统)也扩大了治疗选择范围。
此外,先进成像技术、计算建模和个体化患者分析的整合,开创了个性化治疗和优化并发症管理的新时代。
外科技术创新
在过去二十年中,受提高手术精度、减少手术创伤、改善患者预后和满意度的需求推动,外科二尖瓣修复术发生了深刻变革。对创伤更小、个体化治疗方案的需求不断增加,促进了先进外科技术的发展。微创入路、可视化辅助和机器人辅助手术以及三维(3D)成像(尤其是超声心动图)等创新,显著优化了手术规划和执行过程,在改善手术预后方面显示出巨大潜力。这些技术旨在保留传统修复术的耐用性和有效性,同时扩大高危或解剖结构复杂患者的手术适应症。
1
可视化辅助与三维重建技术
微创二尖瓣修复术(MIMVr)包括避免全胸骨正中切开的外科技术。这些方法在入路部位、可视化方式(直接视野或视频辅助技术)和器械操作方式上可能有所不同,范围从传统的手持长轴器械到全机器人辅助系统。
与直接视野方法相比,全视频辅助技术(尤其是结合三维技术时)可能会延长手术时间和主动脉阻断时间,但能提供更清晰的可视化效果,保持相当的围手术期安全性,并展现出相似的早期临床结果,且重症监护病房住院时间有缩短趋势。事实上,与传统的二维视频辅助系统相比,三维视频辅助技术提高了深度感知能力,增强了修复手术的精度(尤其是人工腱索植入术),并缩短了手术时间。
先进的可视化平台还整合了增强现实和虚拟现实界面,为外科医生和心血管影像医师提供沉浸式培训和术前规划。此外,基于计算机断层扫描(CT)或三维超声心动图数据集的患者特异性二尖瓣3D打印模型,可用于外科和经导管修复术的实操模拟和术前规划。当与机器学习辅助分割相结合时,这种方法在教学、瓣膜和血管功能评估以及复杂瓣膜解剖结构或存在明显解剖结构扭曲的再次手术的术前规划中特别有益。
2
机器人辅助二尖瓣修复术
机器人辅助二尖瓣修复术(ROB-MVr)是微创技术中最先进的发展之一,与传统开胸或胸腔镜方法相比,具有更高的灵活性和更清晰的可视化效果。最广泛使用的平台是达芬奇手术系统,它使外科医生能够通过微小的肋间切口,使用关节器械和高清三维摄像头进行复杂的二尖瓣修复术。
其技术复杂性和较长的手术时间被微创性和较短的住院时间所抵消,尤其是在经验丰富的医疗中心,该方法能保证与其他方法相当的手术成功率和长期预后。
在对比分析中,与传统胸骨正中切开术相比,机器人手术具有住院时间短、出血量少、恢复正常活动快和美容效果好等优点。重要的是,这些优势似乎并未影响长期结果,多家中心报告称,在5-10年的随访中,机器人辅助二尖瓣修复术的修复耐用性和无再次手术率与其他方法相当或更优。
然而,机器人辅助二尖瓣修复术也面临一些挑战,包括显著的学习曲线(需要近200 例手术才能最大程度缩短手术时间),以及与设备、培训和器械维护相关的高昂初始成本。此外,与其他非机器人微创方法相比,该技术的主动脉阻断时间和手术持续时间更长。尽管如此,先前在小切口二尖瓣修复术方面的经验对初始学习曲线有积极影响。
因此,该技术的应用主要集中在具有专业专长的高容量医疗中心。未来的发展可能会侧重于提高可及性和降低成本,同时探索将机器人系统与实时成像和基于人工智能(AI)的手术引导相结合,以帮助减轻该技术当前的局限性。
3
微创外科入路及预后
微创二尖瓣修复术已成为传统胸骨切开术的一种有价值的替代方案,旨在减少手术创伤,同时保留外科二尖瓣修复术的高疗效(图1)。该手术通常通过右侧小切口开胸和外周插管进行,通过4-6厘米的切口直接到达二尖瓣,无需劈开胸骨。这种入路既适用于传统的手持器械,也适用于机器人辅助。
多项研究表明,微创二尖瓣修复术与术后疼痛减轻、术后并发症发生率降低、住院时间缩短、美容效果改善和恢复日常活动速度加快相关,最终有助于降低整体医疗成本 。重要的是,这些优势的获得并未以牺牲修复质量为代价。在经验丰富的医生操作下,与传统方法相比,该技术已显示出相当或更优的修复率、低死亡率和出色的长期耐用性。值得注意的是,不同入路部位在围手术期和长期发病率及死亡率方面没有差异。
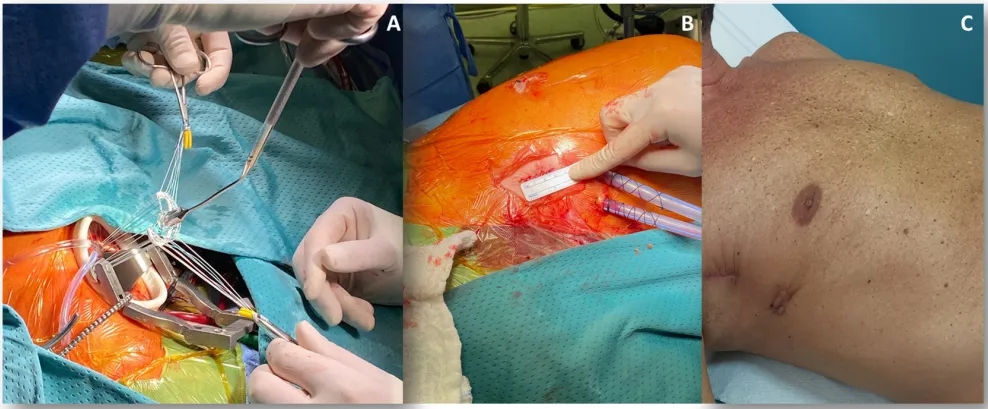
图1.经右侧小切口开胸的微创二尖瓣修复术:(A)显示通过右侧小切口开胸入路放置二尖瓣瓣环成形环的过程;(B)描绘修复后的最终结果,移除牵开器和手术器械后,放置引流管并缝合切口;(C)展示最终手术疤痕,与胸骨正中切开术相比,美容效果更优,对患者的影响更小。
然而,患者选择仍然至关重要。微创二尖瓣修复术可能不适用于复杂的再次手术、严重胸壁畸形或广泛瓣环钙化的病例。该技术也存在学习曲线,需要具备术中经食管超声心动图(TEE)技能的心脏麻醉医师参与,不仅要明确识别二尖瓣病变(如图2所示)并指导手术,还要确保外周插管时导管定位正确。
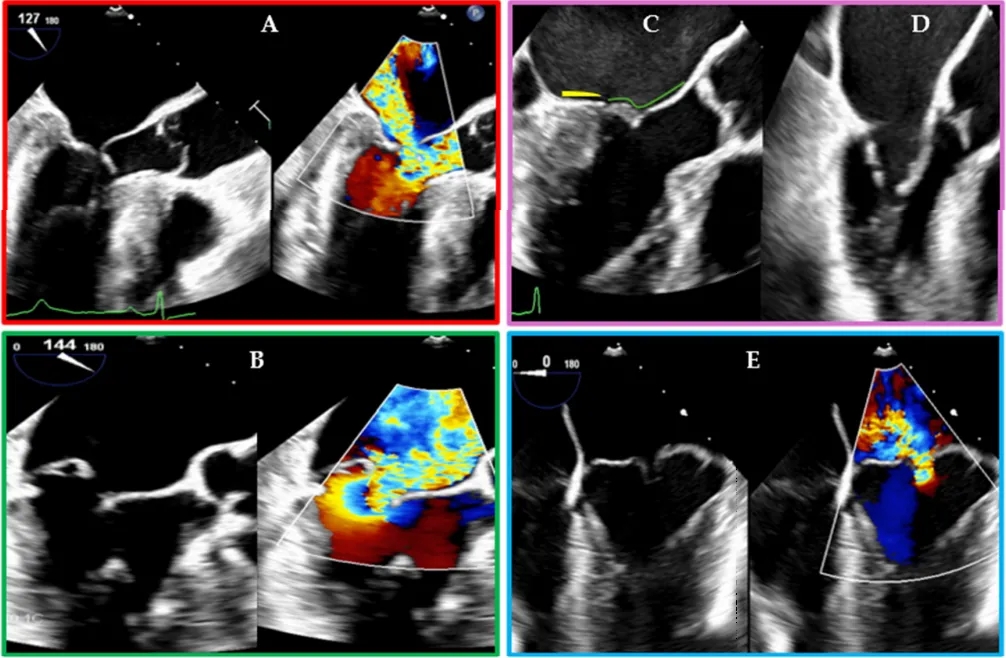
图2.导致二尖瓣反流的不同二尖瓣病变的经食管超声心动图表现:(A)因室间隔基底段肥厚和左心室腔狭小导致二尖瓣叶收缩期前向运动引起的二尖瓣反流;(B)二尖瓣后叶(PML)脱垂引起的二尖瓣反流;(C)心房功能性二尖瓣反流病例:注意二尖瓣后叶的附着点(黄线)向后移位至左心室嵴上方,使其看起来较短,且接合区也向后移位;绿线描绘二尖瓣前叶;(D)风湿性二尖瓣疾病引起的二尖瓣反流病例:注意二尖瓣叶舒张期呈圆顶状;(E)二尖瓣前叶和后叶双叶脱垂引起的二尖瓣反流;(A、B、E)图同时显示二维模式和二维彩色多普勒图像。
介入治疗进展
过去十年,经导管二尖瓣修复术取得了显著进展,为被认为传统手术高危或无法手术的患者改变了治疗格局。与主动脉瓣不同(经导管技术现已成为常规方法),二尖瓣由于其复杂的瓣下结构、动态瓣环和多变的病变,带来了独特的解剖和功能挑战。尽管如此,基于导管的技术(包括经导管缘对缘修复术、瓣环成形术和人工腱索技术)的发展,已能够通过经皮或经心尖入路成功治疗部分二尖瓣反流病例。
介入技术最初针对功能性二尖瓣反流和晚期心力衰竭患者,如今正越来越多地应用于退行性二尖瓣反流患者,既可作为手术的过渡治疗,也可作为体弱患者的确定性治疗 。一项正在进行的随机对照试验正在研究经导管缘对缘修复术与外科二尖瓣修复术在 65岁及以上退行性二尖瓣反流且无其他心脏手术指征患者中的疗效和安全性对比(NCT05051033)。
1
经导管缘对缘修复术
经导管缘对缘修复术已成为最成熟的经导管二尖瓣修复术形式,主要通过MitraClip 系统以及随后的PASCAL系统实现。受阿尔菲里手术技术的启发,这些装置旨在通过在反流束起源处对合二尖瓣前叶和后叶来减少二尖瓣反流,从而改善瓣膜接合。
MitraClip系统已在欧洲和美国广泛应用并获得监管批准,用于治疗有症状的高危或无法手术的退行性二尖瓣反流和功能性二尖瓣反流患者。EVEREST II 试验提供了支持其疗效的有力证据,该试验表明,与手术相比,MitraClip系统具有相似的长期生存率和功能改善,且手术创伤更小,尽管在退行性二尖瓣反流患者中残余二尖瓣反流率和再次干预率更高。更具说服力的是,COAPT试验表明,对于尽管接受了最佳药物治疗但仍有症状的功能性二尖瓣反流患者,MitraClip系统显著降低了心力衰竭住院率并改善了生存率,为该人群建立了新的护理标准。RESHAPE-HF2和 MATTERHORN试验进一步完善了这一证据,分别证明了在功能性二尖瓣反流程度较低和心力衰竭严重程度较轻的患者中,MitraClip系统具有临床获益,且与手术方法相比具有非劣效性。
PASCAL系统进行了设计改进,例如中央间隔器、独立瓣叶抓取功能(新一代 MitraClip装置后来也采用了这一功能)以及更宽的装置轮廓,旨在增强瓣叶捕获并减少张力。CLASP研究的数据表明,即使在解剖结构具有挑战性的病例中,该系统也具有良好的手术成功率和二尖瓣反流减少效果。
影像引导(尤其是三维经食管超声心动图)在患者选择、装置定位和术后结果评估中起着关键作用。尽管经导管缘对缘修复术为二尖瓣反流提供了一种经皮且耐受性良好的解决方案,但仍存在局限性,尤其是在复杂或不可行的解剖结构情况下。此外,经导管缘对缘修复术的另一个固有局限性是缺乏通过瓣环成形术实现的瓣环稳定,而瓣环成形术是外科手术中二尖瓣修复术耐用性的基石,因此需要开发辅助治疗和联合介入方法。
2
瓣环成形术装置和腱索置换系统
除经导管缘对缘修复术外,经导管瓣环成形术和腱索置换系统已成为解决特定二尖瓣反流机制(尤其是瓣环扩张和腱索断裂)的补充或替代策略。这些装置旨在通过基于导管的方法复制外科技术,分别特别适用于以瓣环扩张为主的功能性二尖瓣反流或涉及孤立腱索病变的退行性二尖瓣反流。
在间接瓣环成形术系统中,Carillon二尖瓣轮廓系统利用冠状窦作为锚定点,沿二尖瓣环施加张力,从而减小瓣环尺寸。REDUCE-FMR试验表明,与单纯标准药物治疗相比,Carillon系统显著减少了反流容积和左心室容积。然而,冠状窦与二尖瓣环之间的解剖变异性可能会影响装置的疗效和安全性,尤其是存在冠状动脉受压风险时。
在直接瓣环成形术系统中,Cardioband系统通过经房间隔入路直接固定在二尖瓣后环上,并允许术中收紧。在一项针对使用Cardioband系统治疗功能性二尖瓣反流的单臂前瞻性多中心研究中,该装置显示出令人满意的安全性和有效性。1年后,大多数患者的二尖瓣反流程度为中度或以下,且功能状态得到显著改善。
在腱索置换领域,NeoChord DS1000系统和HARPOON TSD-5系统提供经心尖、心脏不停跳入路至二尖瓣,能够为孤立瓣叶脱垂患者靶向植入人工腱索。这些系统在具有良好解剖结构的选定患者中,在手术成功率、瓣叶稳定和持久减少二尖瓣反流方面显示出良好的结果。尽管这些系统仍未得到充分利用,在经验丰富的医疗中心外应用有限,但它们体现了经导管二尖瓣修复术日益增长的多功能性。然而,从技术角度来看,与经导管方法相比,外科手术方法允许进行更复杂和多样化的人工腱索植入,而经导管方法的手术受到入路部位和装置性能的限制(图3)。
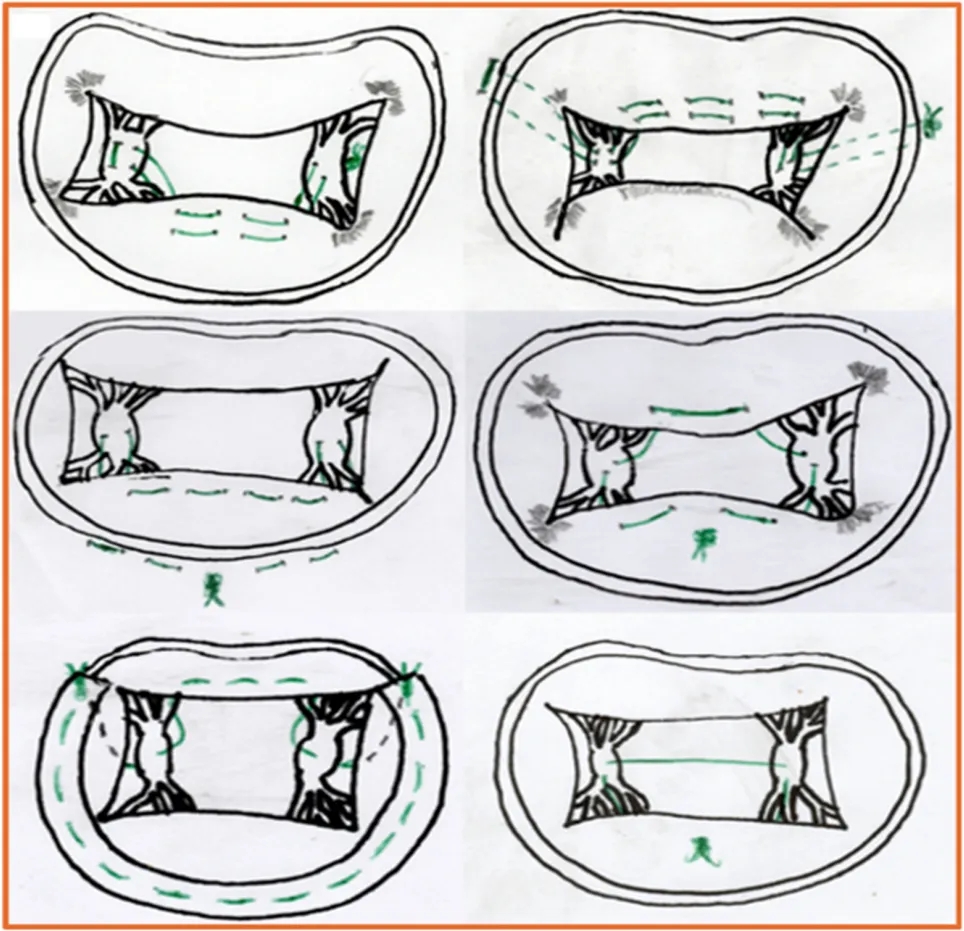
图3.不同外科腱索植入技术的示意图:从左上角开始顺时针方向,展示了以下外科技术:罗马拱技术、米诺陶技术、“V”形技术、方形技术、ARGO技术和束带技术;缝线以绿色表示;在某些情况下,绘制了虚线以更好地描绘缝线的路径。
3
患者选择与手术预后
适当的患者选择对于外科二尖瓣修复术和经导管二尖瓣修复术的成功至关重要。对于采用微创方法治疗的外科患者,任何增加并发症风险、修复失败风险或转为全胸骨切开术风险的因素,都可能抵消微创方法的优势,甚至可能导致比计划的传统手术更差的结果。大多数修复手术(图4)都能成功进行,尤其是在退行性二尖瓣反流患者中。然而,二尖瓣环钙化或风湿性心脏病可能难以(甚至无法)通过这种方法有效治疗。
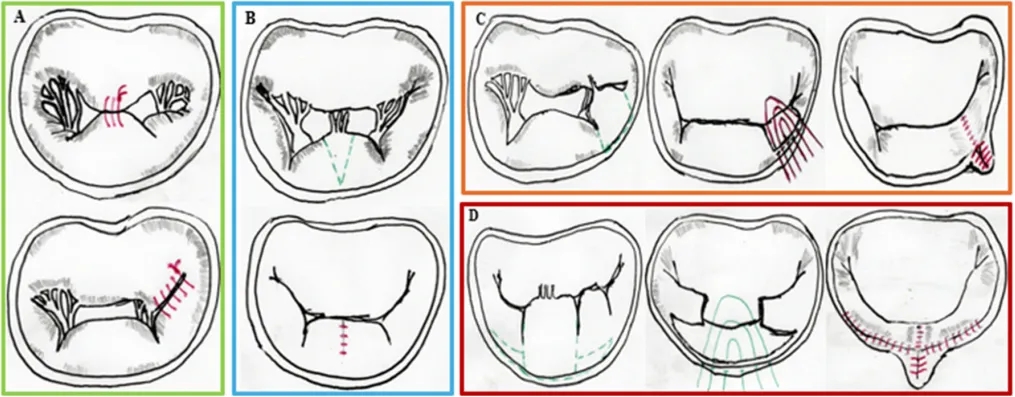
图4.外科二尖瓣修复术主要技术的示意图:(A)缘对缘缝合术(也称为阿尔菲里缝合术),分别位于A2-P2(上方)和A3-P3(下方)位置;(B)三角形切除术:绿色虚线表示瓣叶切除部位(上方);平行的红色实线代表切除后随后的瓣叶缝合(下方);(C)带瓣环折叠的四边形切除术:绿色虚线代表将要进行切除的部位(P2M2P3);红色实线是将要放置的瓣环折叠缝线;平行的红色实线代表修复结束时的缝线;(D)带滑动成形术的四边形切除术:切除部位由绿色虚线划定;绿色实线代表缝线;红色实线表示最终结果。
同期手术(如三尖瓣修复术、心房颤动消融术或房间隔缺损修补术)并非微创二尖瓣修复术的禁忌证,在经验丰富的医疗中心,这些手术通常可通过该方法进行。尽管如此,需要认识到这些手术会增加额外的手术时间。同样,先前通过开胸进行的胸部手术或存在广泛的胸膜肺粘连可能是一个重要的限制因素。如果存在严重的肺和胸膜粘连,分离时间可能会更长,而严重的肺气肿可能导致延长呼吸机依赖;这些方面都必须加以考虑。相反,同期冠状动脉旁路移植术的需求是该方法的一个重大障碍,尤其是在计划采用机器人辅助方法时,因为这既增加了复杂性,又延长了手术时间。然而,对于单支或双支血管疾病患者,采用经皮血运重建的分期混合策略可能是一种切实可行的替代方案。当使用经胸主动脉夹时,轻度主动脉扩张通常不排除微创二尖瓣修复术的可能性,而升主动脉瘤则不然,同时考虑到当主动脉直径≥40毫米时,主动脉内球囊阻断不可行。中度以上主动脉反流可能会影响心肌保护的效果。胸腹主动脉和髂股动脉的广泛钙化会增加逆行血流导致脑栓塞的风险,应被视为股动脉插管的禁忌证。在这些情况下,腋动脉插管可能是一种可行的替代方案。严重肺动脉高压也是术后并发症的一个危险因素。在患者相关因素中,年龄并非真正的禁忌证,但对于存在胸壁畸形、严重肥胖或体型非常小的患者,微创二尖瓣修复术通常不可行。
关于经导管二尖瓣修复术,每种技术都有其适宜和不适宜的解剖结构。一般来说,活动性心内膜炎、血流动力学显著的二尖瓣狭窄和抓取区域的严重钙化是该手术的明确禁忌证。如果选择经房间隔入路,必须识别出使该手术不可行的解剖结构,例如下腔静脉中断(如腔静脉滤器)或房间隔血栓。在这种情况下,可以考虑冠状窦瓣环成形术或经心尖入路。
微创二尖瓣修复术的手术预后在短期和长期的有效性和安全性方面都非常出色。此外,选择一种方法而非另一种方法似乎不会对主要临床结果(如短期和长期死亡率或长期再次手术率)产生负面影响。
关于经导管二尖瓣修复术,必须区分退行性二尖瓣反流和功能性二尖瓣反流。在退行性二尖瓣反流中,已发表的经验主要来自EVEREST II、CLASP、TACT和TRACER 试验,这些试验探索了不同经导管二尖瓣修复术系统的安全性和有效性。迄今为止,唯一可用的经导管二尖瓣修复术与外科二尖瓣修复术直接对比研究的数据显示,经导管二尖瓣修复术的术后不良事件发生率更低,这主要是由于机械通气时间延长和输血风险降低。再次干预的高风险仅限于前6个月,之后差异不再显著。最近的一项回顾性研究进一步表明,对于由后叶脱垂引起的退行性二尖瓣反流,与经导管缘对缘修复术相比,外科二尖瓣修复术在中期随访中确保了更高的耐用性。在功能性二尖瓣反流中,经导管方法的获益不仅在心室功能性二尖瓣反流中得到证实,在新发现的心房功能性二尖瓣反流中也得到了证实。然而,值得注意的是,外科手术方法允许在单次手术中治疗多种病变。
另一个值得注意的方面是,在外科二尖瓣修复术和经导管二尖瓣修复术中,医疗机构每月的手术量越高,手术成功率越高,住院时间越短,长期主要临床结果(包括生存率、心脏死亡率、心力衰竭住院率和再次手术率)也越好。
4
个性化治疗策略
随着二尖瓣介入治疗变得越来越多样化和复杂,以详细的解剖、功能和临床特征分析为指导的个性化方法已成为优化患者预后的关键。个性化治疗策略现在是当代二尖瓣修复术实践的核心,尤其是在高危和解剖结构复杂的患者中(图5)。
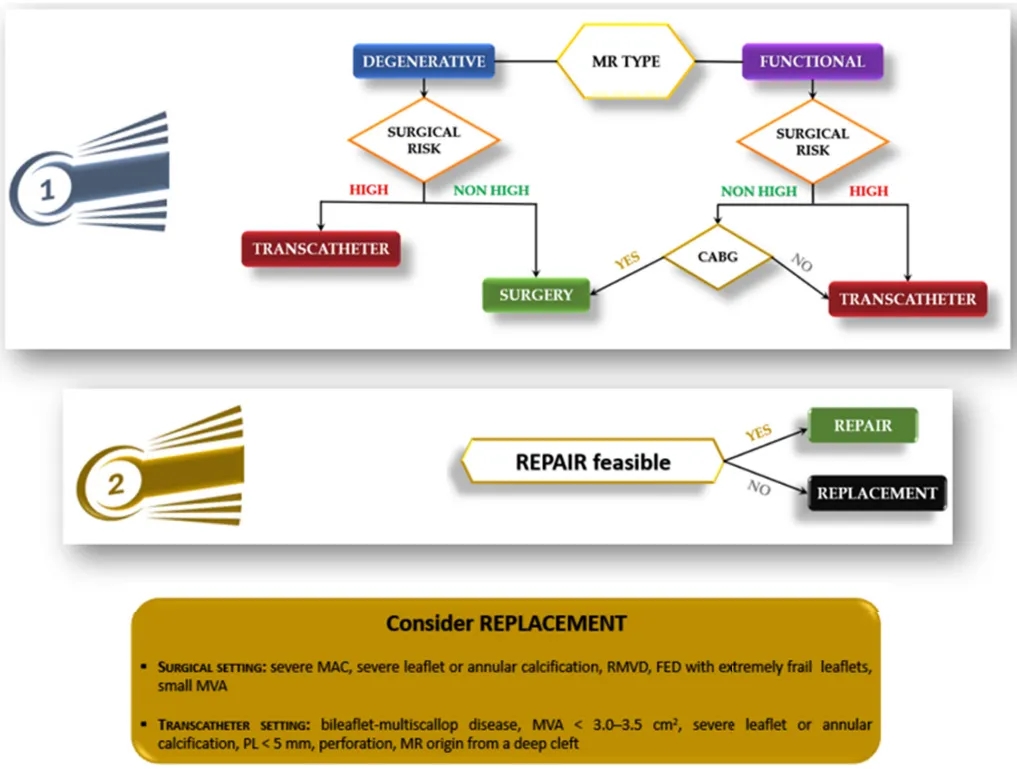
图5.二尖瓣反流治疗策略流程图:(1)第一步基于潜在病因(退行性二尖瓣反流与功能性二尖瓣反流)和患者的手术风险,指导选择外科或经导管方法;(2)一旦确定需要介入治疗,修复与置换的决策取决于可行性以及应考虑瓣膜置换的特定解剖条件(黄色框中突出显示)。
影像整合(经食管超声心动图和计算机断层扫描)在规划中的应用
先进的心脏影像技术是个性化二尖瓣治疗的核心,是患者选择、手术规划和术中指导的基石。
全面评估瓣膜解剖结构、识别病变节段以及了解二尖瓣反流的病理生理机制,对于选择适当的修复策略和实现最佳手术效果至关重要。
传统上,二维成像一直是评估二尖瓣装置、识别二尖瓣反流机制、预测二尖瓣修复术后并发症的基石;然而,二维成像在空间定位、深度感知方面存在局限性,且需要对二尖瓣复杂的三维结构进行心理重建,这可能会降低诊断准确性和可信度。三维经食管超声心动图提供了二尖瓣的实时正面视图(图6),增强了外科医生识别脱垂、连枷或裂隙病变的能力,尤其是在复杂的双叶或交界区疾病中。
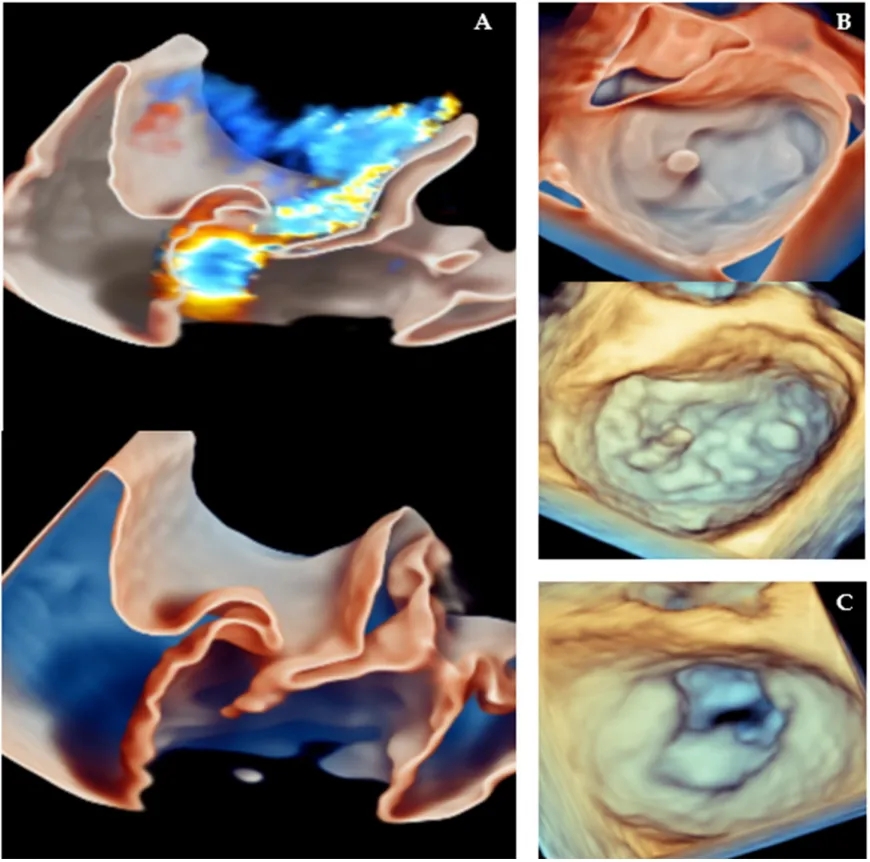
图6.导致二尖瓣反流的二尖瓣病变的三维经食管超声心动图表现:(A)使用玻璃渲染模式显示的二尖瓣后叶连枷,分别为带三维彩色(上方)和不带三维彩色(下方);(B)二尖瓣的“正面” 视图,显示二尖瓣后叶P1扇叶小部分的连枷,分别为带玻璃渲染模式(上方)和不带玻璃渲染模式(下方);(C)二尖瓣反流患者风湿性二尖瓣的“正面”视图(本例中二尖瓣修复术不可行)。
在无胸腔插管的方法中,所有体外循环和心脏停搏液导管均经皮插入,并通过术中二维经食管超声心动图指导和监测其放置和功能。静脉流出道导管分别通过股静脉和颈静脉插入下腔静脉和上腔静脉。动脉流入导管是一种球囊尖端导管,用于输送心脏停搏液、血管内阻断和有创压力监测,通过股动脉插入降主动脉。当选择血管内入路进行升主动脉阻断时,经食管超声心动图是评估球囊定位和充气是否恰当的唯一方法,这两者对于有效主动脉阻断至关重要。经食管超声心动图在经导管方法的术中指导以及外科二尖瓣修复术和经导管二尖瓣修复术的术后结果评估中也起着关键作用。三维成像和重建技术(包括三维经食管超声心动图、计算机断层扫描和心脏磁共振成像)的整合,极大地改善了术前和术中的瓣膜评估。
计算机断层扫描越来越被认为是评估微创二尖瓣修复术解剖可行性和优化手术规划的宝贵工具。它能精确评估胸腔解剖结构、主动脉位置、冠状动脉和主动脉疾病以及外周血管入路,这对于确定微创方法在技术上是否可行和安全至关重要。关于经导管二尖瓣修复术,当选择直接瓣环成形术和腱索修复技术时,计算机断层扫描在术前评估中的作用已得到确认。对于前者,旨在评估二尖瓣环几何结构及其与回旋支动脉的关系;对于后者,旨在确定装置的最佳入路部位。
风险分层与治疗算法
二尖瓣反流的有效管理依赖于个体化风险分层,以指导治疗决策。传统风险模型(如 STS评分和EuroSCORE II)提供了围手术期发病率和死亡率的重要估计,但作为独立工具使用时可能不够充分。这些模型应用于当代接受经导管二尖瓣介入治疗的人群时,准确性有限。此外,它们在经导管缘对缘修复术人群中的准确性也有限。认识到这些局限性,最近开发并验证了专门的模型(COAPT风险评分和MitraScore),以应对该患者群体的特定风险特征。
多项研究一致表明,对衰弱程度、合并症负担、功能能力和认知状态的额外评估能提高预后准确性,因为这些因素独立预测外科和经导管介入治疗后的不良结果。患者偏好(通常受感知生活质量和恢复期望的影响)也是决策过程的重要组成部分。
多学科心脏团队将这些参数与解剖和手术考虑因素整合到治疗算法中,确保决策不仅反映手术可行性,还反映患者更广泛的临床背景和预期寿命。基于临床指南、风险评估和患者价值观的共同决策,是选择最佳策略(无论是外科二尖瓣修复术、经导管二尖瓣修复术、传统或微创方法,还是保守治疗)的基础。
新兴模型正越来越多地整合人口统计学、临床、影像衍生标志物和实验室参数,以完善外科和经导管队列的这些算法。
未来方向
在装置设计、影像技术、计算建模和临床研究创新的推动下,二尖瓣修复术的领域继续快速发展。
未来用于经导管手术的下一代装置应设计为具有良好的安全性、较短的学习曲线、更低的手术创伤和复杂性、更广泛适用于各种病变和解剖结构,并提高耐用性,同时旨在进一步加强治疗的个性化。新兴的联合治疗(将瓣环成形术与经导管缘对缘修复术或腱索置换相结合)寻求通过经导管方法复制外科修复术的全面性。这些策略在混合病变中可能特别有益,因为在混合病变中,单独的瓣叶或瓣环策略通常被证明是不够的。
先进的影像工具(如四维计算机断层扫描、融合超声心动图和增强现实引导)正在开发中,以支持精准介入治疗。此外,人工智能和机器学习正越来越多地整合到手术规划中(也使用虚拟现实和增强现实),为风险分层、装置选择优化、结果和并发症预测以及随访策略个性化提供预测分析。
此外,全球注册数据库和适应性临床试验的持续发展将支持装置的迭代开发和上市后评估,有助于完善适应症和扩大治疗选择范围。在这方面,正在进行的 REPAIR MR 试验(NCT04198870)和PRIMARY试验(NCT05051033)将通过比较外科和经导管方法治疗退行性二尖瓣反流的有效性,进一步阐明二尖瓣修复术领域。
综上所述,这些进展将推动二尖瓣修复术向精准引导、数据增强治疗转变,使二尖瓣修复术成为一门高度个体化、循证的学科。
结论
二尖瓣修复术已进入一个以技术创新、微创策略和个性化治疗路径为特征的新时代。机器人辅助和三维引导技术等外科进展提高了手术精度,同时降低了手术发病率。与此同时,经导管治疗(尤其是经导管缘对缘修复术和新兴的经导管二尖瓣修复术平台)为高危患者提供了更多治疗选择。
正在进行的临床试验、基于人工智能的手术规划整合以及下一代装置,有望进一步改善预后和耐用性。未来成功的关键将是继续完善患者选择算法,并利用多模态成像来定制治疗方案。
随着这些创新的成熟,二尖瓣修复术将变得越来越个性化、数据化和微创化,为更广泛的患者提供耐用、改善生活质量的治疗。
参考文献:
Rolando M, Affronti A, Loreni F, Bergonzini M, Carluccio E, Fortuni F. Mitral Valve Repair in the Modern Era: Insights into Techniques and Technologies with a Glimpse of the Future. J Clin Med. 2025 Oct 14;14(20):7251. doi: 10.3390/jcm14207251.
-END-
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系

发表留言
暂无留言
输入您的留言参与专家互动