潘文志教授:二尖瓣反流介入治疗技术进展及困境
导语:2003年Mitraclip的诞生,开启了二尖瓣反流介入治疗的征程。如今,20年已过去,二尖瓣反流(MR)介入治疗积累了大量循证医学证据,并逐步迈向创新发展之路。作为经导管二尖瓣缘对缘技术(TEER)的代表器械,MitraClip(二尖瓣嵌夹术)的可行性和安全性已被Everst-Ⅱ研究所证实,2015年这项关键性研究公布了5年随访结果,该研究将患者随机分配为外科手术组(N=80)和MitraClip组(N=178),提示从6个月起,夹子稳定,瓣膜反流情况和外科手术相当。
此外,新进的研究也显示在一些患者中,短期和一年的效果跟外科不相上下。或许,正是TEER这项技术的诸多优势符合了介入的原理和理念,促使它可以长久存在和发展下去。我们可以将它的优势理解成,只消除了病变部位,而不影响未干预部位的正常开放或闭合功能,相较其他介入技术而言干扰最小,也非常符合介入器材设计的理念。COPAT研究也验证了对于HFrEF合并MR患者,TEER治疗效果卓越,价值较大。TEER还被欧美指南列入外科手术高危、解剖合适MR患者的适应证。

结合我国目前的现状,TEER这项技术究竟面临着怎样的现状和挑战,同样作为二尖瓣反流介入治疗领域的重要治疗手段之一的TMVR(经导管二尖瓣置换术)器械研发面临的困境又在哪里,复旦大学附属中山医院潘文志教授从临床和科研角度出发,带来了他的理解。

TEER的五大现状
现状一:新一代TEER器械性能提高,学习曲线及手术时间缩短。
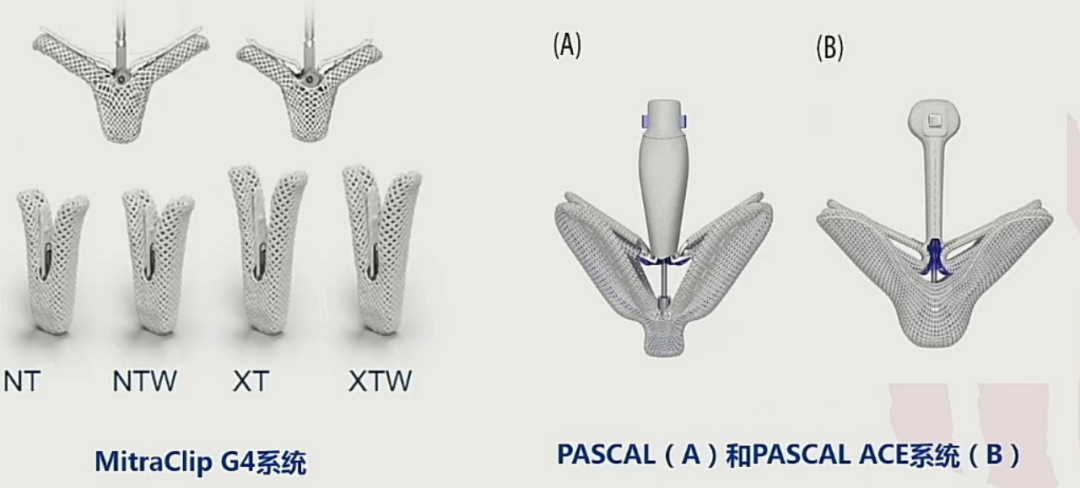
目前 MitraClip已经进入第4代,称为 MitraClip G4 system,目前已获得 FDA 及CE认证。新系统提供4种夹子尺寸(两种宽度×两种长度),可以单独捕获二尖瓣瓣叶,还可以提供心房压力监测,以实时监测手术效果。在新近发表1篇G4研究中,入选59例患者,2/3患者植入2个以上夹子,30 d二尖瓣反流≤2 级的成功率为 96.6%,二尖瓣反流≤1 级成功率为 93.0%,显示了良好治疗效果。PASCAL系统技术原理同MitraClip,也是经股静脉穿房间隔的TEER器械。它的夹合臂更宽、更长,且可以两边分别夹合,中间具有隔离可以降低瓣膜张力,其夹合臂锁定方式为弹性自锁。
复旦大学附属中山医院葛均波院士与上海捍宇医疗合作研发的器械 ValveClamp为经心尖TEER器械,具有入路短直,操控简便;夹臂平移,更易捕获;以小治大,无需二夹;单纯超声,避免辐射的独特优势,由于闭合环的卷缩效应,4mm夹子产生8mm对合,二夹比例低于10%。
现状二:TEER效果明显提升,向外科手术水平接近!
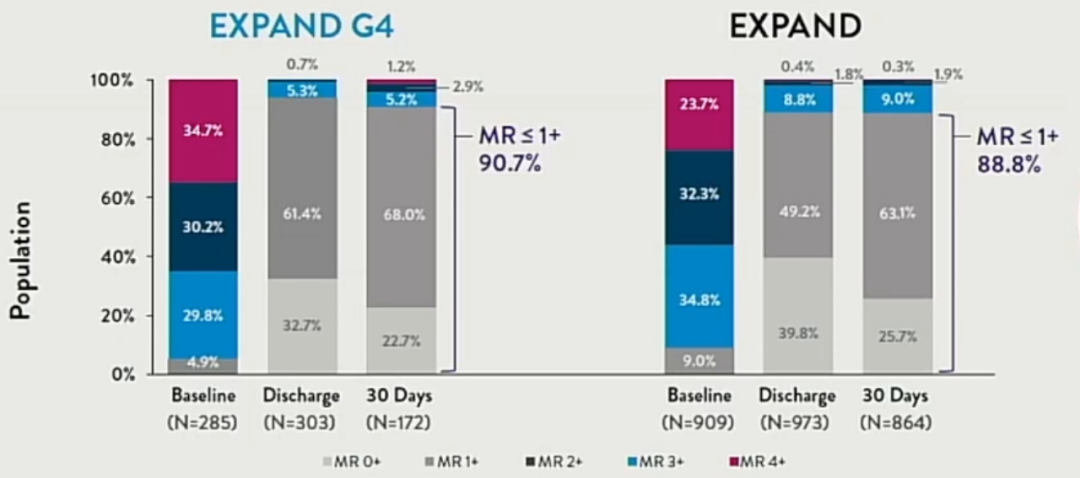
在研究一年随访中可见,TEER实现MR≤1+可达到90%左右。
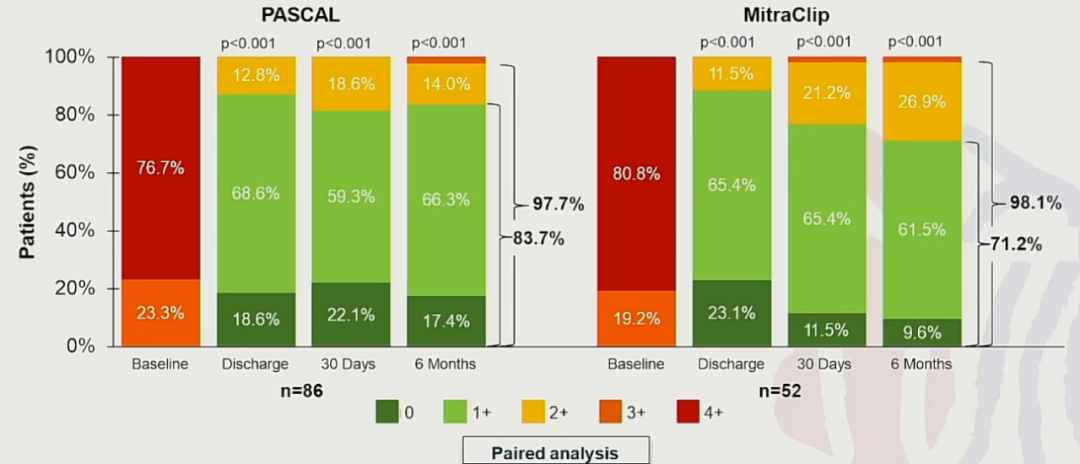
CLASPⅡD研究也现实了PASCAL和MitraClip器械都取得了不错的效果,研究显示在6个月时,PASCAL的MR≤1+可达到83.7%,MitraClip的MR≤1+可达到71.2%。
由此可见,随着产品迭代及经验积累,TEER效果持续提升。
现状三:扩大TEER 适应证临床研究正在开展
扩大TEER适应证包括A1P1或A3P3连枷/脱垂、联合连枷/脱垂、手术修复失败、Clips夹合器的使用、伴有MR的终末期心力衰竭、合并AS和MR、MR伴有严重MAC、低位/中危原发性MR。

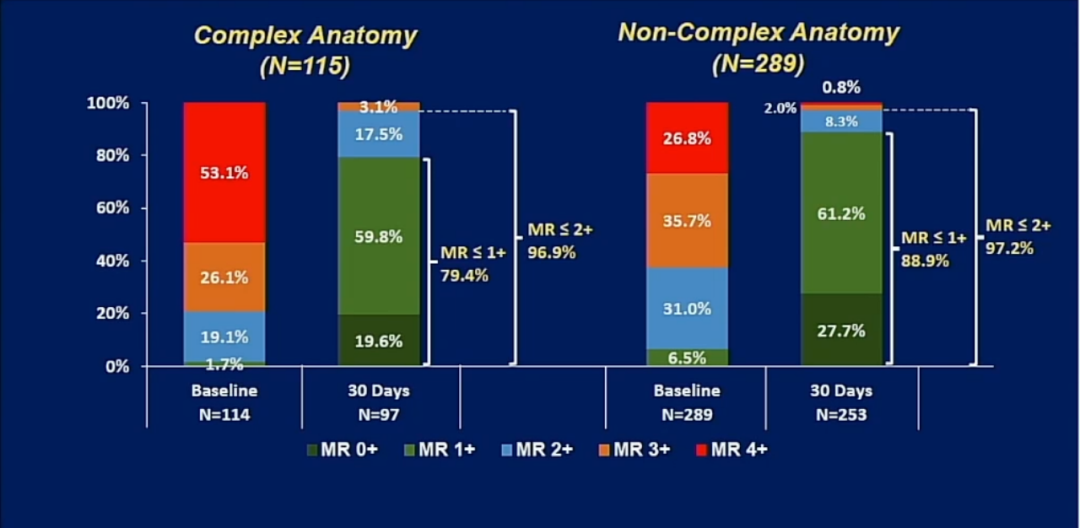
在EXPAND研究中,可见复杂病例和简单病例的效果相当。
现状四:经股静脉(TS-)TMVR器械成为新趋势
目前已有个案报道:对于TEER术后复发,经导管切断缘对缘连接处,再行二尖瓣瓣膜置换(MVR)。
现状五:其他新型器械正在探索
器械设计改进升级方面,目前经股静脉的TEER仍不是很完美,存在着设计过于复杂、操作不够简便、效果仍有提高空间等缺点,有待于新一代器械的开发。
上述讲到了目前TEER的技术现状和进展,那二尖瓣反流修复介入,困境在哪里?
TEER的六大困境
困境一:解剖适应证有限
TEER解剖适应证有限,约20%理想,40%合适;腱索修复,约5%合适。
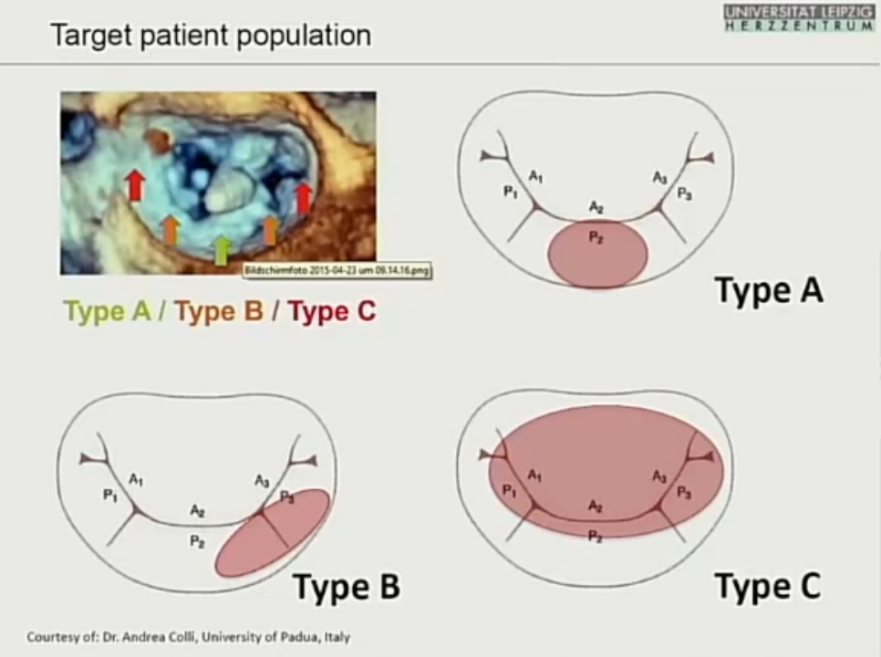
困境二:FMR动态变化,药物影响大。
MR具有动态特征,其严重程度随左室负荷变化而变化。与清醒状态下TTE评估相比,TEE术中的镇静和血压降低可能会显著降低MR的严重程度。高血压急症出现严重的MR,通过控制血压可显著改善。二尖瓣脱垂和肥厚性梗阻性心肌病,降低左室前负荷的治疗,MR的严重程度将增加。肥厚性梗阻性心肌病,后负荷的减少预计也会增加MR的严重程度。
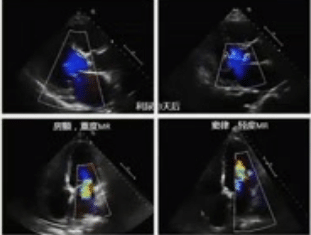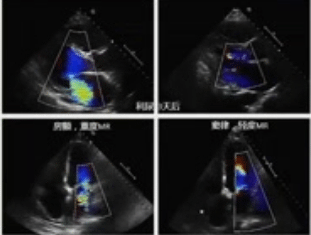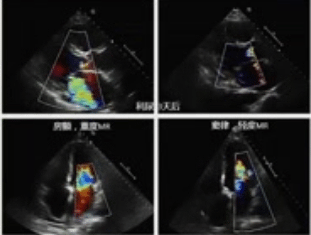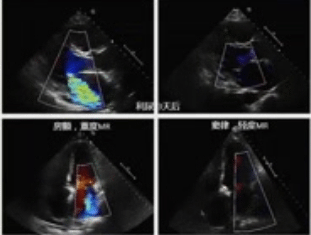
有严重心衰症状的缺血性心肌病患者
困境三:TEER术后复发难以再介入
TEER术后复发,再次进行TEER干预存在困难,可能引起进一步狭窄,很多情况下还是需要外科开刀。
困境四:TEER仍不够生理,可引起一定瓣膜狭窄。
在置入多枚夹子或使用夹合壁较宽的夹子,可以出现瓣口狭窄的问题。
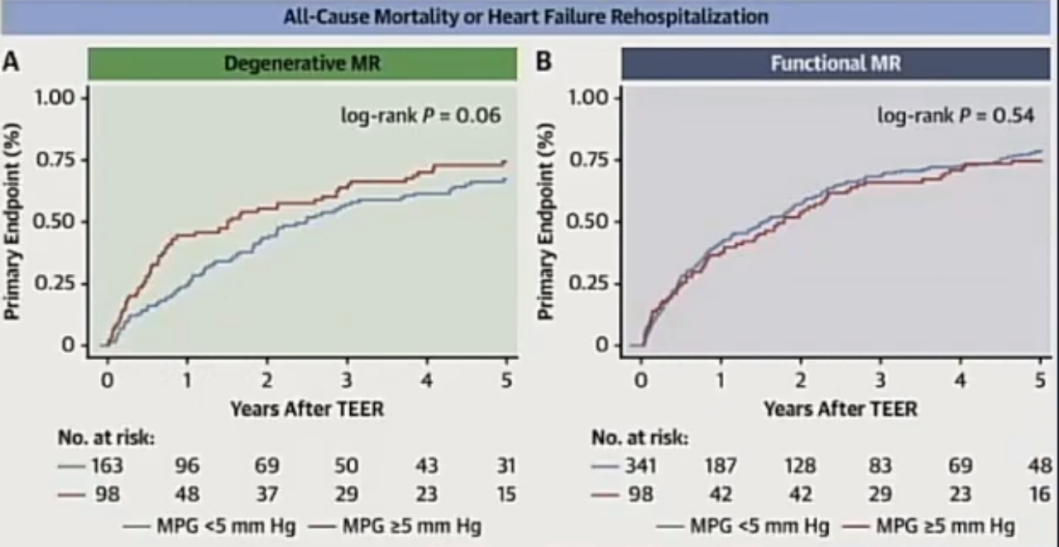
困境五:只针对单一的机制,中期结果良好,但长期耐久性还需要进一步数据。
目前临床研究大多只有一年随访数据,大规模应用时间较短,远期效果缺乏足够数据。
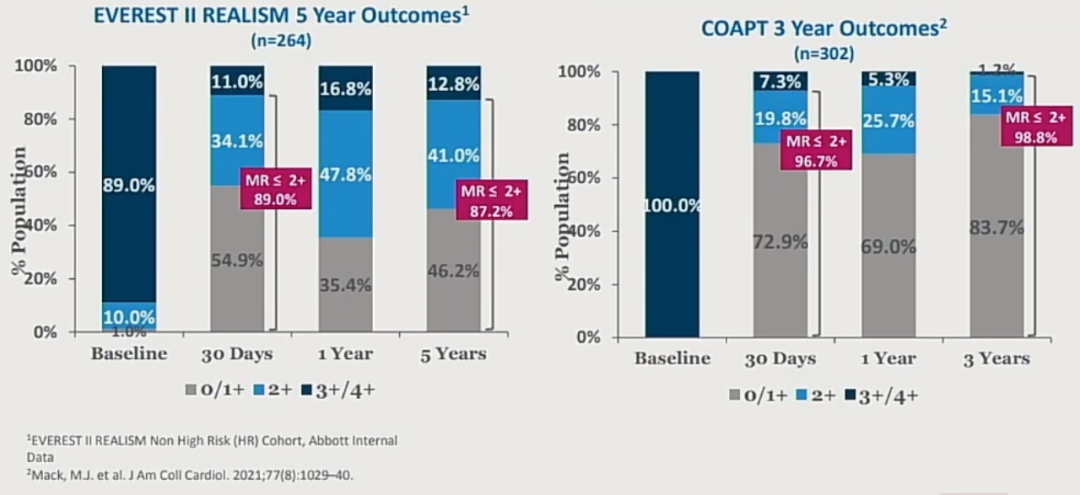
困境六:器械昂贵,学习曲线长,超声要求高,技术普及低。
经静脉途径TEER器械设计及操作相对复杂,学习曲线较长。在目前临床实践中对于一些挑战病例,经常耗费3-4小时导管操作时间才能完成手术。
目前来看,TMVR虽然取得了初步成功,但也难免面临一些现实的挑战。
TMVR研发的挑战
二尖瓣瓣叶较复杂。它不是圆形也不是“D”形,是不对称、不平整的“马鞍形”。它的瓣环不是静止的,而是“动态的”。它不是被动的,可以在收缩期减少瓣膜面积。它是一种高压关闭瓣,而不是高压开启瓣。在解剖上约有120根腱索附着在二尖瓣上,有24多根腱索附着到乳头肌上。二尖瓣阻断主动脉血液流出相对容易,它比主动脉瓣(AV)更容易形成血栓,而且比AV瓣环更大。在心力衰竭发生时,瓣环会改变大小。MR不是一种疾病。可以说二尖瓣复杂的解剖基础,使得TMVR器械的研发面临挑战。
那TMVR的研发,挑战在哪里?
挑战一:左心室流出道梗阻,难以避免的问题。
左心室流出道梗阻是难以避免的问题。这是因为自然瓣膜在心脏收缩时处于关闭状态,二尖瓣往心房内靠,若人工瓣膜锚定时把瓣膜往流出道方向推动,就会引起左室流出道梗阻(LVOTO)。
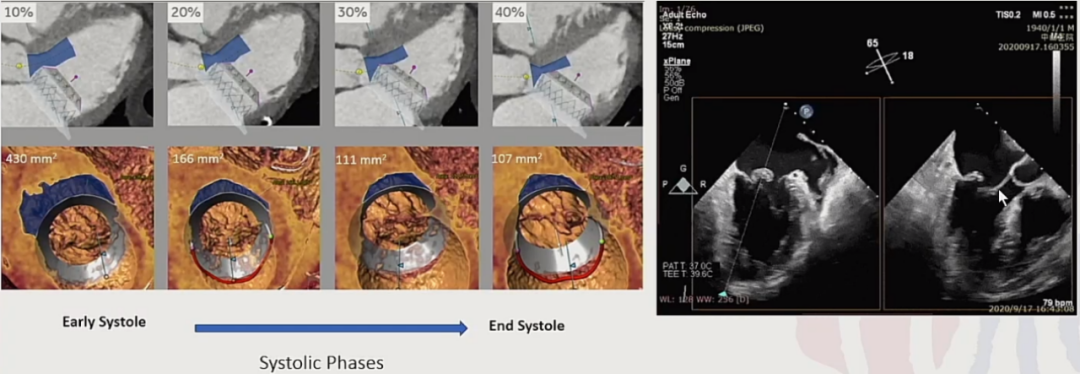
挑战二:不允许有瓣周漏存在,容易溶血。
为了减少流出道梗阻,需要短瓣架及收腰设计,必然导致瓣周漏可能性增加。
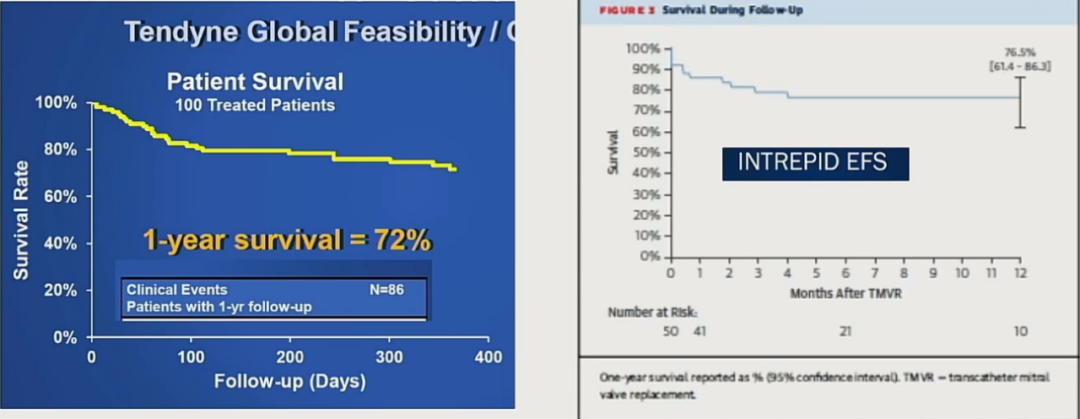
挑战三:长期生存率低,心律失常及血栓风险不能忽视。
在Tendyne和INTREPID研究中可见,1年和2年生存率都不是很理想,都有潜在的心律失常和血栓风险。
挑战四:瓣膜耐久性较TAVR要求高。
生物衰败方面,由于二尖瓣的大瓣环、高压力、低吊桥,导致瓣膜易衰败。
挑战五:输送尺寸大,实现经股难度极大,常引起血管出血。
由于二尖瓣的瓣架较大,输送尺寸就较大。
目前来说,理想的TMVR技术需要达到四层效果:使MOA适应TS输送和解剖变异;面向真实世界解剖学的细化设计(已实现);微型化和输送系统研发;影像规划+指导的演变;但实际上只达到了一层效应,未来道路还很漫长。
此外,TEER已成为治疗二尖瓣反流最重要也是最普及的治疗手段;现有TEER器械不断更新迭代,多种新型 TEER 治疗器械陆续登上临床,多项临床试验结果引导 TEER 更加科学规范地运用。同时TEER器械也不再都依赖进口,国产TEER器械的研发和转化,让中国大陆成为二尖瓣介入治疗的新阵地,相信在不久的未来,在这片广阔的新阵地上的丰硕成果,将对二尖瓣治疗经验的丰富,治疗技术的成熟做出积极的贡献。
专家简介
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。





发表留言
暂无留言
输入您的留言参与专家互动