潘文志教授:经导管二尖瓣(TMVR)器械研发的六层挑战
复旦大学附属中山医院潘文志教授在中国心血管健康大会上以“经导管二尖瓣置换(TMVR)器械研发的六层挑战”为题作汇报,从解剖学和临床应用等方面逐个剖析了TMVR器械研发所面临的六层挑战。整体来说,相对于TAVR(经导管主动脉瓣置换术),TMVR走得异常艰难,虽然取得初步成功,仍存在巨大挑战!

早在2012.6.12就有报道世界首例经导管二尖瓣置换(丹麦哥本哈根的瑞斯医院,Lars Sondergaard )经心尖植入 CardiAQ。第一例患者显示早期良好的植入和血流动力学结果,但3天后因多器官衰竭死亡。尸检没有发现任何瓣膜假体问题。
第二个TMVR 瓣膜 --Edwards Lifesciences Fortis瓣膜(2014年3月人体首例)

2014年,丹麦哥本哈根的瑞斯医院,Lars Sondergaard使用瓣膜CardiAQ第二代(Evoque的前身)完成第一个经股静脉TMVR手术,30F输送系统,snare辅助调弯,动静脉建立轨道。
Tendyne Mitral Valve使用超过1500例,Tendyne 2.0瓣膜还进行了改进(蓝色)。
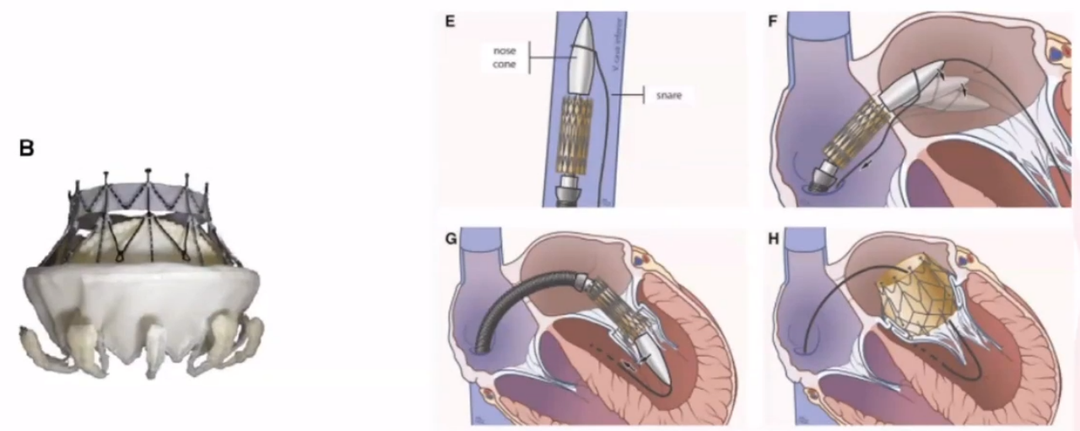
经股静脉(TS-)TMVR器械
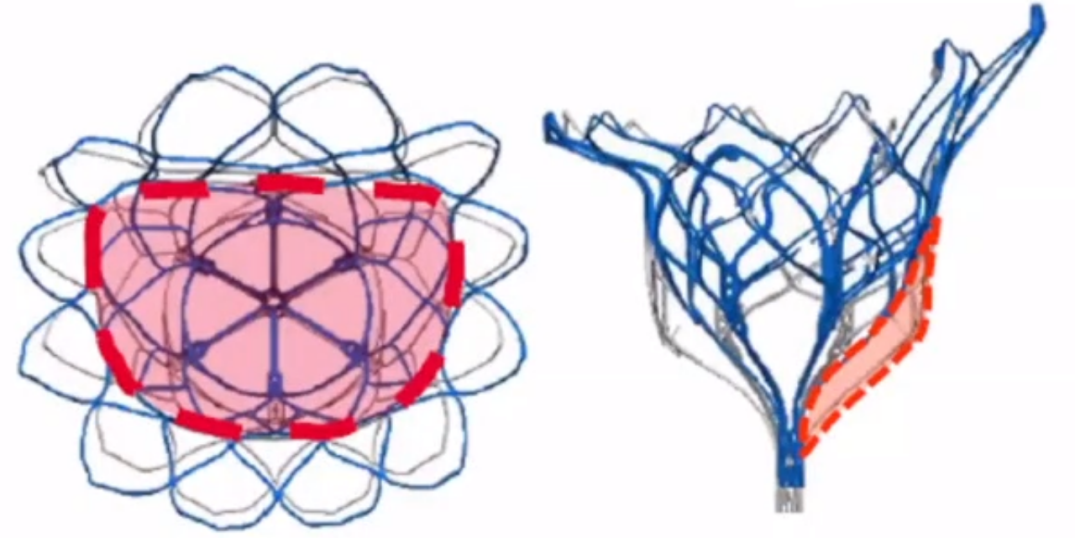
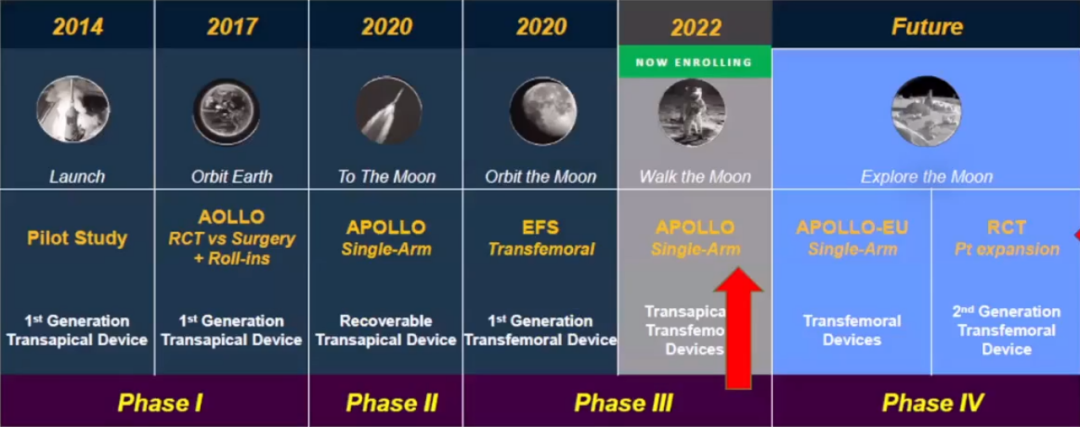
美敦力于2019年开启雄心勃勃的阿波罗试验,瓣膜采用双支架设计,解决解剖和生理挑战。试验设计评价美敦力IntrepidTM TMVR器械在严重症状性二尖瓣关闭不全患者中应用的安全性和有效性。主要研究终点是全因死亡、卒中、再手术(或再干预),以及1年后的心血管住院。最终,阿波罗试验于2022年暂停,改为单臂试验!预计将来在开展RCT。

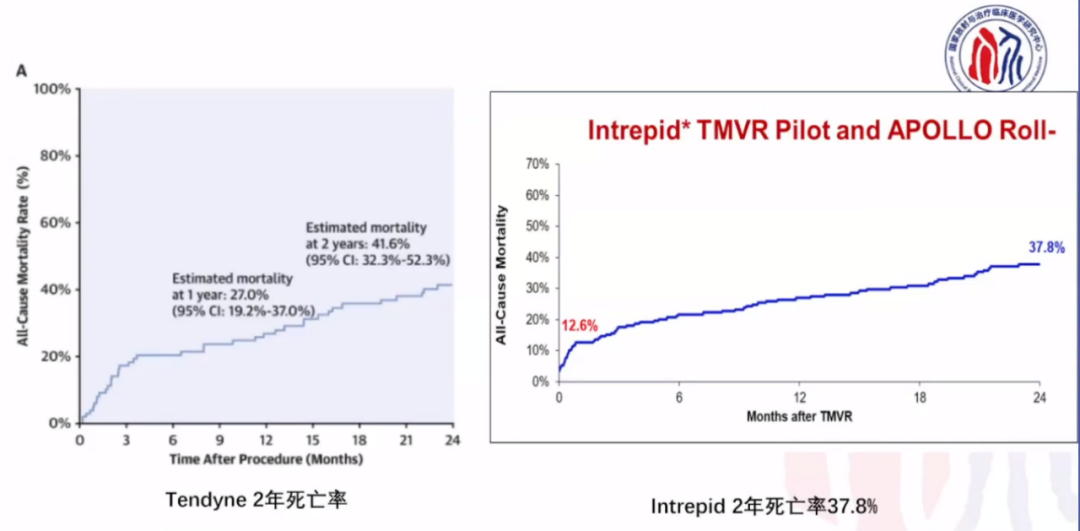
2021年JACC杂志报道了《严重症状性二尖瓣反流患者经导管二尖瓣置换术的 2 年结果》。在这项研究中,TMVR 对 MR 严重程度、HFH 率降低和症状改善的影响持续了 2 年。全因死亡率和对 HFH 的需求在术后前 3 个月内最高。
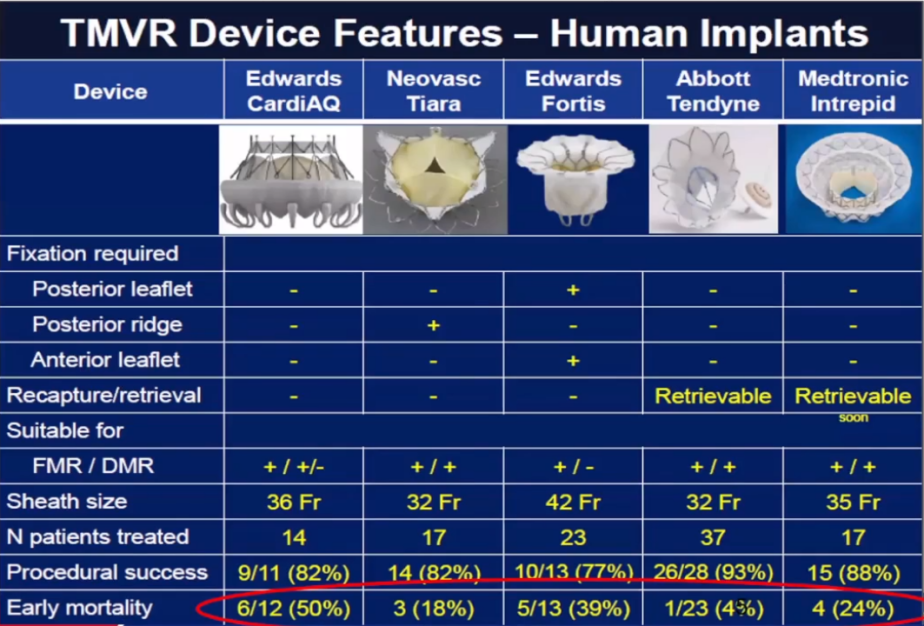
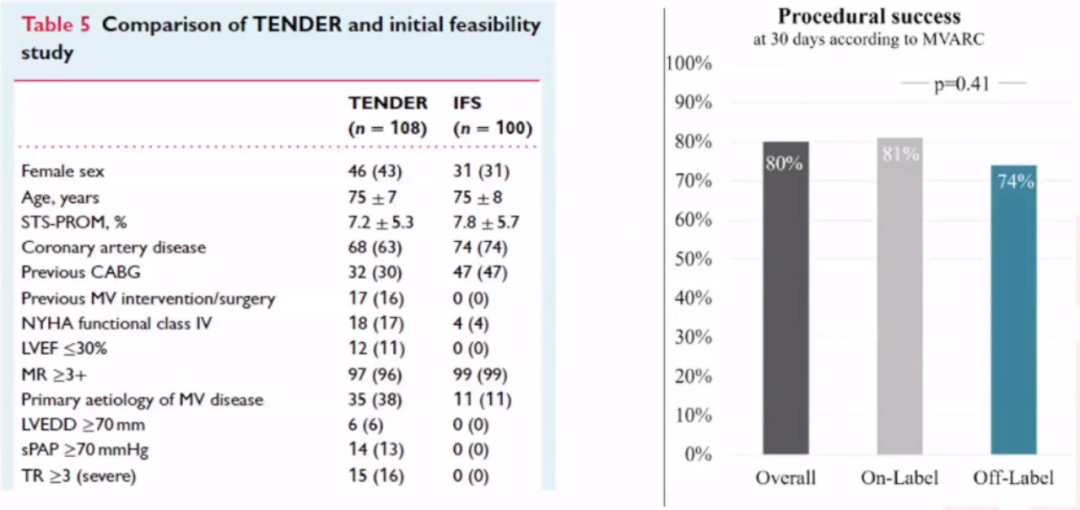
Tendnye 上市后真实世界的研究。2022年European Journal of Heart Failure杂志发布了《经心尖二尖瓣植入术治疗症状性二尖瓣疾病:真实世界的多中心经验》。技术成功率为96%,所有植入成功的患者均实现了 MR 降低至≤1+。有两例手术死亡,30天全因死亡率为12%。
二尖瓣瓣叶较复杂。它不是圆形也不是“D”形,是不对称、不平整地的,“马鞍形”。它的瓣环不是静止的,而是“动态的”。它不是被动的,可以在收缩期减少瓣膜面积。它是一种高压关闭瓣,而不是高压开启瓣。在解剖上约有120根腱索附着在二尖瓣上,有24根+腱索附着到乳头肌上。二尖瓣阻断主动脉血液流出相对容易,它比主动脉瓣(AV)更容易形成血栓,而且比AV瓣环更大。在心力衰竭发生时,瓣环会改变大小。MR(二尖瓣反流)不是一种疾病。可以说二尖瓣复杂的解剖基础,使得TMVR器械的研发面临挑战。
相对于TAVR(经导管主动脉瓣置换术),TMVR走得异常的艰难,虽然取得初步成功,仍存在巨大挑战!
第一层挑战:人工瓣膜锚定
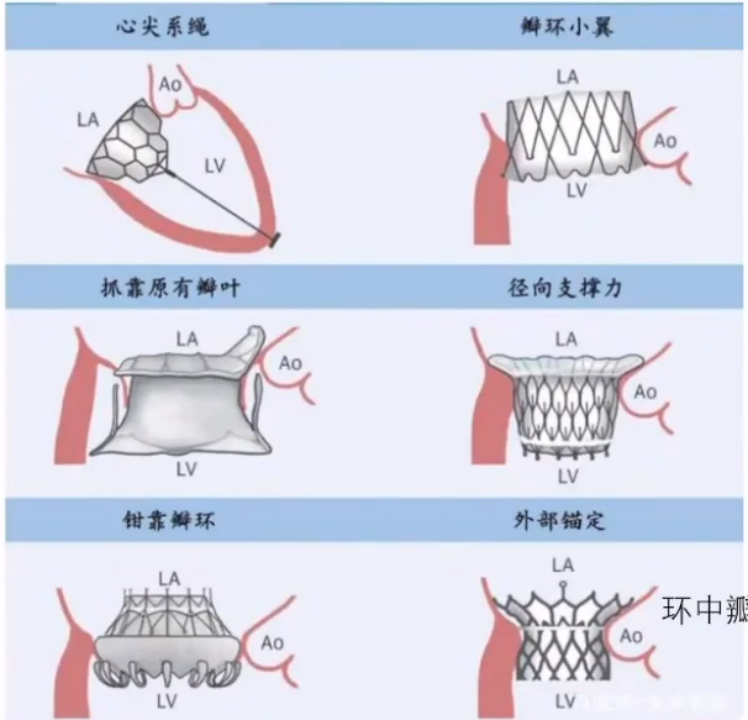
人工瓣膜锚定存在一些问题:组织无钙化,无轴向管道,瓣环有伸缩性,左心室收缩期腔内压力巨大,固定困难等。目前常用的七种方法提供了解决办法,包括心尖系绳、瓣环小翼、抓靠原有瓣叶、径向支撑力、钳靠瓣环、外部锚定以及环中瓣。
第二层挑战:流出道梗阻
左心室流出道梗阻是难以避免的问题。目前临床应用瓣膜或多或少都会出现梗阻问题,还没有瓣膜可以做到100%消除流出道梗阻。这是因为自然瓣膜在心脏收缩时处于关闭状态,二尖瓣往心房内靠,若人工瓣膜锚定时把瓣膜往流出道方向推动,就会引起左室流出道梗阻(LVOTO)。
CTA 是 TMVR 规划不可或缺的一部分,仔细测量neo-LVOT区域,这仍然是医源性 LVOTO 最重要的预测指标之一。通过将 TMVR 后 CTA 成像与长期结果数据相结合,进一步完善该方法,对于加强患者选择和模拟方法以及改善手术结果至关重要。
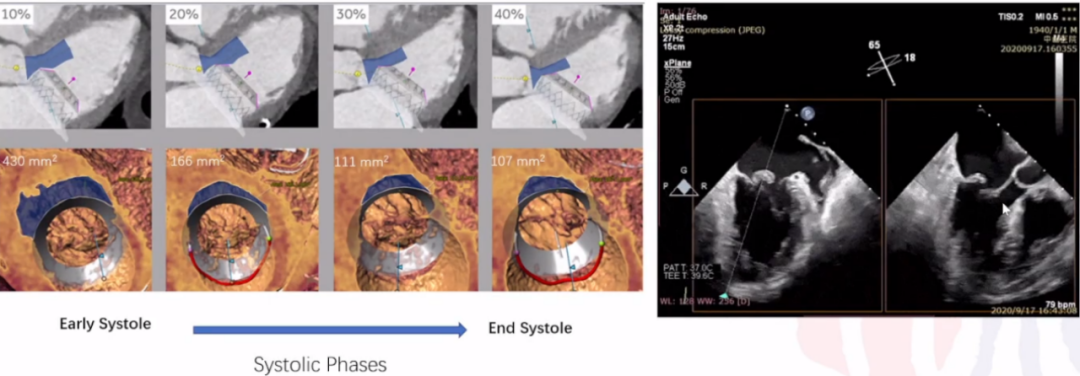
文献中关于neo-LVOT和TMVR的专家建议,LVOT 面积减少 35% 会导致 LVOT 压力梯度呈指数增加,并减少左心室排空,从而导致心输出量降低。将峰值压力梯度>30mmHg视为LVOTO,>50mmHg则视为具有血流动力学意义的 LVOTO。根据MVARC(二尖瓣学术研究联盟)标准,1.7-1.9cm2的neo-LVOT面积阈值可预测LVOTO,具有较高的敏感性和特异性。
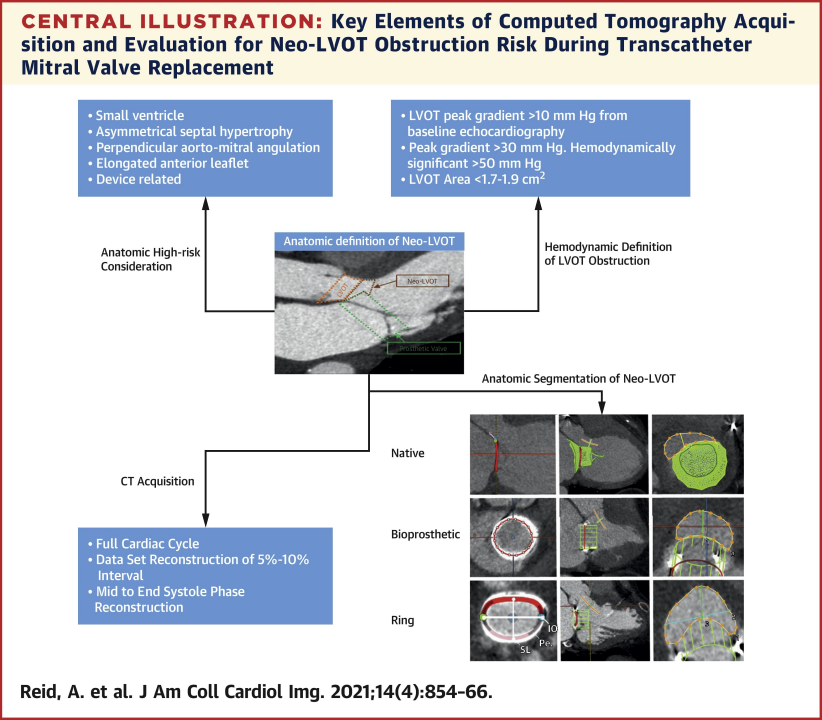
除了上述CTA外,LAMPOON和ShortCutTM Mitral Catheter方法也有应用降低左室流出道梗阻,但在临床中这一问题并没有完全解决,TMVR后LVOTO时有发生。目前临床还是严格筛选患者条件来预防这一并发症。
第三层挑战:瓣周瘘
解剖特点容易导致瓣周漏。二尖瓣环呈“马鞍形”的立体结构,不在一个平面;瓣环在收缩期舒张期有15%-20%的变化。
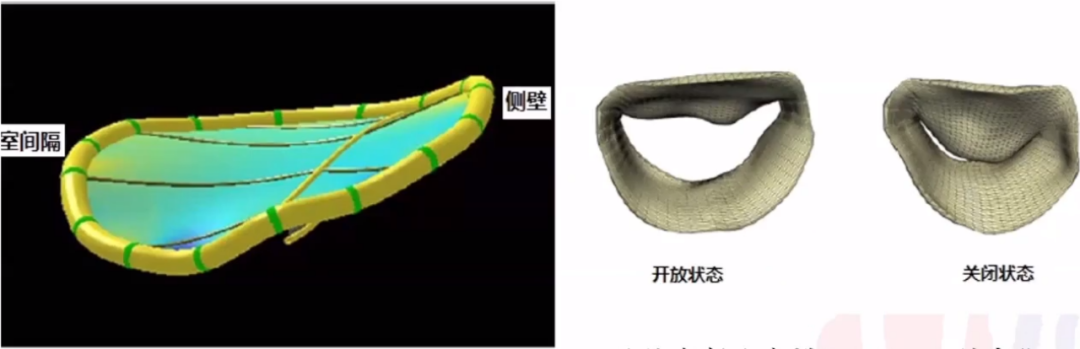
为了减少流出道梗阻,需要短瓣架及收腰设计,必然导致瓣周漏可能性增加。但对于患者而言不允许有瓣周漏存在,容易溶血。一旦溶血,难以自愈,导致顽固性贫血及肾功能不全。
第四层挑战:血栓与出血
根据现有的早期证据,血栓形成风险似乎与TMVR后相关,经导管心脏瓣膜 (THV) 血栓形成涉及多种机制,涉及程序、设备和患者相关因素。详细的术前筛查对于识别具有特别高血栓形成风险特征的患者和评估患者的个体出血风险非常重要。应考虑采用基于抗凝的抗血栓策略来预防 TMVR 后的 THV 血栓形成和血栓栓塞 (TE) 事件,根据个体出血和血栓风险情况调整规定的抗血栓方案的强度和持续时间。建议进行系列临床和影像学随访,以及时发现和治疗血栓性 THV 功能障碍。
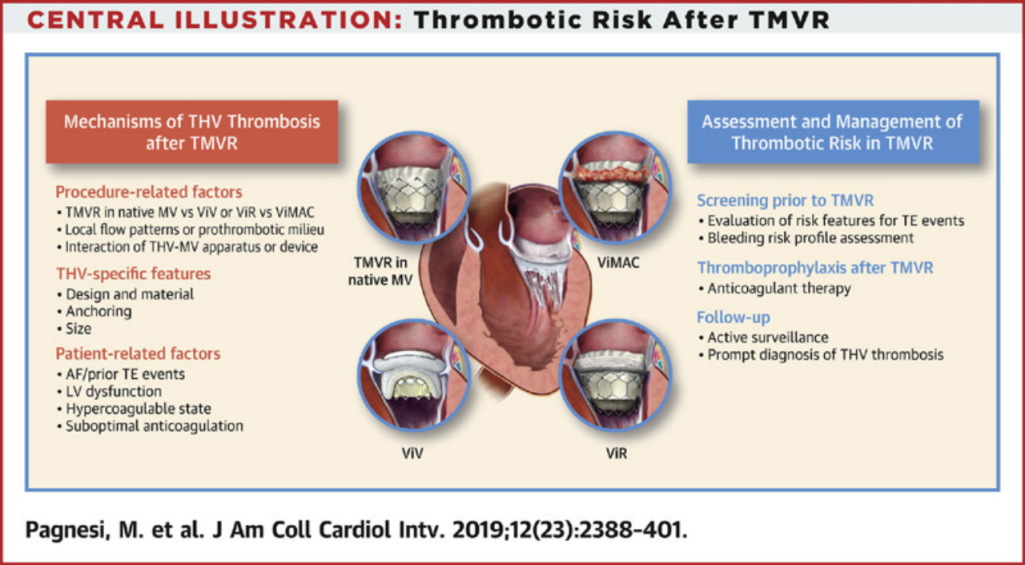
未来,需要专门研究来确定TMVR 后的最佳抗血栓形成策略。
第五层挑战:生物瓣衰败
生物瓣衰败方面,二尖瓣瓣膜耐久性较TAVR要求高。这是由于二尖瓣大瓣环,高压力,低吊桥,易衰败引起。
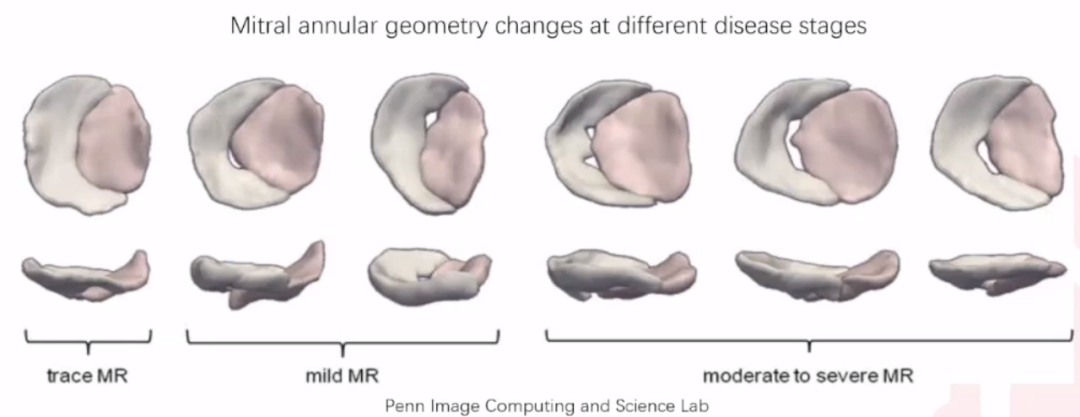
二尖瓣瓣环D型结构,且收缩预期变小15%,人工瓣膜支架受挤压变形后容易产生瓣中漏。

第六层挑战:心功能下降与心律失常
长期生存率低,心功能下降及心律失常是不能忽视问题。以下研究中30天时LVEF由术前47%±9.2%下降为41±9.5%(图左);30天时平均LVEF由术前43.6±12.1%下降为36.2±10.2%(图右)。
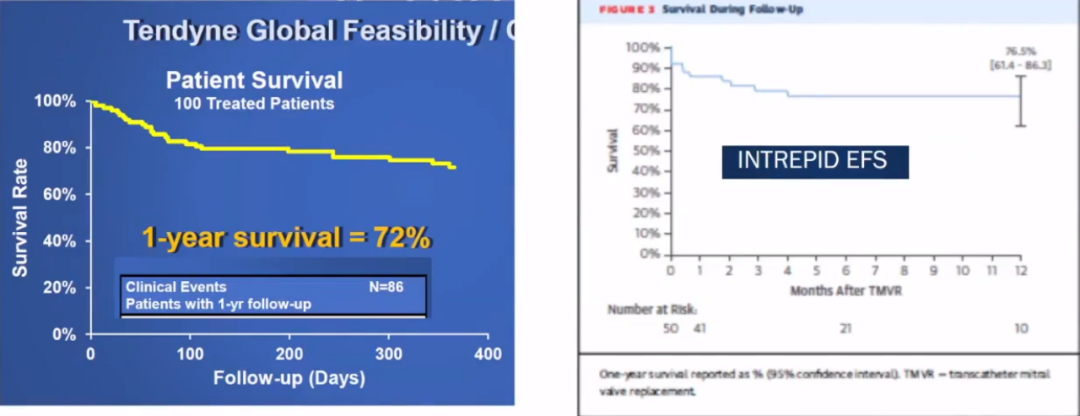
在Intrepid TM TMVR早期可行性研究结果中,输送尺寸大,实现经股难度极大,常引起血管出血。

目前来说,理想的TMVR技术需要达到四层效果:使MOA适应TS输送和解剖变异;面向真实世界解剖学的细化设计(已实现);微型化和输送系统研发;影像规划+指导的演变;但实际上只达到了一层效应,未来道路还很漫长。

发表留言
暂无留言
输入您的留言参与专家互动