JACC:Case Reports丨球扩瓣治疗自膨瓣衰败:需要个性化治疗方案

伴随着经导管主动脉瓣置换术(TAVR)的迅猛发展,逐渐衍生出了瓣中瓣(ViV)技术,是指采用微创介入方法在原来的“问题”瓣膜位置二次植入一个新瓣膜,从而恢复患者的生理功能。这种技术不仅减少了手术创伤和并发症的风险,还缩短了患者的住院时间和恢复时间,为患者带来极大获益。近期,《JACC:Case Reports》杂志报道了一例82岁患者经导管心脏瓣膜(THV)植入Evolut R自膨瓣,术后5年结构性瓣膜衰败(SVD),出现有临床症状的假体内主动脉瓣反流(AR),进行Redo-TAVR(二次TAVR)的病例。最初认为Redo-TAVR存在冠状动脉阻塞的高风险。研究采用系统的基于计算机断层扫描的方法,规划SAPIEN 3 Ultra THV低位植入,有效地降低了风险。

病例介绍
该患者为82岁男性,因接受THV植入26mm Evolut R瓣膜术后5年出现迅速进展的呼吸困难被转诊入院 (动图1)。入院时,体格检查发现心脏听诊有严重的AR杂音。经胸超声心动图(TTE)和经食道超声心动图(TEE)显示左心室射血正常,假体内反流严重,原因是无冠瓣完全脱垂。测量结果表明反流口面积为39 mm2,舒张末期反流为21 cm/s,心输出量增加至8.5 L/min。(图1,动图2)。
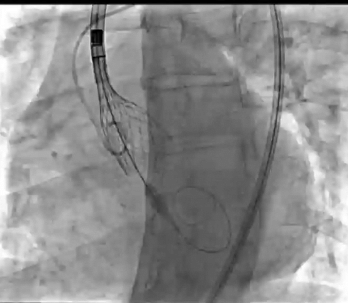
动图1:TAVR手术
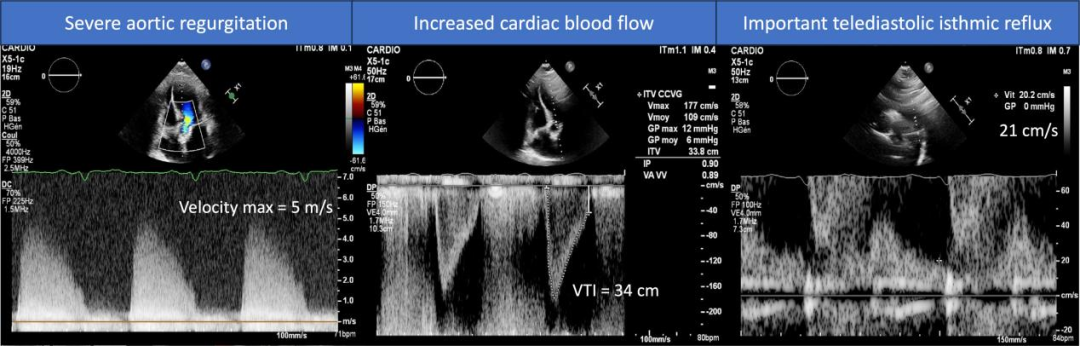
图1:TTE 评估AR的严重程度
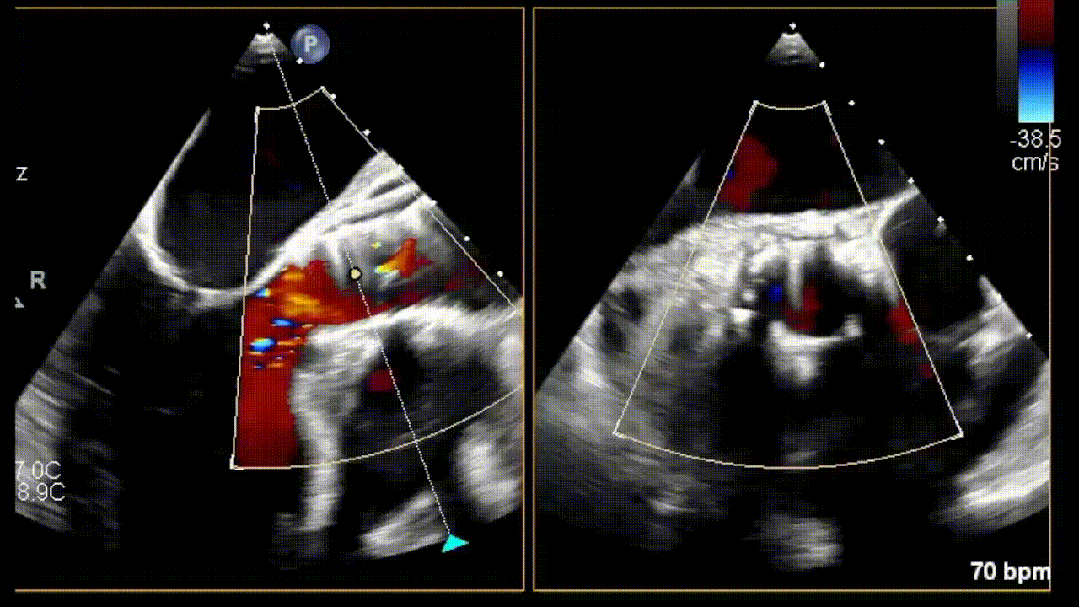
动图2:经TEE评估严重的AR而无明显的PVL
术前分析
术前冠状动脉造影证实患者无冠状动脉疾病。虽然术前TAVR CT对于术前规划至关重要,但我们没有进行该项检查。事实上,我们重点分析了TAVR术后数值,测量的流入段尺寸为18×21mm(面积=354mm2/周长= 63mm),腰部尺寸为 20×22.5mm(面积= 374mm2/周长=67mm)(图2)。此外,CT显示严重的交接错位(中央插图)。为了评估冠状动脉阻塞的风险,我们考虑投影风险平面,该平面根据第一个THV的设计和植入深度以及第二个短瓣架THV的设计和计划的Evolut节点植入水平(即低[节点4],中[节点5]或高[节点6])而变化(中央图,图3)。考虑到最小化冠状动脉阻塞风险的迫切需要,使用23mm SAPIEN 3 Ultra(S3U)球扩瓣进行低植入的Redo-TAVR(即,S3U THV流出段位于Evolut R THV节点4的水平)。该方法形成了17.1 mm的新裙边,有90%的脱垂,THV扩展0.5 mm。值得注意的是,突出的17.1mm新裙边位于冠状动脉口和窦管交界处的正下方(图 3)。

图2:Redo-TAVR术前CT分析

中央插图:CT 评估THV和冠状动脉阻塞风险

图3:根据不同的Sapien 3假体位置预测风险水平
手术过程
该手术包括经股动脉入路,植入S3U 23mm(Edwards)瓣膜,并使用局部麻醉。由于计划低位植入第二个THV,因此预计严重传导紊乱的风险很高。通过左股静脉插入临时起搏器实现起搏。采用导丝对左主干、右冠状动脉进行冠脉保护,作为二次THV定位的标志。通过将S3U THV流出段对准Evolut R THV第四节点的水平,策略性地将S3U THV植入低位,以最大限度地降低冠状动脉阻塞的风险。快速心室起搏后进行S3U THV瓣膜释放(动图3)。最终血管造影证实瓣膜植入良好,无渗漏或冠状动脉阻塞(动图4)。最终心电图显示窦性心律,无明显传导障碍;因此,起搏导联在手术结束时被移除。患者在手术后2天出院,第1天TTE显示无瓣周漏(PVL),最终残余平均压差为13 mmHg(图4)。Redo-TAVR术后仅使用阿司匹林进行单一抗血小板治疗,与目前的TAVR术后抗血栓策略类似。

动图3:S3 THV释放采用低位植入,针对Evolut THV节点4下的S3流出段,使用快速起搏。
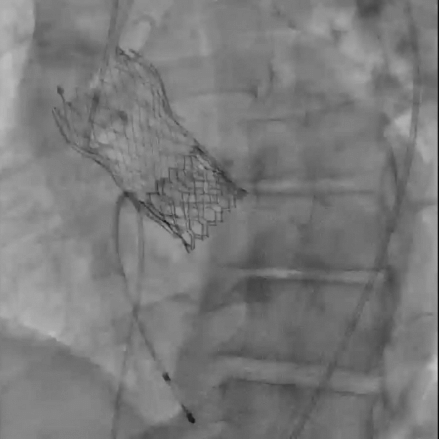
动图4:最终血管造影显示无PVL,无冠状动脉阻塞,无局部血管并发症。
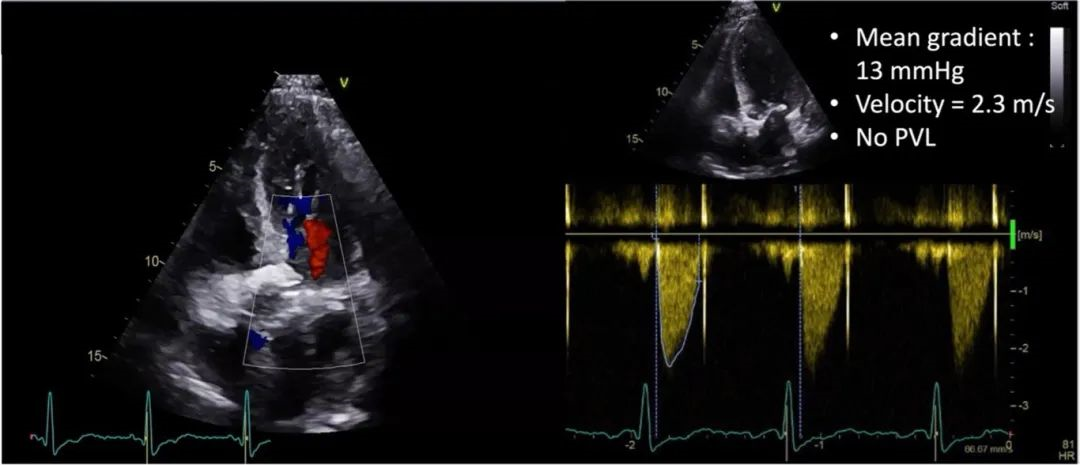
图4:出院前最后一次TTE
术后讨论
该患者由于结构性瓣膜恶化导致的症状性THV衰竭入院,首次TAVR后5年出现严重的假体内反流。无冠瓣脱垂导致严重的反流,尽管排除了心内膜炎,但确切原因仍不清楚。TAVR手术遵循标准方案,在瓣膜释放过程中没有出现并发症,只回收了一次瓣膜,目前与瓣叶退化风险增加无关。
THV失败的治疗方案包括外科THV植入或Redo-TAVR。虽然缺乏直接的随机比较,但注册数据表明,Redo-TAVR的30天和1年死亡率低于外科THV植入。鉴于患者的年龄和外科植入相关风险,我们选择了Redo-TAVR。事实上,考虑到Evolut THV在5年前植入,经过彻底的CT分析,存在潜在的卡压风险和可接受的冠状动脉闭塞风险,Redo-TAVR低植入第二个THV是最安全、最可行的选择。
这例复杂的Redo-TAVR病例强调了对于寿命较长的患者,在不影响首次THV植入结果的情况下,在首次植入前预测未来再次TAVR的可行性至关重要。仔细规划对冠状动脉再通路、瓣叶交界对齐和第一个瓣膜的最佳植入深度至关重要,以便进行潜在的Redo-TAVR。尤其对于年轻患者,平衡植入深度以避免传导障碍,同时确保再次植入的可行性至关重要。如果再次植入的可行性受到影响,则应重新考虑外科主动脉瓣置换策略。
在Redo-TAVR中,详细的术前CT分析对于评估主动脉根部解剖结构和了解THV的准确定位至关重要。正如最近的Redo-TAVR专家共识所推荐的,这种方法简化了TAVR后的CT分析,用于筛查和植入指导。事实上,如中央插图所示,该病例存在冠状动脉阻塞的高风险。为了降低这种风险,临床实践中有两种选择。第一种是使用专门的技术修改首次THV的瓣叶,例如生物假体或主动脉瓣叶故意撕裂以防止TAVR期间的医源性冠状动脉阻塞,但严重的交接错位和冠状动脉重叠无法采取这种策略。第二种选择是低位植入第二个THV,适用于瓣叶脱垂。因此,我们选择了第二种方案,并以基准模型研究为指导,该研究可以让我们深入了解最佳THV定位以及第二个THV与第一个THV之间的相互作用。在我们的案例中,在Evolut THV中使用 S3U THV进行Redo-TAVR需要将S3流出段与THV瓣架上的标志对齐,从而确保更好地评估预期的新裙边高度和瓣叶脱垂程度。
SVD的机制是假体内反流,但瓣叶脱垂对最终血流动力学的影响尚不清楚,因此就血流动力学结果而言,这是一种高风险手术。由于在Redo-TAVR之前未观察到 Evolut THV的梯度和瓣叶钙化,我们预计由于第一个THV的退化机制,第二个 THV不会受到狭窄影响,这一点后来得到证实。然而,瓣叶脱垂的演变及其对第二个THV血流动力学的影响有待进一步研究。
术后随访
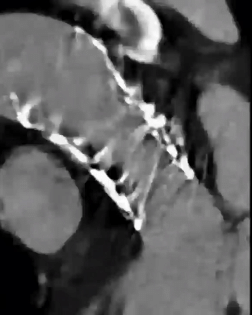
术后1个月,患者无症状。随访CT显示S3U THV位置良好,轻微扩张不足,表现出良好的瓣叶交界对齐,没有出现瓣叶增厚(图5)。此外,还观察到THV瓣叶退化部分生理性回缩(图6,动图5)。
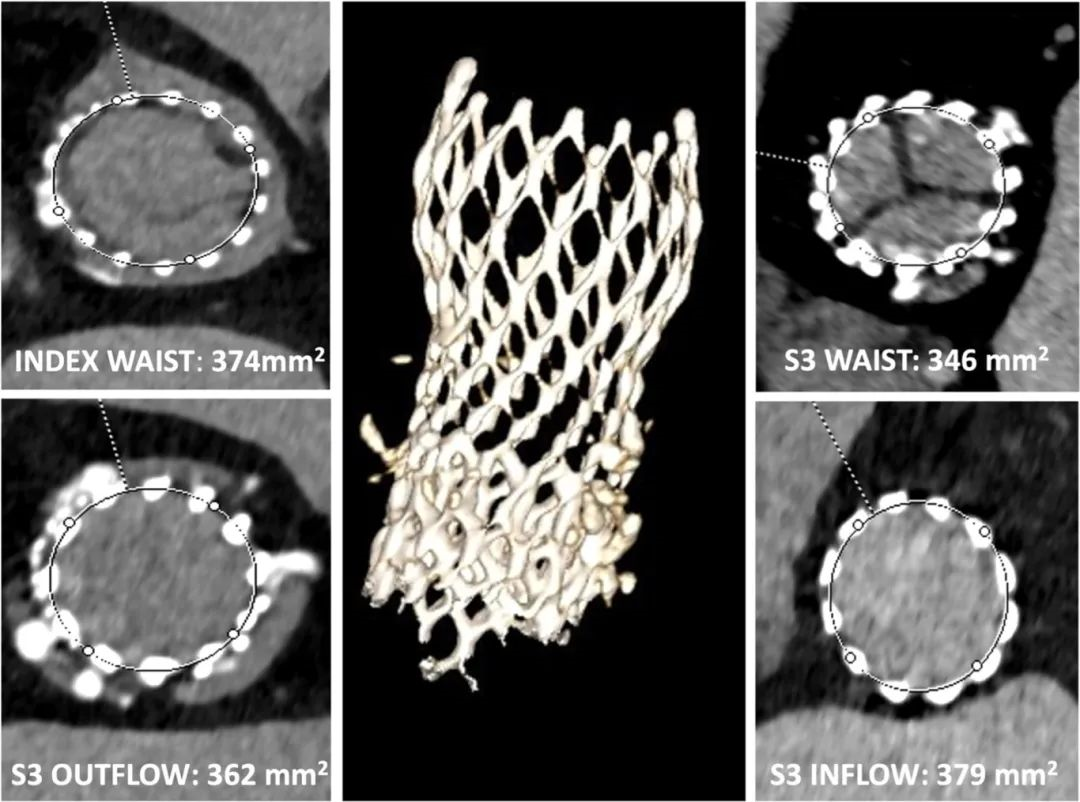
图5:Redo-TAVR后1个月的CT分析
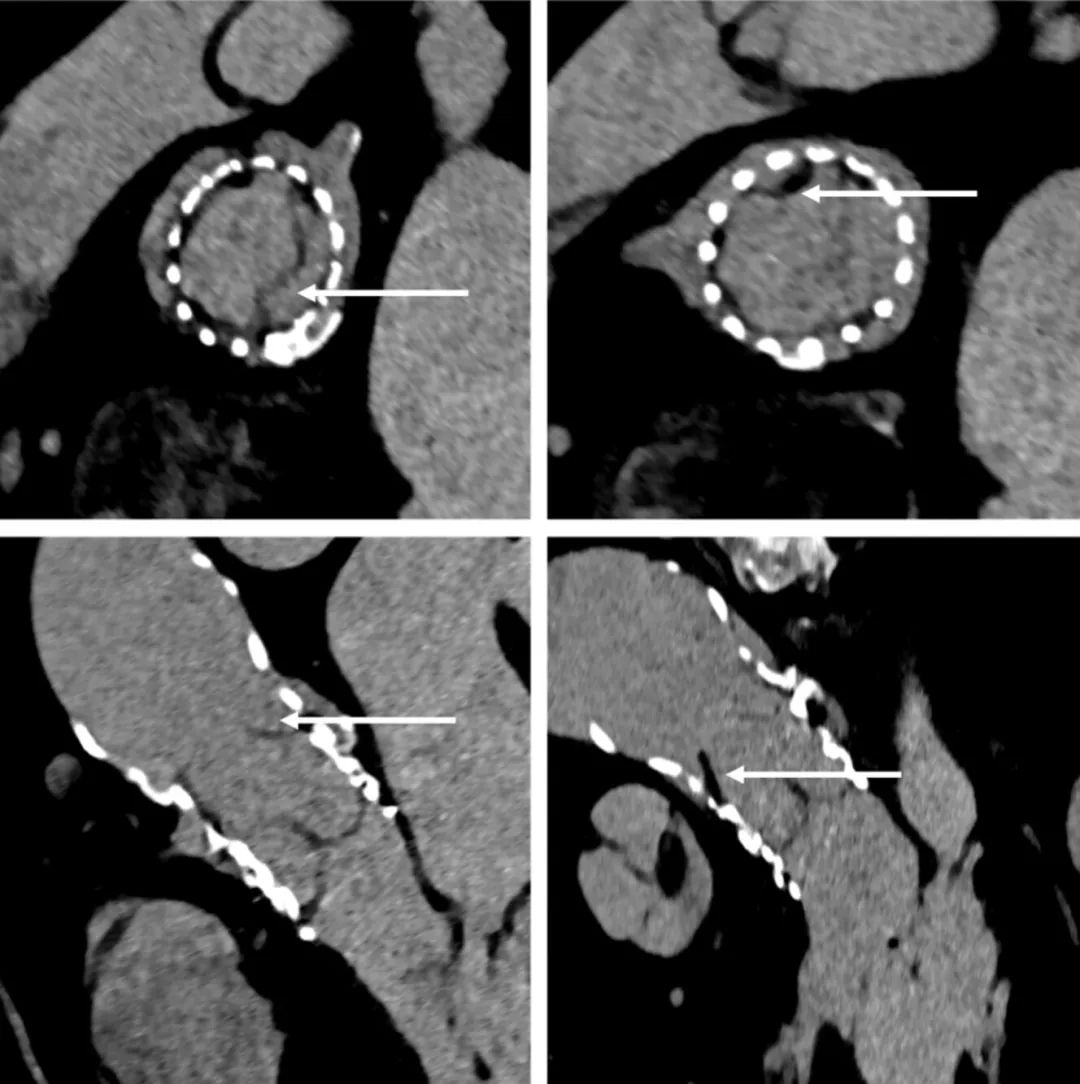
图6:1个月时瓣叶生理性回缩和部分回缩
动图5:CT显示术后1个月,THV失败的S3U伴瓣叶脱垂部分缩回。
研究结论
本病例凸显了THV植入失败后的挑战,强调了在全面的术前规划和模型研究的指导下,需要为患者量身定制手术策略。尽管早期预后最佳,但对于这些有结构性瓣膜恶化风险的患者,密切的临床随访和CT成像似乎是必不可少的。
本文为医谱学术原创文章,转载请标注来源
文献来源
https://www.jacc.org/doi/10.1016/j.jaccas.2024.102388
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系。



发表留言
暂无留言
输入您的留言参与专家互动