马凡综合征的诊断与管理

马凡氏综合征(MFS)是一种常染色体显性遗传、与年龄相关(即随年龄增长而进展)的结缔组织遗传性疾病,在骨骼、眼部和心血管系统中表现突出。MFS的多效性主要表现在主动脉根部动脉瘤、急性主动脉夹层、不成比例的长骨过度生长和晶状体异位(即眼球晶状体的移位或错位)。MFS是一种高度渗透性疾病,在家庭内和家庭间表现出很大变异性。20世纪90年代初,FBN1(编码细胞外基质糖蛋白原纤维蛋白-1)的致病变异被确定为MFS的病因。高达25%的FBN1致病变异是新发的,也就是说,突变对于患病个体来说是新发的。FBN1错义变异、插入和缺失以及与一个等位基因表达缺失相关的变异会导致MFS,并被证实会导致原纤维蛋白-1水平下降。原纤维蛋白-1是细胞外基质结构(称为微纤维)的主要成分,微纤维单独存在于组织中或与弹性蛋白纤维紧密相关。
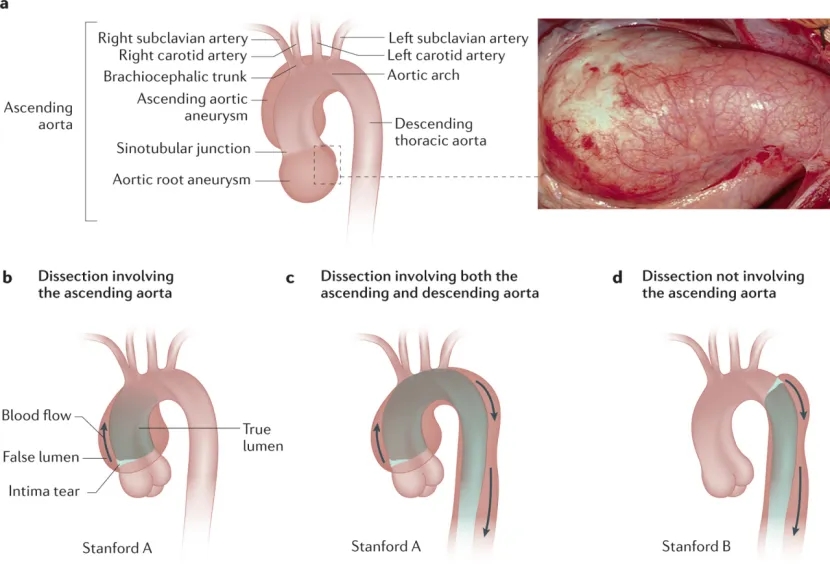
1955年,Victor McKusick建立了结缔组织疾病的第一个分类,其中包括MFS。MFS的主要表现之一是主动脉并发症(图1)。在大多数MFS患者中,胸主动脉疾病始于无症状的主动脉根部扩大,随着时间的推移逐渐形成动脉瘤(动脉壁变薄弱导致膨胀或扩张)。药物可以减缓扩大的速度,但不能阻止它。主动脉瘤随着扩大而变得不稳定,最终可能导致急性升主动脉夹层(Stanford A型夹层),这是一种危及生命的并发症,可能导致预期寿命缩短。A型主动脉夹层具有较高的发病率和死亡率,在主动脉手术出现之前,很大一部分MFS患者死于主动脉夹层并发症或破裂,大多数患者在45岁时死亡。目前,对MFS患者进行胸主动脉瘤的正确诊断和治疗可以预防大多数急性A型主动脉夹层,自1970年代以来,MFS患者的预期寿命已接近普通人群。值得注意的是,不到10 %的MFS患者患有B型夹层,这种夹层起源于左锁骨下动脉远端,通常沿降主动脉向下蔓延。
除了胸主动脉疾病外,MFS还会影响大多数患者的多个其他器官和组织。事实上,MFS的临床诊断需要识别全身存在的特征,并且可以通过或不通过FBN1致病变异基因检测进行。MFS最突出的全身特征包括晶状体异位和骨骼异常,包括身材高大、手臂和腿过长、关节异常灵活(包括足弓塌陷)、脊柱异常弯曲(脊柱侧凸)以及胸骨突出(鸡胸)或凹陷(漏斗胸)。在过去的二十年中,人们发现了MFS的其他相关特征,包括肺塌陷(气胸,即肺和胸腔之间的胸膜腔内空气异常聚集)、髋臼异常凹陷(髋臼突出)、椎管腰段扩大(硬膜扩张)和妊娠纹(条纹)。
MFS患者通常根据以下一种或多种情况被转诊从而被诊断:骨骼特征、晶状体异位、胸主动脉疾病或家族成员中致病变异的级联检测。骨骼特征通常可以作为诊断依据。如果骨骼或眼部并发症未能及时导致诊断,无症状和未被发现的主动脉根部动脉瘤最终可能发展为急性主动脉夹层,而出现夹层是另一个可以导致诊断的特征。在某些情况下,直到患者出现急性主动脉夹层时才诊断出MFS,这促使对FBN1进行测序并随后识别出致病变异。
MFS的诊断标准最近一次修订是在2010年,被称为Ghent II 疾病分类(BOX 2)。修订后的标准强调了心血管表现的存在,并纳入了FBN1测序。该标准强调,具有提示其他综合征的特征的个体,例如Loeys-Dietz综合征、Shprintzen-Goldberg综合征、先天性挛缩性蛛网膜指畸形、家族性胸主动脉瘤和夹层以及血管性Ehlers-Danlos综合征,需要通过基因检测排除这些诊断(表1)。值得注意的是,Ghent II 标准中评估骨骼过度生长的MFS诊断特征,例如胸骨畸形和脊柱侧弯,可能在个体完成骨骼生长后才能完全体现。

针对导致遗传性胸主动脉疾病的基因进行基因检测通常是诊断MFS患者最有用和最经济的选择。这些检测组对所有已确定的易患胸主动脉疾病的基因进行测序,包括FBN1,并且通常还包括对基因重复和缺失的评估。由于MFS的特征与Loeys-Dietz综合征的特征有很大的重叠,因此这些检测组可以通过识别FBN1中的致病变异来确认MFS的正确诊断。
主动脉表现
与MFS相关的最常见主动脉事件是主动脉根部(最靠近心脏的主动脉节段)扩张。主动脉根部扩张通常是对称的,并且仅限于主动脉根部,至少在疾病进展的初期是如此。主动脉根部扩张具有诊断价值,但正常的主动脉根部直径必须使用包括年龄、性别、身高和体重的列线图进行调整。主动脉根部扩张通常出现在最终被诊断为MFS的患者第一次超声心动图检查中,即使是在婴儿期进行检查。因此,任何接受MFS评估的患者,无论是儿童还是成人,都应接受超声心动图检查。接受药物治疗的儿童主动脉根部预期平均每年增加约0.5至0.8毫米,但在一年内可能高达3毫米。对于成人,主动脉根部平均生长较低,范围为0.3 至0.7毫米/年,男性和基线时主动脉根部较大的人的生长速度最快,且生长速度因治疗方案而异。因此,MFS患者的主动脉生长速度高于一般人群中未受影响个体的主动脉正常生长速度(每年0.1 毫米)。
除了诊断外,主动脉根部扩张的程度还包含重要的预后信息,特别是主动脉夹层的风险。主动脉根部直径是考虑进行预防性主动脉根部手术以防止急性升主动脉夹层的主要标准。除了主动脉根部(也称为Valsalva窦)的直径外,推荐预防性主动脉手术的标准还包括主动脉扩张率、主动脉夹层家族史以及主动脉瓣反流的严重程度。在成人中,主动脉瓣反流通常在主动脉根部直径大于5.0 cm时出现问题,因此,在诊断延迟、失访且发现主动脉根部直径较大或不遵守至少每年一次影像学检查建议的患者中可能会观察到主动脉瓣反流。
在患有MFS的患者中可以观察到管状升主动脉扩张,并且几乎总是与主动脉根部的显著扩张有关。管状主动脉的额外扩张被认为表明主动脉夹层的风险高于单独的主动脉根部扩张。在患有MFS的个体中,主动脉扩张在管状升主动脉水平上很少大于在主动脉根部,而这种表现在伴有二叶式主动脉瓣的主动脉扩张患者中更为常见。在患有MFS的患者中,涉及弓、降主动脉、胸腹主动脉和腹主动脉的原发性(非夹层)动脉瘤相对少见。升主动脉的最大直径(无论是在根部还是在管状升主动脉)用于确定预防性修复动脉瘤的时机,以防止急性A型主动脉夹层。在大多数情况下,夹层可以进一步蔓延到升主动脉的远端部分,并继续沿降主动脉向下延伸,或者血液可以向近端夹层破裂并破裂进入心包囊,大多数因夹层而突然死亡的人死于心包填塞。
MFS患者还存在发生主动脉夹层的风险,这种夹层起源于主动脉的其他部位,位于左锁骨下动脉起点远端,并沿降主动脉向下发展,称为B型夹层。这些夹层较少导致猝死,并且在夹层起源部位几乎没有或根本没有扩大。B型夹层可能发生需要手术的并发症,包括脊髓动脉灌注不良导致轻瘫和截瘫、内脏动脉灌注不良导致腹痛和主动脉破裂。已确认的一些B型主动脉夹层风险因素包括先前对根部和/或升主动脉进行预防性手术、降主动脉直径> 27毫米和肺动脉扩张。此外,主动脉曲折指数> 1(主动脉长度与主动脉起点和终点之间的线性距离之比)使B型夹层的风险增加12.1倍。由于B型夹层可能发生在主动脉根部直径正常的MFS患者或主动脉根部预防性修复后,因此应对所有MFS患者实施预防主动脉夹层的建议。
心脏表现
MFS还与心脏并发症有关。主动脉瓣环拉伸可能引起瓣叶对合不良以及主动脉瓣反流。这种表现通常与主动脉瓣尖脱垂和瓣尖对合开窗(卵圆形孔)相结合。一项针对MFS儿童患者(< 18岁)的研究发现,中度至重度主动脉瓣反流是主动脉根部生长和心血管事件(例如死亡、主动脉夹层和心脏瓣膜或主动脉根部手术)的独立预测因素。
二尖瓣脱垂(MVP)和二尖瓣反流(MVR)是MFS患者已确定的并发症。成人MFS患者的MVP患病率估计为40–68%(而普通人群为1–2%)。约32–38%的MFS儿童(<18岁)患有MVP,且患病率随年龄增长而增加。在大量患有MFS的儿童和年轻人中,女性MVP患病率高于男性。对于新生儿MFS,严重的二尖瓣脱垂伴有中度至重度MVR是出生时存在的主要并发症。一项基于人群的研究发现,MFS患者发生二尖瓣相关临床事件(心内膜炎、手术和心力衰竭)的风险增加28%,而特发性MVP患者的风险增加13%。MFS患者发生事件时的年龄也明显低于不伴有MFS的MVP患者(35岁vs. 65岁)。由于退行性二尖瓣疾病导致的严重二尖瓣反流在MFS患者中可以成功修复,但与一般人群中相同的手术相比,该手术通常更为复杂。最近发现,二尖瓣环分离(MAD)在MFS患者中非常普遍。MAD是严重疾病的标志,包括年轻时发生的主动脉事件和需要修复的二尖瓣疾病。
肺动脉扩张发生在患有MFS的儿童和成人中,与主动脉根部扩张、先前的主动脉根部手术、左心室射血分数降低和肺动脉收缩压升高有关。肺根部扩张的临床并发症很少见,并且可能仅与肺动脉压力升高有关。
5–30%的MFS患者死于心力衰竭,其根本原因是严重的瓣膜功能障碍和内在心肌功能障碍。不同系列中报告的“马凡心肌病”患病率为3%至68%。轻度心肌病通常不会随着时间的推移而发展,但如果出现其他血流动力学触发因素,如瓣膜功能障碍和/或主动脉根部置换术,则可能导致不良病程。多项研究报告称,MFS患者在终末期心力衰竭时需要进行心脏移植。
患有MFS的儿童和成人易患室上性心律失常和室性心律失常(即心律不齐),但这些心律失常并不总是与瓣膜异常有关。三项研究报告称,MFS患者中7–9%的人患有危及生命的室性心律失常,多达4%的人发生心脏骤停,这很可能是由于心律失常引起的。如上所述,与潜在的内在心肌功能障碍可能存在关联,这一发现支持了这一观点:血清NT-proBNP水平(因心肌损伤而升高)是MFS患者心律失常事件最强的独立预测因子。
骨骼表现
MFS与严重的肌肉骨骼异常有关,这是由于三个病理生理过程造成的。首先,管状骨的生长过度,导致手指(蜘蛛指)、腿部(导致不成比例的高大身材(肢体细长))和肋骨(导致漏斗胸或鸡胸)的延长(图4)。其次,韧带松弛导致关节过度活动,尤其是手指、肩膀、膝盖和脚踝,以及进行性脊柱变形(脊柱侧弯)。第三,某些部位的进行性变形导致髋关节凹陷(髋臼突出)以及腰椎和神经孔变薄和变宽(硬膜扩张)。此外,大多数患者比预期更早患上退行性关节炎。
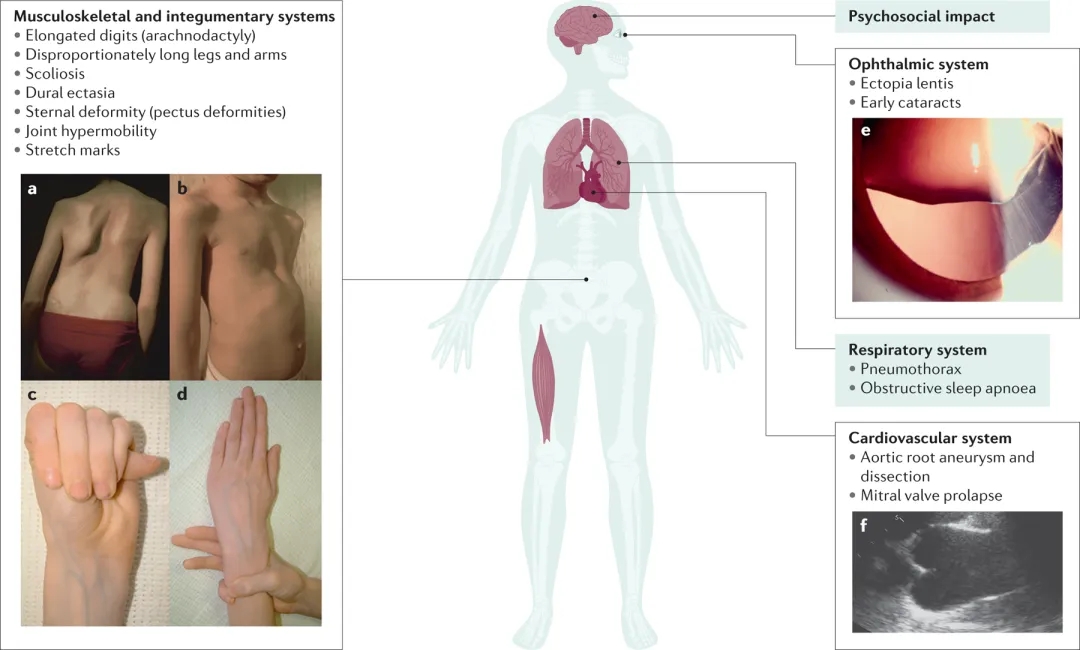
图4马凡综合征的临床表现。(图中显示了MFS的主要表现。A.脊柱侧弯或脊柱弯曲。B.胸壁畸形,如漏斗胸。蜘蛛指症,表现为拇指(C)和手腕(D)阳性体征。E.晶状体异位。F.经胸超声心动图在胸骨旁长轴视图中观察到的主动脉根部动脉瘤。)
眼部表现
MFS患者的眼部表现因突变和由此导致的疾病严重程度而异。具有MFS典型特征的患者在十岁之前就会出现晶状体和/或轴性近视,应转诊给眼科医生评估其近视程度。如果一只或两只眼睛的晶状体脱位,则应怀疑并根据Ghent II 标准确认MFS的诊断。在没有晶状体脱位的情况下,角膜直径增大、角膜散光、瞳孔缩小(瞳孔过度收缩)和虹膜发育不全可能提示患有MFS。约60%的MFS患者在其一生中会出现晶状体脱位,大多数患者在青少年时期被诊断出来,此时眼球发育完成,但晶状体脱位可能发生在70多岁晚期。角膜散光和晶状体散光都很常见且严重。弱视(懒惰眼)继发性斜视可能在生命的第一个十年出现,因为晶状体脱位通常是不对称的,导致受累较轻的眼睛偏向于弱视。早发性白内障是MFS患者的常见并发症。开角型青光眼和视网膜脱离是导致MFS患者视力丧失的并发症。对于患有最严重形式的MFS(新生儿MFS)的患者,出生时眼球通常会增大,角膜直径也会增大。
主动脉成像评估主动脉根部直径对于许多情况下诊断MFS以及在诊断后预防急性主动脉夹层都至关重要。经胸超声心动图(TTE) 在MFS患者的诊断、随访和管理中起着至关重要的作用。TTE是用于识别和连续随访根部和升主动脉生长的初始成像工具。关键的超声心动图测量是主动脉根部直径(在Valsalva窦水平)。在成人中,该测量标准是在舒张末期前缘至前缘并通过胸骨旁长轴视图垂直于主动脉长轴进行。85%–90%的MFS患者主动脉根部和升主动脉的直径是预测A型夹层的最佳危险因素(图5)。如果主动脉最大直径大于正常人群中考虑年龄、性别和体表面积时的参考值,则可诊断为主动脉根部扩张。目前已开发出各种具有正常上限或z分数方程(反映平均值的两个标准差的分数)的列线图,但临床界的共识是当BMI高于或低于正常范围时使用Campens提出的列线图和Devereux提出的列线图。成人z分数≥2或儿童z分数≥3被认为是异常。
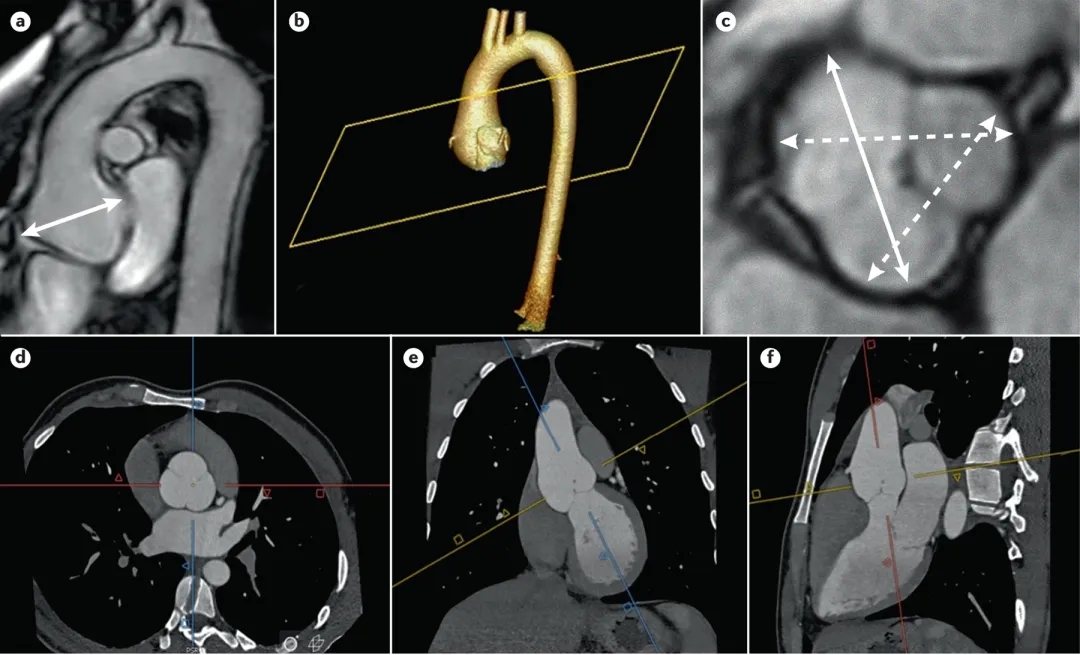
图5对患有MFS的个体进行胸主动脉疾病的影像学检查。a)胸主动脉的MRI显示主动脉根部动脉瘤(双箭头)。主动脉根部动脉瘤的CTA成像(d、e和f)的3D重建(b)。使用矢状面和冠状面图像获取双斜主动脉图像以实现与主动脉流的垂直性的方法可产生校正的主动脉腔真实横向图像;c)使用舒张末期瓣尖到瓣尖直径通过MRI测量主动脉根部动脉瘤。实线双箭头显示最大主动脉根部直径。)
在儿童中,主动脉测量采用“儿科方法”,即测量收缩期结构内壁到内壁的距离,这是美国超声心动图学会在儿科人群中推荐的方法。要确定儿科患者是否有主动脉根部扩张,应使用经过验证的z分数算法,z分数≥2定义为扩张。值得注意的是,儿童的z分数可能因模型而异,必须注意参考人群。
在初次诊断MFS时,通常建议进行CT或MRI额外成像,以确认TTE测量的主动脉大小是否准确,并评估远端升主动脉、主动脉弓和降主动脉节段,这些节段很少会扩大或慢性解剖。TTE在某些MFS患者中提供的图像质量不佳,主要是当存在明显的胸腔变形时,可能需要进行CT和MRI检查。CT和/或MRI并非儿童在诊断时普遍需要进行,但如果TTE质量不佳、主动脉尺寸接近手术阈值、主动脉生长迅速或怀疑近端主动脉以外有疾病,则建议进行CT和/或MRI检查。在初步监测后,建议在6个月时进行成像以评估主动脉根部扩大的速度。如果主动脉直径保持稳定且小于45毫米,每年进行一次主动脉成像是合理的。主动脉扩张迅速或主动脉直径>45毫米的患者应更频繁地重复进行主动脉成像。当TTE不能用于主动脉年度成像时,MRI优于CT,以限制辐射暴露。
需要经常干预的主要骨骼问题是前胸和脊柱畸形。漏斗胸(胸骨凹陷)很常见,而且通常不对称。随着肋骨的生长,畸形会加剧,一旦生长完成,就会变得不可逆转。手术修复的指征是临床上重要的肺活量减少(运动时呼吸困难)、心血管结构受压或需要升主动脉修复。对于没有结缔组织疾病的人来说,脊柱畸形(脊柱侧弯、异常后凸或前凸)会在骨骼生长过程中进展,并通常会随着成熟而稳定下来。在马凡氏综合征中,脊柱畸形很常见,并且可能在骨骼成熟后进展。这种进展在畸形严重(例如,脊柱侧弯弯曲度>30度)的个体中尤其可能出现。后果之一是腿长不一致。对于弯曲严重或进展迅速的儿童,应考虑使用外部支撑。当弯曲度超过40度时,应考虑手术固定脊柱畸形,现在可以使用可扩展杆在儿童和青少年中进行。
过去几十年来,由于MFS的DNA诊断和眼科技术的改进,MFS眼部特征的诊断和治疗有了显著改善。被诊断或怀疑患有MFS的患者应每年检查一次,如果出现并发症,则应更频繁地检查。如果晶状体脱位到无法通过晶状体矫正视力的程度,则必须仔细权衡摘除脱位晶状体的风险、益处和时机。脱位晶状体的手术摘除和眼内植入手术应由经验丰富的外科医生进行。高达10%的MFS患者会出现视网膜脱离,这可能是由于巩膜中的原纤维蛋白-1减少导致眼球变长而继发的。视网膜脱离需要尽早诊断,并可根据外科医生的指征通过激光手术、玻璃体切除术或巩膜扣带术进行治疗。
另一种严重的眼部并发症是青光眼,30%的患者一生中都会患上青光眼。每年的检查中都应怀疑患有青光眼,并积极治疗青光眼。它可以在任何年龄发展,并且最常伴有开角。确切的发病机制仍不清楚。晶状体溶解性青光眼也很常见。如果出现眼内炎症的迹象,则应摘除晶状体。
主动脉瘤发展为急性A型主动脉夹层是MFS患者死亡和发病的主要原因。定期进行影像学检查和改变生活方式是保护主动脉的第一步。低到中等水平有氧运动的休闲运动对所有人的身心健康都很重要,包括MFS患者。一般来说,大多数MFS患者应通过低强度(有氧)、低冲击的体育活动定期锻炼,这些活动可以根据他们的特定需求进行调整。建议进行非竞争性运动和以非剧烈速度或约50%的能力进行体育活动。建议避免接触性运动、剧烈的举重训练或等长运动。
药物治疗减缓主动脉生长的药物治疗和预防性主动脉瘤手术可防止A型夹层,从而延长MFS患者的寿命。β-肾上腺素受体阻滞剂具有血流动力学效应,可能对胸主动脉瘤疾病有益。这些药物可降低心脏的收缩力状态,降低射出的血液对主动脉的冲击力,主要用于降低心率和血压。因此,理论上,β-肾上腺素受体阻滞剂治疗可能对MFS患者有益,并降低主动脉破裂的风险。在一项长期开放标签随机试验中,对70名MFS年轻患者(入组时平均年龄为15岁)进行了普萘洛尔与无治疗的比较。经过10年的随访,接受普萘洛尔治疗的患者主动脉根部扩张率低于未接受该药物治疗的患者。一项回顾性、非随机研究显示,接受β受体阻滞剂治疗的MFS儿童患者的主动脉扩张速度比未接受该药物治疗的患者慢。在一项对417名MFS患者的研究中,接受β受体阻滞剂治疗的患者比未接受β受体阻滞剂治疗的患者存活时间更长。2010年AHA/ACC胸主动脉疾病指南建议对合并主动脉瘤的MFS患者给予β受体阻滞剂治疗,以降低主动脉扩张的速度,并建议患有高血压和胸主动脉瘤疾病的个人使用β受体阻滞剂治疗。
儿童需要药物治疗,因为研究表明药物可以减缓主动脉扩张,越早开始用药,效果越好。儿童药物治疗逐渐加量对于达到药物的治疗水平非常重要。对于β受体阻滞剂,加量目标可能包括心率降低20%或目标心率(较小儿童为70次/分,较大儿童和青少年为60次/分) ,同时避免出现明显的不良副作用。对于 ARB类药物,通常会在避免不良副作用的同时将剂量加定至目标剂量。青春期前滴定这些药物的一些策略还包括增加药物剂量,直到注意到主动脉根部z分数下降。总之,β受体阻滞剂和ARB在随机试验中耐受性良好。
主动脉成像诊断时需要评估整个主动脉,然后定期监测主动脉根部的生长情况。当CT或MRI测量的尺寸之间存在相关性时,TTE可用于对MFS和主动脉根部扩张患者进行连续影像学随访。然而,当图像质量不是最佳时,心电门控CT(与心电图波形同步数据采集)和MRI测量的最大主动脉直径的可重复性比TTE更好。CT、MRI或TTE测量的直径变化小于4毫米可能无法反映主动脉大小的真实变化(图4)。欧洲心脏病学会指南建议当主动脉直径每年增加> 3毫米时进行手术,而AHA指南规定每年增加> 5 毫米。在临床实践中,这些指征很少支持主动脉手术修复,因为MFS患者的主动脉根部直径扩张率随时间推移为每年< 0.5毫米。CT血管造影(CTA)是测量主动脉直径的首选技术,需要静脉注射造影剂来提供体积数据集,以便进行多平面和3D重建。
其他影像生物标志物正在被评估为MFS不良后果的预测因素。在主动脉扩张的早期阶段,MFS中已发现主动脉生物力学受损(通过主动脉扩张性评估),并且与进行性主动脉扩张有关。新兴技术4D流MRI可提供高级流信息,例如壁面剪切应力、血管僵硬性(基于脉搏波速度)、血流偏心率、脉搏波反射和湍流动能。
当需要进行择期手术时,应进行心电门控CTA检查,以获得准确的主动脉形态测量数据,包括准确的主动脉环和根部直径测量、胸壁异常的识别、手术入路的确定以及冠状动脉疾病的评估。此外,建议使用TTE监测外科治疗,尤其是David或Yacoub瓣膜保留主动脉手术,以排除大量残留主动脉瓣反流,并评估主动脉瓣反流的存在和严重程度、左心室功能和其他异常,如二尖瓣脱垂或大量二尖瓣反流。选择性主动脉根部置换术后,通常在6个月或一年内进行TTE和CT或MRI检查,以建立基线主动脉评估。后续主动脉成像的频率根据患者特征而个性化,例如所实施的手术类型和其他部位主动脉扩张的程度。连续的术后随访成像应关注影响原生主动脉的疾病进展和常见的术后并发症,包括假性动脉瘤和冠状动脉吻合口动脉瘤的发展。CT和TTE的结合可为诊断主动脉夹层及其并发症提供最佳信息。术中经食管超声心动图(TEE)有助于识别真腔和假腔之间的较大交通,并有助于指示主动脉置换的延伸-包括弓或近端降主动脉。
主动脉手术预防性手术切除主动脉瘤以防止急性A型夹层是延长MFS寿命的主要因素。在急性夹层中幸存下来的患者的长期生存率较低,主动脉夹层后重复主动脉手术干预更为常见。因此,在主动脉夹层或破裂之前进行主动脉瘤手术是治疗的目标。许多因素都会影响MFS中主动脉根部动脉瘤修复的手术阈值,其中主动脉直径是最重要的因素。2010年ACC/AHA/AATS胸主动脉疾病指南建议当主动脉直径达到或超过5厘米时对主动脉根部动脉瘤进行手术。当主动脉直径< 5 cm(但 ≥4.5 cm)时,有多种指征需要考虑进行预防性主动脉根部动脉瘤手术。这些指征可能包括有主动脉夹层家族史,且主动脉直径相对较小(< 5.0 cm)、主动脉快速生长(如果使用相同成像技术获得测量值,则每年>3 mm)、严重主动脉瓣反流、需要进行二尖瓣手术、既往有B型主动脉夹层、希望怀孕以及患者或外科医生的意愿(尤其是在考虑保留瓣膜的根部置换术时)。在共同决定主动脉根部置换术时机时,患者的年龄、性别、体型和身高也可能是需要考虑的重要因素。胸主动脉疾病指南建议,如果主动脉根部最大横截面积(以cm2为单位)除以患者身高(以m为单位)>10则进行手术。
目前尚无关于何时对儿童进行主动脉根部置换术的指南,尽管一些专家建议对大多数儿童采用与成人相同的指南。在以下任何一种情况下,当主动脉根部< 50 毫米时可能需要进行干预:计划进行另一次心脏手术、有主动脉根部< 50 毫米夹层的家族病史,或患者在非常年轻时(即< 5 岁)就达到40毫米。大多数年轻患者家属选择瓣膜保留手术,以避免出血并发症和终生抗凝治疗。
MFS中的主动脉根部置换手术通常包括两种主要手术之一:复合主动脉瓣移植(CVG;也称为Bentall手术)和使用再植入(David)技术的瓣膜保留根部置换(VSRR)手术。在某些情况下,在手术期间检查主动脉瓣叶时,决定进行VSRR还是CVG置换。适合VSRR的患者主动脉根部相对较小(<55毫米),主动脉瓣反流不重,手术检查瓣叶正常。当瓣叶有较大的开窗或严重的钙化和瘢痕形成时,主动脉瓣置换术可能是更好的选择。如果VSRR被认为不合适,则进行CVG。CVG包括用人工瓣膜(通常是机械瓣膜)和人工聚合物替换主动脉瓣。
随着亚急性和慢性B型夹层血管内治疗的引入,主动脉疾病的治疗已迅速发展。尽管目前仅推荐移植物对移植物血管内修复术用于MFS患者的非紧急主动脉修复,但进一步的改进可能会使血管内修复术得到更广泛的应用。正在进行的研究旨在进一步优化胸主动脉瘤修复时机以防止夹层。目前正在进行功能成像以了解主动脉壁的病理生理过程,以及四维成像以评估流动模式和壁应力。需要结合主动脉直径评估生物标志物,例如椎动脉弯曲度和分支动脉瘤的存在,以改善主动脉瘤修复时机以防止夹层。需要将遗传修饰因素纳入此评估中,包括进一步描述与特定FBN1致病变异和人类基因组中改变表型的其他变异相关的表型。
来源:中南医院心血管超声医学科
医谱app
扫码或者点击图片下载
微信公众号
扫码或点击图片关注
版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、上载、下载、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系



发表留言
暂无留言
输入您的留言参与专家互动