EHJ | 揭秘罕见的三联征——探寻反向Takotsubo心肌病、肺栓塞和嗜铬细胞瘤的内在关联

DOI:10.1093/ehjcr/ytaf574
面对急性胸痛伴低血压的患者,你的第一反应诊断是什么?急性心肌梗死?主动脉夹层?还是大面积肺栓塞?近期在EHJ上发表了这样一则罕见病例,患者因急性胸痛住院,并出现心率和血压的波动,抽丝剥茧的一系列检查后,发现了反向Takotsubo心肌病、肺栓塞和嗜铬细胞瘤三联征共存。
嗜铬细胞瘤是源于肾上腺髓质或副神经节、分泌过量儿茶酚胺的神经内分泌肿瘤,其临床表现多样且常呈阵发性,可涵盖高血压危象、心悸、头痛等。然而,以血压交替性波动、持续性低血压、反向Takotsubo心肌病及肺栓塞集中发生的患者极为罕见,对临床诊断与管理提出了重大挑战。
突发急性胸痛+血压剧动=急性冠脉综合征?
患者男性,68岁,因"急性胸痛、气促伴发热1天"入院。
入院查体:血压158/94mmHg,心率102次/分,体温37.7℃。心电图示V3-V6导联ST段压低。实验室检查:超敏肌钙蛋白T194ng/L(4小时后峰值456ng/L)。
初始经胸超声心动图示左室肥厚,射血分数保留(58%),但心室基底部及中间段运动减弱。左心室造影确认基底部及中间段无运动、心尖部运动正常,符合反向Takotsubo心肌病特征(图1A);冠状动脉造影未见显著狭窄(图1B,C)。
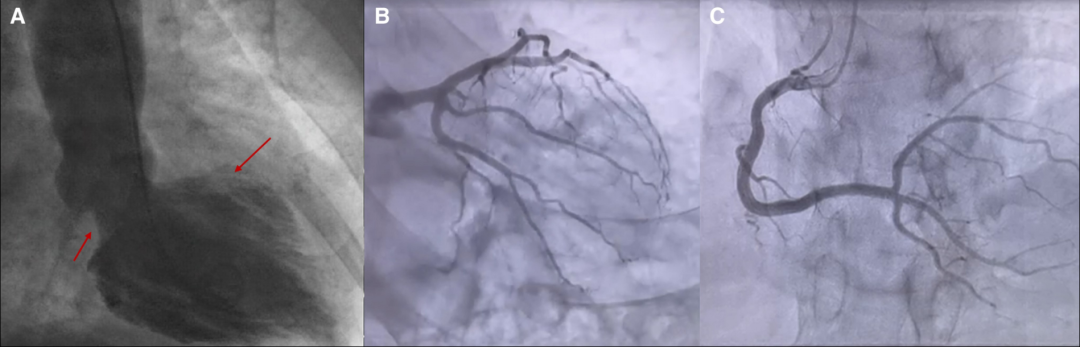
图1心脏室壁显像显示倒置(基底)takotsubo心肌病的特征性模式,顶段超动,基底左室壁运动减慢(A,箭头)。冠状动脉造影未显示阻塞性冠状动脉疾病(B和C)。
入院次日查D-二聚体3.72mg/L,CT肺动脉造影提示右下肺叶段支肺栓塞(图2A, B)。
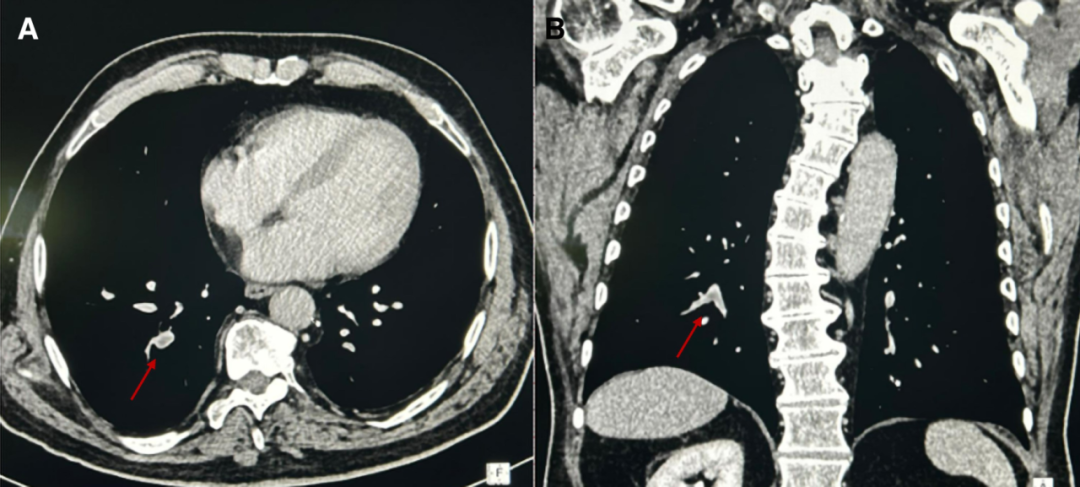
图2计算机断层扫描肺血管造影显示肺动脉段支气管多发充盈缺损,符合肺栓塞(A和B,箭头;冠状面和矢状面)。CTPA,计算机断层扫描肺血管造影。
同期CT意外发现右肾上腺5×3cm占位。后续监测中,患者出现血压剧烈波动(收缩压68-233mmHg)与心率变化(50-120次/分),呈现约2小时周期(图3)。其间曾发生血压达240/130mmHg的高血压危象,伴胸痛、大汗。
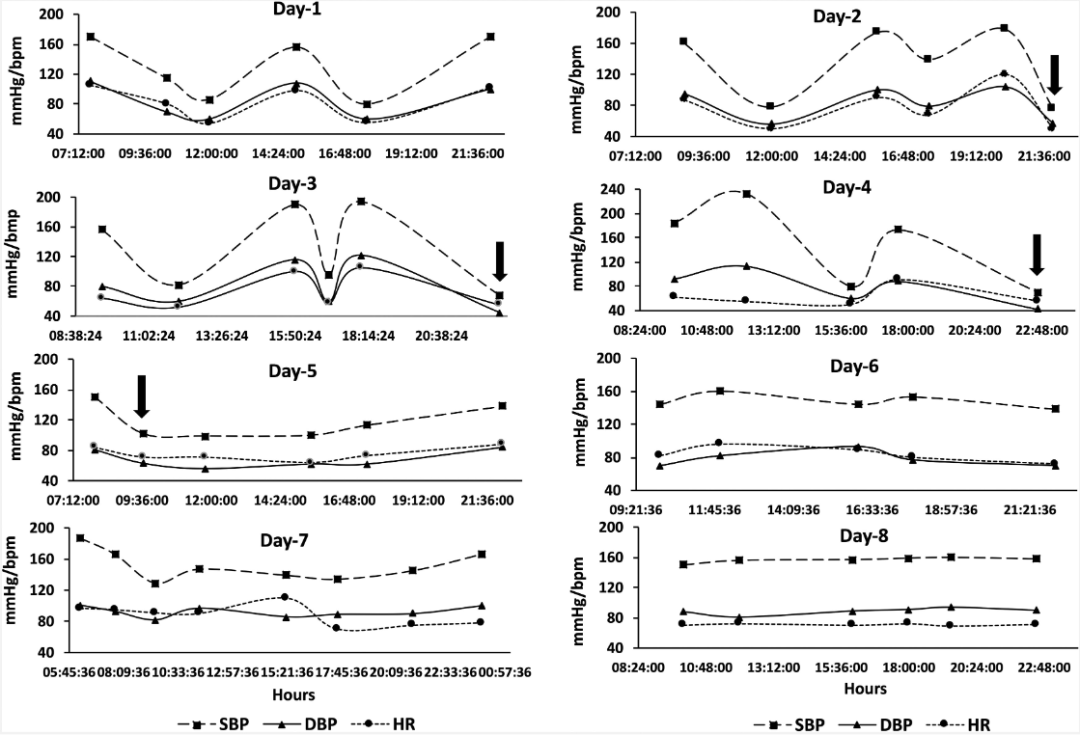
图3在第1至第8天期间,对血压(mmHg)和心率(b.p.m.)进行监测。在第2、3和4天,收缩压和心率显著降低(黑色箭头)。在开始α-阻滞剂和静脉输液治疗后,到第5天,收缩压、舒张压和心率的波动明显减少。在第6和第7天,血流动力学变异性仍然存在,但变得更加不频繁和不规则。在第8天,随着口服多沙唑嗪的使用,血流动力学得到了稳定。收缩压(SBP);舒张压(DBP);心率(HR)。
对于突发急性胸痛伴血压剧动,必须优先排除急性冠脉综合征,但这仅是鉴别诊断的开始,务必警惕主动脉夹层、肺栓塞、嗜铬细胞瘤危象等致命性疾病。
治疗策略的精准转向:
从急性冠脉综合征表象到嗜铬细胞瘤本质
对于患者的高血压危象,治疗团队初始采用静脉注射拉贝洛尔(100mg)处理,随后续以持续静脉输注乌拉地尔(12.5mg/小时)并联合每日3000mL生理盐水输注。该方案结合停用硝酸甘油、钙通道阻滞剂以及肾素-血管紧张素-醛固酮系统抑制药物(即沙坦类药物、螺内酯和呋塞米),最终使血压与心率的波动周期完全消失(图3,第5-8天)。
与此同时,计算机断层扫描显示右侧肾上腺存在异常。血液检查提示嗜铬粒蛋白A(258.6ng/L,正常值<108ng/mL)、皮质醇(27μg/dL,正常值<12 μg/dL)、糖化血红蛋白(45mmol/mol)及24小时尿变肾上腺素(2947 μg/24h,正常值<260μg/24h)水平升高。
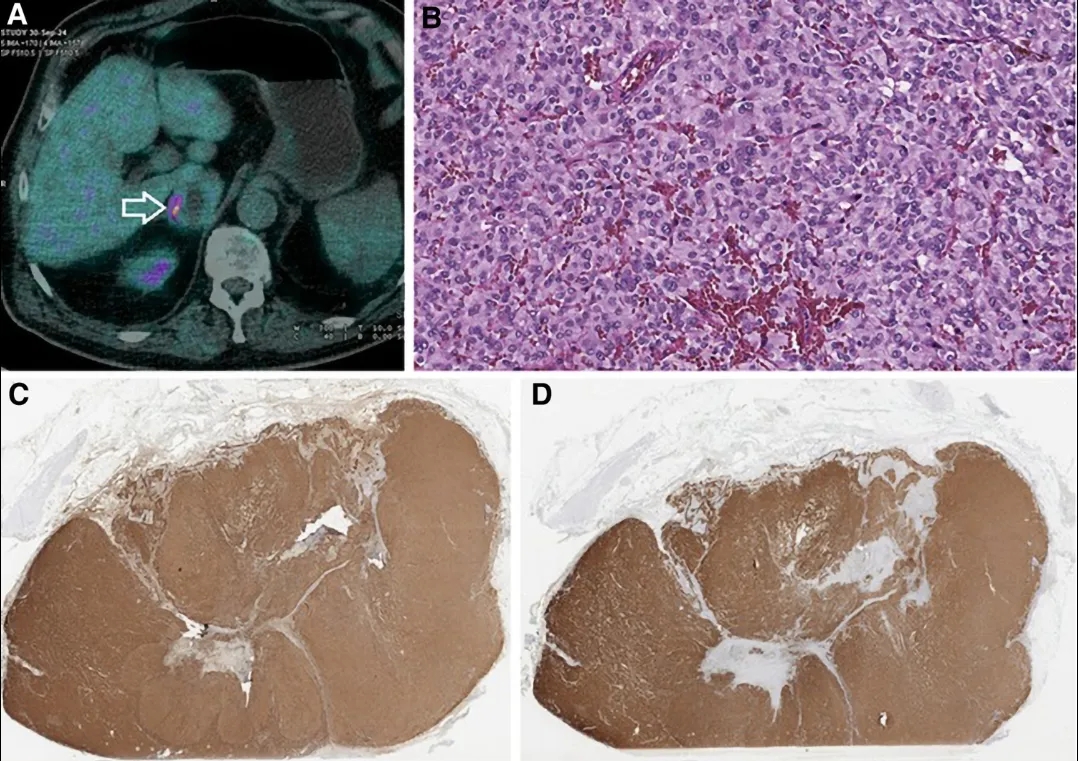
图4(A)F-18氟代多巴(¹⁸F-FDOPA)正电子发射断层扫描/计算机断层扫描(PET/CT)图像显示,右肾上腺(箭头所示)存在强烈的放射性示踪剂摄取,该表现符合嗜铬细胞瘤特征。(B)肾上腺肿块的组织病理学检查(H&E染色,×20)显示其呈小梁状(Zellballen)结构,由大量多角形肿瘤细胞构成,这些细胞具有圆形至卵圆形的细胞核、明显的核仁以及丰富的细胞质。(C)和(D)分别为免疫组织化学染色结果,显示肿瘤细胞胞浆分别对嗜铬粒蛋白A(C)和突触素(D)呈弥漫阳性表达。
在出院时,患者血压和心率恢复正常,并在3个月口服抗凝治疗后接受了腹腔镜右肾上腺切除术。腹腔镜手术后获取的组织病理标本呈现出典型的Zellballen结构,并通过免疫组化染色得到确证,得出了中度分化嗜铬细胞瘤(GAPP评分5分)的最终诊断。
诊断地图——三联征的发现到确诊
嗜铬细胞瘤危象的诊疗启示:
从血压剧动到根源破解
嗜铬细胞瘤(Pheo)的临床管理充满挑战,其典型特征为儿茶酚胺过量释放引发的血压波动。然而,更为棘手的是伴有显著血压波动的严重低血压情况,这在术前诊断阶段尤为罕见且处理极为困难。
本病例精准诠释了Pheo管理的核心原则。患者入院初期沿用原有降压方案反而诱发严重低血压,这揭示了在此类患者中避免使用血管扩张剂和RAAS抑制剂的必要性。关键的治疗转折在于识别出特征性的血压心率周期性波动后,立即调整策略:停用所有不当药物,启用具有α1受体阻滞和中枢交感抑制双重作用的乌拉地尔,并辅以充分容量管理。待血流动力学稳定后,逐步过渡到口服α阻滞剂多沙唑嗪,并严格遵循"先α后β"原则,在充分α阻滞后才加用小剂量β阻滞剂,有效避免了无对抗的β受体兴奋可能引发的危象。
诊断方面,通过冠状动脉造影排除缺血性心脏病,并根据心室基底部及中间段无运动伴心尖部保留的特征性表现,结合儿茶酚胺激增的临床背景,确诊为反向Takotsubo心肌病。这一诊断路径清晰展现了Pheo相关心脏并发症的辨识要点。更为特殊的一点是,本病例合并特发性肺栓塞,构成了罕见的临床三联征。肺栓塞的发生不仅体现了Pheo的高凝状态,其本身也可能通过加剧应激反应而成为反向Takotsubo心肌病的诱发因素,形成复杂的病理生理循环。
在临床实践中,面对反向Takotsubo心肌病这一颇具迷惑性的诊断时,我们必须培养一种更深层的警觉性。若患者表现出“高血压与低血压无规律交替”的血压剧烈波动,这绝非普通的血流动力学不稳定,而应被视为一个关键的诊断转折点,强烈指向潜在的嗜铬细胞瘤(Pheo)的可能。当病情进一步复杂化,例如合并了肺栓塞(PE)时,意味着我们面临的已不是一个孤立的器官问题,此时的临床管理复杂化、改变血流动力学状态,更增加了出血风险。对此类患者,必须组建高效协同的多学科团队(MDT),包括心内科医师、高血压专科医师及外科医师共同参与,为患者制定出安全、有效的个体化治疗方案。

扫码查看原文
本文为医谱学术翻译整理,转载请标注来源
-END-
专业的心血管医生学术交流平台


版权及免责声明:
本网站所发表内容知识产权归属医谱平台、主办方以及原作者等相关权利人,未经许可,禁止进行复制、传播、展示、镜像、转载、摘编等。经授权使用,须注明来源,否则将追究其法律责任。有关作品内容、版权和其他问题请与本网联系

发表留言
暂无留言
输入您的留言参与专家互动